
- •Глава 1. Строение и свойства материалов
- •1.1. Кристаллические и аморфные тела
- •1.2. Элементы кристаллографии
- •1.2.1. Кристаллическая решетка
- •1.2.2. Кристаллографические плоскости
- •1.2.3. Анизотропия
- •1.3. Влияние типа связи на структуру и свойства кристаллов
- •1.3.1. Взаимодействие частиц в кристаллах
- •1.3.2. Молекулярные кристаллы
- •1.3.3. Ковалентные кристаллы
- •1.3.4. Металлические кристаллы
- •1.3.5. Ионные кристаллы
1.3.3. Ковалентные кристаллы
Кристаллы, в которых преобладает ковалентный тип связи, называют ковалентными. Их образуют элементы IV, V, VI подгруппы В Периодической системы Д.И. Менделеева: углерод, кремний, германий, сурьма висмут и др. При взаимодействии атомы обобществляют свои валентные электроны с соседними атомами, достраивая таким образом валентную зону.
Каждая связь образуется парой электронов, движущихся по замкнутым орбитам между двумя атомами. Число атомов п, с которым: происходит обобществление электронов, зависит от валентности элемента и может быть определено по формуле п = 8 — N, где N — валентность элемента. Например, для углерода это число п = 4, т.е. атом углерода имеет четыре валентных электрона, посредством которых он образует четыре направленные связи и вступает в обменное взаимодействие с четырьмя соседними атомами.
В природе углерод встречается в двух кристаллических формах (рис. 1.11). Обе кристаллические решетки характеризует наличие у каждого атома четырех соседей. В сложной решетке алмаза все четыре соседа располагаются на одинаковом расстоянии от центрального атома (хорошо видно в элементе, показанном штриховой линией).
В слоистой ГП решетке графита один из четырех соседей (см. жирные линии на рис. 1.11) находится на значительном удалении. Между тремя атомами в плоскости основания решетки действуют ковалентные силы, а между основаниями — слабые силы Ван-дер-Ваальса. При деформации графита в первую очередь разрушаются связи между слоями, чем и объясняется низкая твердость графита. Коэффициент линейного расширения велик в направлении действия сил Ван-дер-Ваальса (см. табл. 1.2).
Ковалентная связь характеризуется направленностью. Вследствие этого атомы в ковалентных кристаллах укладываются некомпактно и образуют кристаллические структуры с небольшим координационным числом. Так, ГЦК решетка алмаза имеет координационное число 4 (К4).
Вследствие большой энергии связи ковалентные кристаллы характеризуются высокими температурами плавления.
Образование заполненных валентных зон при такой связи превращает ковалентные кристаллы в полупроводники и даже диэлектрики. Алмаз — диэлектрик. Хорошая электрическая проводимость графита объясняется заменой одной из четырех ковалентных связей металлической связью, в результате чего появляются свободные носители электрического тока.
Температурный коэффициент электрического сопротивления у ковалентных кристаллов имеет отрицательное значение, т.е. при нагреве электрическое сопротивление снижается. К ковалентным кристаллам относятся многие сложные кристаллические вещества, состоящие из разнородных атомов, например карбид кремния, нитрид алюминия и др.
1.3.4. Металлические кристаллы
Это кристаллы, в которых преобладает металлический тип связи. Их образуют элементы всех подгрупп А и I — III подгрупп В Периодической системы элементов. В металлическом кристалле при взаимодействии с элементами других групп атомы легко отдают свои валентные электроны и превращаются в положительные ионы.
При взаимодействии валентные энергетические зоны атомов перекрываются, образуя общую зону со свободными подуровнями. Это дает возможность валентным электронам свободно перемещаться в пределах этой зоны.
Таким образом, валентные электроны в металле нельзя считать потерянными или приобретенными атомами. Они обобществлены атомами в объеме всего кристалла в отличие от ковалентных кристаллов, в которых такое обобществление ограничено одной парой атомов.
Металлическая связь ненаправленная. Следствием этого является высокое координационное число и большая компактность кристаллических структур металлов. Как указывалось, большим координационным числом, характеризующим компактность решетки, обладают кристаллические структуры ГЦК и ГП. ГЦК решетку имеют такие металлы, как Ni, Ag, Си, Аи, Fe, Pt, A1 и Pb. ГП решетка встречается у многих металлов, но отношение с/а = 1,633, соответствующее сферической симметрии атомов, имеют лишь Mg и Со. Отклонение с/а от значения 1,633 объясняют наличием доли ковалентной связи и возникшей в результате этого несферической симметрии атомов. При расположении несферических атомов в кристалле своей большой осью вдоль оси z отношение с/а > 1,633 (Zn и Cd). При расположении атомов малой осью вдоль оси z отношение с/а < 1,633 (Be, Ti, Zr). ОЦК решетку имеют Fea, Cr, Mo, W, V, Та, Tip, Nb, Zr g. Такая структура не обладает большой плотностью упаковки.
Среди кристаллов распространено явление полиморфизма — способность в твердом состоянии при различных температурах (или давлении) иметь различные типы кристаллических структур. Эти кристаллические структуры называют аллотропическими формами, или модификациями. Низкотемпературную модификацию называют , а высокотемпературные — , , и т.д.
Стабильность модификаций при определенных температуре и давлении определяется значением энергии Гиббса:
G = H – ST (1.1)
В термодинамических расчетах температура приведена в Кельвинах, в остальных случаях — в градусах Цельсия.
Б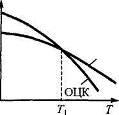 олее
стабильной при данной температуре
будет модификация, имеющая меньшее
алгебраическое значениеG,
что может быть достигнуто либо вследствие
уменьшения энтальпии H,
либо путем увеличения энтропии S
системы.
олее
стабильной при данной температуре
будет модификация, имеющая меньшее
алгебраическое значениеG,
что может быть достигнуто либо вследствие
уменьшения энтальпии H,
либо путем увеличения энтропии S
системы.
Рис. 1.12. Изменение G двух модификаций металла при нагреве.
В металлических кристаллах плотно-упакованные структуры ГП (К12) и ГЦК (К12) (рис. 1.12) вследствие меньшей энтальпии устойчивы при низких температурах (до Т\). Более «рыхлая» структура ОЦК (К8) имеет большую энтропию, а поэтому устойчива при повышенных температурах. Этим объясняется стабильность ОЦК решетки при высоких температурах во многих металлах Ti, Zr, Fe, U. Стабильность ОЦК решетки в железе при низких температурах связывают с возрастанием электронной составляющей энтропии. Температурным полиморфизмом обладают около тридцати металлов (табл. 1.3). Быстрое охлаждение может сохранить высокотемпературную модификацию в течение длительного времени при 20 ... 25°С, так как низкая диффузионная подвижность атомов при таких температурах не способна вызвать перестройку решетки.
При нагреве до 2000°С и давлении ~ 1010 Па углерод в форме графита перекристаллизуется в алмаз. При очень больших давлениях в железе обнаружена низкотемпературная модификация с ГП решеткой.
Рост давления может приводить к превращению при низких температурах менее плотноупакованных модификаций в плотноупакованные структуры. В Ge, Si и Sn при больших давлениях обнаружено превращение ковалентных кристаллов с решеткой алмаза (К4) в металлические кристаллы с тетрагональной объёмно-центрированной решеткой (К8).
Энергия металлической связи несколько меньше, чем ковалентной, поэтому металлы в большинстве случаев по сравнению с ковалентными кристаллами имеют более низкие температуры плавления, модуль упругости, но более высокий температурный коэффициент линейного расширения.
Для большинства случаев с увеличением энергии связи Есв растут температура плавления tпл, модуль упругости Е, энергия активации самодиффузии Едиф, а коэффициент линейного расширения , наоборот, уменьшается (табл. 1.4). Закономерность обнаружена экспериментально и имеет ряд исключений: аномально завышен модуль упругости у бериллия,
Таблица 1.3.
Кристаллическая структура полиморфных металлов
|
Металл |
Кристаллическая структура |
Температура существования данной модификации, °С |
|
Титан |
ГП |
До 882 |
|
ОЦК |
882-1668 | |
|
Цирконий |
ГП |
До 862 |
|
ОЦК |
862-1852 | |
|
Олово |
Алмазная |
До 13 |
|
ТОЦ |
13-232 | |
|
Уран |
Ромбическая |
До 663 |
|
ТОЦ |
663-764 | |
|
ОЦК |
764-1130 | |
|
Железо |
ОЦК |
До 911 |
|
ГЦК |
911-1392 | |
|
ОЦК |
1392-1539 | |
|
Кобальт |
ГП |
До 477 |
|
ГЦК |
477-1490 |
Таблица 1.4.
Энергия межатомной связи и свойства металлов
|
Металл |
Есв, кДж/моль |
tпл, °C |
106,°C-1 (25-100°C) |
E, ГПа |
q, кДж/моль |
, г/см3 (25 °С) |
|
Mg |
151 |
650 |
26 |
45 |
134 |
1,7 |
|
А1 |
232 |
660 |
24 |
71 |
142 |
2,7 |
|
Си |
340 |
1083 |
16 |
121 |
197 |
8,9 |
|
Be |
- |
1284 |
12 |
310 |
160 |
1,8 |
|
Fe |
396 |
1539 |
12 |
214 |
250 |
7,8 |
|
Ti |
419 |
1665 |
9,9 |
112 |
122 |
4,5 |
|
Zr |
460 |
1852 |
9,6 |
70 |
92 |
6,5 |
|
Сг |
- |
1875 |
6,2 |
280 |
310 |
7,1 |
|
V |
- |
1919 |
8,7 |
135 |
398 |
6,1 |
|
Nb |
- |
2468 |
7,2 |
124 |
398 |
8,6 |
|
Mo |
670 |
2625 |
5,1 |
334 |
424 |
10,2 |
|
Та |
- |
3000 |
6,5 |
185 |
460 |
16,6 |
|
W |
880 |
3410 |
4,4 |
420 |
500 |
19,3 |
что позволяет использовать его сплавы как материалы повышенной жесткости; титан и цирконий имеют заниженные значения не только модуля упругости, но и энергии активации самодиффузии (последнее объясняет их пониженную жаропрочность).
Вследствие ненаправленности металлической связи и образования плотноупакованных структур металлические кристаллы более пластичны и менее тверды, чем ковалентные. Хорошая электрическая проводимость обеспечивается наличием у них свободных подуровней в валентной энергетической зоне. Температурный коэффициент электрического сопротивления у металлических кристаллов имеет положительное значение, т.е. электрическое сопротивление при нагреве растет.
