
- •Глава 1. Строение и свойства материалов
- •1.1. Кристаллические и аморфные тела
- •1.2. Элементы кристаллографии
- •1.2.1. Кристаллическая решетка
- •1.2.2. Кристаллографические плоскости
- •1.2.3. Анизотропия
- •1.3. Влияние типа связи на структуру и свойства кристаллов
- •1.3.1. Взаимодействие частиц в кристаллах
- •1.3.2. Молекулярные кристаллы
- •1.3.3. Ковалентные кристаллы
- •1.3.4. Металлические кристаллы
- •1.3.5. Ионные кристаллы
1.2. Элементы кристаллографии
1.2.1. Кристаллическая решетка
В кристалле частицы (ионы, атомы, молекулы), из которых он построен, сближены до соприкосновения и закономерным образом располагаются относительно друг друга (рис. 1.2, а). Для упрощения пространственное изображение частиц заменяют схемой (рис. 1.2, б), на которой вместо шаров отмечены точки - центры тяжести частиц.
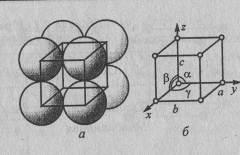
Рис. 1.2. Расположение частиц в кристалле:
а - пространственное изображение; б - схематическое изображение
Через эти точки (центры тяжести) проводят три оси х, у, z, не лежащие в одной плоскости, расстояния между точками, расположенными по этим осям, обозначают соответственно а, b и с (в общем случае они неодинаковы) – их называют периоды решётки. Углы между осями обозначают (между y и z), (между x и z) и (между x и y), в общем случае они также неодинаковы. Плоскости, проведённые через центры тяжести, вместе с координатными плоскостями (x и y, y и z, x и z) образуют параллелепипед, его называют элементарной ячейкой.
Весь кристалл можно представить состоящим из множества таких вот элементарных ячеек, равных и параллельно ориентированных. Говорят, что пространственную кристаллическую решетку можно получить путём последовательного перемещения одной элементарной ячейки во всех направлениях.
Как уже отмечалось, для описания элементарной ячейки кристаллической решетки используют шесть величин: три отрезка, равные расстояниям а, b, с до ближайших частиц по осям координат, и три угла , и между этими отрезками. В зависимости от соотношения между этими величинами все кристаллы подразделяют на семь систем, отличающихся симметрией. Эти системы классифицированы в табл. 1.1.
Таблица 1.1.
Кристаллические системы
|
Система |
Периоды |
Углы |
|
Триклинная |
a b c |
|
|
Моноклинная |
a b c |
= = 900 900 |
|
Ромбическая |
a b c |
= = = 900 |
|
Ромбоэдрическая |
a = b = c |
= = 900 |
|
Гексагональная |
a = b c |
= = 900 = 1200 |
|
Тетрагональная |
a = b c |
= = = 900 |
|
Кубическая |
a = b = c |
= = = 900 |
В большинстве случаев решетки имеют сложное строение, так как частицы находятся не только в узлах, но и на гранях или в центре решетки (рис. 1.3). О степени сложности судят по числу частиц, приходящихся на одну элементарную ячейку. В простой пространственной решетке (см. рис. 1.3-а) всегда на одну ячейку приходится одна частица. Действительно, в каждой ячейке имеется восемь вершин, частица в каждой вершине одновременно принадлежит восьми ячейкам. Т.е. на долю каждой ячейки приходится 1/8 часть частицы, а всего частиц в ячейке восемь. Следовательно, на ячейку приходится одна частица.
В сложной пространственной решетке на одну ячейку приходится больше одной частицы. Так, на т.н. объемно-центрированную ячейку (см. рис. 1.3-б) приходятся две частицы: одна от вершин (как в простой), а другая расположена в центре - она относится только к рассматриваемой ячейке. В гранецентрированной ячейке (см. рис. 1.3-в) имеются четыре частицы: одна от вершин и три от шести граней: частица, находящаяся в центре каждой грани одновременно относится к двум ячейкам.
Система, периоды и число частиц, приходящихся на элементарную ячейку, полностью определяют расположение частиц в кристалле. Дополнительными характеристиками кристаллической решетки являются координационное число и коэффициент компактности. Координационное число К – это число ближайших равноудаленных частиц в кристаллической решётке. Например, в объемно-центрированной кубической решетке (ОЦК) для каждой частицы число таких соседей равно восьми, т.е. К = 8. Для простой кубической решетки координационное число 6 (К = 6), для гранецентрированной кубической решетки (ГЦК) — 12 (К = 12).
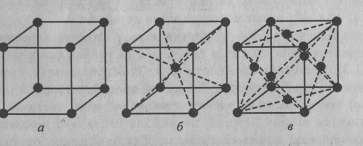
Рис. 1.3.Типы элементарных ячеек кристаллических решеток: а - простая; б, в - сложные

Рис. 1.4. Октаэдрические (а) и тетраэдрические (б) поры в металлах с ГЦК решеткой
Коэффициент компактности - отношение объёма частиц, расположенных в элементарной ячейке, ко всему объёму ячейки. Для кубической решетки его значение равно 0,52, для ОЦК 0,68 и для ГЦК 0,74.
Оставшееся пространство образуют поры. В случае ГЦК различают октаэдрические и тетраэдрические поры, на рис. 1.4 центры этих пор показаны маленькими точками. Радиус октаэдрической поры составляет 0,41, а тетраэдрической поры — 0,22 радиуса частицы.
Для многих металлов характерна плотная упаковка частиц. Если частицы изобразить в виде шаров – во многих случаях это справедливо, так как они обладают шаровой симметрией, то при упаковке получаются структуры, показанные на рис. 1.5.
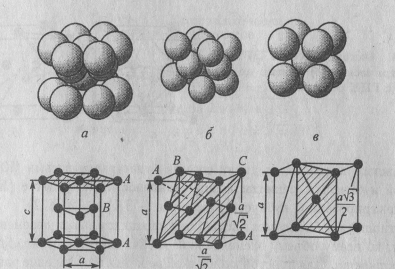
Рис. 1.6. Различные виды плотной упаковки шаров и элементарные ячейки кристаллических решеток: а, г - ГП; б, д - ГЦК; в, е - ОЦК
На первый слой шаров, обозначенных А, в лунки накладывается второй слой шаров, обозначенных В. Для следующего слоя шаров возможны два варианта: если шары укладываются над первым слоем, то получающуюся решетку называют гексагональной плотноупакованной (ГП); если третий слой шаров С укладывается на второй в его лунки и только четвертый слой повторяет первый слой шаров, то получается ГЦК решетка.
Шестигранная призма на рис. 1.6 изображает ГП кристаллическую решетку. Однако элементарной ячейкой здесь является элемент, выделенный жирными линиями: а = б с; = = 90°; = 120°. Исходя из чисто геометрических соображений, можно определить отношение периодов с/а, если частицы обладают сферической симметрией. Оно равно 1,633.
При отклонении частиц от сферической симметрии возможно образование гексагональных структур с отношением периодов, отличающихся от 1,633, а также ОЦК структур (см. рис. 1.6).
