
- •Глава 1. Строение и свойства материалов
- •1.1. Кристаллические и аморфные тела
- •1.2. Элементы кристаллографии
- •1.2.1. Кристаллическая решетка
- •1.2.2. Кристаллографические плоскости
- •1.2.3. Анизотропия
- •1.3. Влияние типа связи на структуру и свойства кристаллов
- •1.3.1. Взаимодействие частиц в кристаллах
- •1.3.2. Молекулярные кристаллы
- •1.3.3. Ковалентные кристаллы
- •1.3.4. Металлические кристаллы
- •1.3.5. Ионные кристаллы
1.3. Влияние типа связи на структуру и свойства кристаллов
1.3.1. Взаимодействие частиц в кристаллах
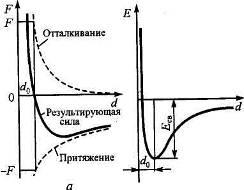
Частицы в кристалле сближаются на определенное расстояние, которое обеспечивает кристаллу наибольшую термодинамическую стабильность. Это расстояние d0 определяется равенством сил притяжения и отталкивания между частицами, при этом достигается минимум энергии связи, что и делает кристалл термодинамически стабильным.
б
 рирода
сил притяжения определяется природой
частиц, составляющих кристалл. Так, в
случае молекулярных кристаллов (см.
ниже) - это силы Ван-дер-Ваальса
(ориентационные, индукционные и
дисперсионные). В ионных кристаллах -
это силы электростатического взаимодействия
катионов и анионов.
рирода
сил притяжения определяется природой
частиц, составляющих кристалл. Так, в
случае молекулярных кристаллов (см.
ниже) - это силы Ван-дер-Ваальса
(ориентационные, индукционные и
дисперсионные). В ионных кристаллах -
это силы электростатического взаимодействия
катионов и анионов.
Природа сил отталкивания имеет электростатических характер, это взаимодействие одноимённых зарядов – электронных орбиталей друг с другом и соседних атомных ядер. Силы отталкивания проявляются при сильном сближении частиц и растут интенсивнее, чем силы притяжения (рис. 1.8).
Рис. 1.8. Изменение силы (а) и энергии взаимодействия (б) при сближении атомов в кристалле.
Тип связи, возникающий между частицами в кристалле, определяется их электронным строением. Энергия связи для различных кристаллов приведена ниже:
|
Кристалл |
Аг СН4 |
Алмаз SiC |
LiF NaCl |
Fe Na |
|
Энергия, кДж/моль |
7,5 10 |
750 1180 |
1000 750 |
390 110 |
|
Тип связи |
Молекулярная |
Ковалентная |
Ионная |
Металлическая |
Она определяет температуру плавления, модуль упругости, температурный коэффициент линейного расширения и др.
При сближении атомов в металлическом кристалле энергетические подуровни превращаются в зоны, которые, перекрываясь, делают возможным обмен и обобществление валентных электронов. Плотность заполнения электронами валентных зон определяет электрические и тепловые свойства кристаллов.
Наличие незаполненных подуровней в валентной зоне металлических кристаллов обуславливает их высокую электрическую проводимость.
При полном заполнении валентной зоны переход электронов возможен только в том случае, если они сумеют преодолеть зону запрещенных энергий и перейдут в зону более высоких энергий, имеющую свободные подуровни. Для такого перехода электрону необходима большая энергия. Кристаллы с такой электронной структурой по своим электрическим свойствам относятся к полупроводникам или диэлектрикам.
Все кристаллы в зависимости от природы связи подразделяют на молекулярные, ковалентные, металлические и ионные. Однако такое разделение условно, так как в некоторых случаях может действовать не один тип связи, а несколько.
1.3.2. Молекулярные кристаллы
Кристаллы, в которых преобладает молекулярная связь, возникающая между любыми частицами (ионами, атомами, молекулами), называют молекулярными. Для многих кристаллов она мала по сравнению с другими, более прочными связями.
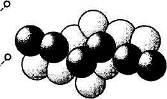 Рис.
1.10. Кристаллическая решетка йода
(пространственное изображение)
Рис.
1.10. Кристаллическая решетка йода
(пространственное изображение)
В кристаллах инертных газов эта связь единственная, а следовательно, она определяет структуру и свойства кристаллов.
Известно, что аргон, так же как и другие инертные газы, может переходить в жидкое и даже твердое состояние при очень низких температурах.
Атомы инертных газов имеют полностью достроенные энергетические уровни, а поэтому при сближении атомов обмен электронами невозможен. Возникновение сил притяжения между атомами объясняют их мгновенной поляризацией при сближении (рис. 1.9).
Аналогичные связи действуют между молекулами с насыщенными связями в кристаллах двухатомных газов Н2, N2, Сl2, существование которых возможно лишь при очень низких температурах; в кристаллах J2, Н2О, СО2, а также в кристаллах СH4 и других органических веществ — при нормальных условиях.
Силы Ван-дер-Ваальса между частицами не имеют направленного характера, так как мгновенный диполь образуется с каждым из соседних атомов. В результате атомы, стремясь увеличить число соседей в кристаллической решетке, укладываются наиболее компактным образом. Типичной решеткой для инертных газов является ГЦК.
 Кристалл
йода имеет ромбическую гранецентрированную
решетку (рис. 1.10).
Кристалл
йода имеет ромбическую гранецентрированную
решетку (рис. 1.10).
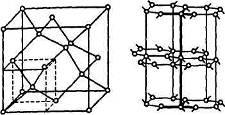
Рис 1.11. Кристаллическая решётка алмаза и графита
Энергия связи сил Ван-дер-Ваальса невелика, поэтому молекулярные кристаллы имеют низкие температуры плавления и легко возгоняются Молекулярные кристаллы — диэлектрики, так как кристалл построен и: электрически нейтральных атомов (молекул), у которых энергетические зоны полностью достроены.
