
- •Кинематика материальной точки. Векторный способ описания движения мт
- •2.Кинематика материальной точки. Координатный способ описания движения мт.
- •3. Кинематика материальной точки. Траекторный способ описания мт.
- •4. Среднее и мгновенное значение скорости и ускорения. Нормальное и тангенциальное ускорение при движении по криволинейной траектории.
- •5. Классификация движений мт. Понятие о степенях свободы. Кинематика поступательного и вращательного движений твёрдого тела. Понятие о мгновенном центре скоростей.
- •6. Векторы угловой скорости и углового ускорения твёрдого тела. Связь угловых и линейных кинематических величин.
- •7. Основная задача динамики. Понятия массы, импульса и силы. Законы Ньютона.
- •8 . Преобразования Галилея. Принцип относительности Галилея.
- •9. Динамика системы материальных точек. Закон сохранения импульса.
- •1 0. Реактивное движение. Уравнение Мещерского. Формула Циолковского.
- •11. Центр масс, уравнение его движения.
- •12. Момент силы и момент импульса для мт и системы мт. Проекция момента силы и импульса на ось.
- •13. Законы сохранения импульса и момента импульса как отражение свойств пространства.
- •14. Закон всемирного тяготения. Сохранение момента импульса при движении в поле центральных сил.
- •15.Основное уравнение динамики вращательного движения.
- •16. Момент инерции. Свойство аддитивности. Теорема Штейнера. Свободные оси вращения. Понятие о гироскопе его применениях.
- •17. Работа при поступательном и вращательном движении. Мощность.
- •18. Кинетическая энергия. Закон изменения кинетической энергии.
- •19. Консервативные и неконсервативные силы. Потенциальная энергия. Понятие о потенциальном поле. Потенциальная яма.
- •20. Неконсервативные силы, диссипация механической энергии. Примеры неконсервативных сил.
- •21. Потенциалы гравитационной силы, силы упругости и силы тяжести. Консервативные системы, закон сохранения механической энергии.
- •Закон сохранения механической энергии
- •22. Законы столкновения/соударения. Импульс силы.
- •23. Статика. Условия равновесия абсолютно твёрдого тела. Понятие связей в механике. Реакции связей.
- •24. Колебания. Гармонические колебания. Закон движения при гармонических колебаниях. Скорость и ускорение при гармонических колебаниях.
- •25. Силы, действующие на осциллятор. Дифференциальное уравнение гармонических колебаний. Превращение энергии при гармонических колебаниях. Энергия гармонического осциллятора.
- •26. Формы представления гармонических колебаний. Простые осцилляторы (физический, математический и пружинный маятники).
- •27. Сложение колебаний методом векторных диаграмм. Биения.
- •28. Сложение взаимно перпендикулярных колебаний. Фигуры Лиссажу.
- •29. Затухающие колебания. Дифференциальное уравнение затухающих колебаний.
- •30. Вынужденные колебания. Резонанс. Дифференциальное уравнение вынужденных колебаний.
- •32. Стоячие волны. Уравнение стоячей волны. Спектр частот колебаний струны.
- •33.Энергия волны. Вектор Умова.
- •34. Звук, инфра- и ультразвук. Эффект Доплера.
- •35. Границы применимости классической механики. Постулаты специальной теории относительности. Преобразования Лоренца.
- •36. Следствия преобразований Лоренца: сокращение размеров тел в направлении их движения; замедление хода времени в движущейся системе отсчёта.
- •1 Следствие: сокращение размеров тел в направлении их движения.
- •2 Следствие: замедление хода времени в движущейся системе отсчёта:
- •37. Следствия преобразований Лоренца: относительность одновременности; инвариантность интервала между двумя событиями.
- •38. Закон преобразования скоростей в релятивистской механике.
- •39. Импульс релятивистской частицы. Основной закон релятивистской динамики.
- •40. Энергия в релятивисткой механике. Закон взаимосвязи массы и энергия. Масса покоя.
- •41. Понятие о квантовой механике. Корпускулярно-волновой дуализм. Волна де Бройля. Принцип суперпозиции состояния. Волновая функция и её статистический смысл.
- •42. Соотношение неопределённостей Гейзенберга. Тождественность и спин частиц. Временное и стационарное уравнение Шредингера.
- •43. Решение стационарного уравнения Шредингера для свободной частицы.
- •45. Решение стационарного уравнения Шредингера для гармонического осциллятора. Нулевая энергия.
- •46. Туннельный эффект.
- •48. Работа в термодинамике. Уравнение состояния вещества. Уравнение Клапейрона- Менделеева. Газовые законы. Первое начало термодинамики.
- •49.Адиабатический процесс. Уравнение адиабаты.
- •50. Вычисление работы и внутренней энергии идеального газа для изотермического, изобарического, изохорического и адиабатического процессов.
- •Внутренняя энергия идеального газа
- •51. Теплоёмкость вещества. Изобарическая и изохорическая теплоёмкость. Уравнение Майера.
- •52. Теплоёмкость и внутренняя энергия идеального газа.
- •53. Циклические процессы. Прямой и обратный циклический процесс. Цикл Карно. 1-я и 2-я теоремы Карно. Циклические процесс как основа работы тепловых машин.
- •54. Второе начало термодинамики. Формулировки второго начала термодинамики. Понятие обратимого и необратимого процессов.
- •55. Неравенство Клаузиуса. Энтропия. Статистический вес макроскопических состояний. Формула Больцмана. Свойства энтропии.
- •56. Принцип возрастания энтропии. Третье начало термодинамики. Основное уравнение термодинамики.
- •3 Начало термодинамики. 1906-теорема Нернста.
- •57. Термодинамические функции равновесного состояния системы. Взаимосвязь функций состояния («Энергетический пирог»).
- •58. Модель идеального газа. Закон Максвелла для распределения молекул по скоростям теплового движения. Вычисление средних величин с использованием функций распределения.
- •59. Основное уравнение молекулярно-кинетической теории газов. Давление. Молекулярно-кинетический смысл температуры. Следствия из основного уравнения мкт.
- •61. Закон Больцмана для распределения частиц в потенциальном поле. Барометрическая формула.
- •62.Понятие о статистических распределениях Ферми-Дирка и Бозе-Эйнштейна. Переход к классическому распределению при высоких температурах.
- •64. Уравнение Клапейрона-Клаузиуса. Правило Максвелла для равновесия в точке фазового перехода.
- •6 5. Силы и потенциальная энергия межмолекулярного взаимодействия. Межмолекулярный потенциал Леннард-Джонса. Уравнение Ван-дер-Вальса.
- •67. Внутренняя энергия реального газа (газа Ван-дер-Вальса). Сжижение газов и получение низких температур.
- •68. Эффект Джоуля – Томпсона. Кривая инверсии.
- •69. Строение твёрдых тел и их основные свойства. Симметрия и дефекты кристаллической решетки. Деформация.
45. Решение стационарного уравнения Шредингера для гармонического осциллятора. Нулевая энергия.
В
тех случаях, когда частица находится
в стационарных потенциальных силовых
полях, ур-ние Шредингера можно
представить: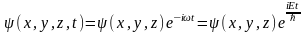 ,где
Е-полная энергия частицы, которая в
случае стационарного поля остается
неизменной. Подставим данную ф-цию в
ур-ние Шредингира:
,где
Е-полная энергия частицы, которая в
случае стационарного поля остается
неизменной. Подставим данную ф-цию в
ур-ние Шредингира: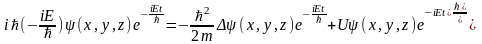 .Сократив и преобразовав ур-нение,
получим стационарное ур-ние Шредингера:
.Сократив и преобразовав ур-нение,
получим стационарное ур-ние Шредингера: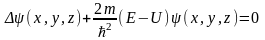
Нулевая
энергия
— минимальный уровень энергии, который
может иметь данная квантовомеханическая
система. Частица может находиться в
точке, отвечающей минимуму потенциала
энергии и иметь нулевую кинетическую
энергию. В этом случае частица находится
в состоянии устойчивого равновесия и
имеет минимальную энергию, равную
потенциальной энергии в точке равновесия.
Нулевая энергия используется как
синоним для энергии вакуума.
46. Туннельный эффект.
Т уннелирование
– прохождение микрочастицы через
потенциальный барьер. Потенциальный
барьер – область
пространства от 0 до Х, где потенциальная
функция имеет большее значение, чем в
соседних областях.
уннелирование
– прохождение микрочастицы через
потенциальный барьер. Потенциальный
барьер – область
пространства от 0 до Х, где потенциальная
функция имеет большее значение, чем в
соседних областях.
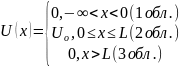
Коэффициент потенциальности:
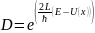
Выражения
для уравнения Шредингера для областей
1,3 и 2 будут отличаться:
для 1,3:
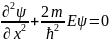 для 2:
для 2:
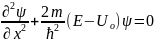
Ψ1(x)=A1eikx+B1е-ikx
(область 1);
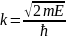
Ψ2(x)=A2eiqx+B2е-iqx
(область 2);

Ψ3(x)=A3eikx+B3е-ikx ; в общем решении B3е-ikx →0 (область 3).
Особенности квантовой механики:
Все частицы – тождественные величины.
В зависимости от вида потенциальной ф-и, отношение Е потенциальной ф-и и Е частицы изменяются.
Т.к. вид потенциальной ф-и всегда отличается от теор. бескон. глубины потенциальной ямы, то обнаруживается ненулевая вероятность нахождения частицы за пределами потенциальной ямы.
47. Основные принципы термодинамики. Понятие внутренней энергии, состояния, системы, процесса. Равновесные и неравновесные процессы. Первое начало термодинамики для изотермического, изобарического, изохорного и адиабатического процессов.
Термодинамика изучает макросистемы (системы которые состоят из очень большого числа частиц) не интересуясь их внутренним строением. При таком подходе для характеристики систем используется понятия и сведения величин, которые относятся к системе в целом. И эти величины могут быть непосредственно изменены в эксперименте.
Термодинамика опирается на 2 принципа, которые представляют собой обобщение совокупностей экспериментальных данных: 1.Принцип эквивалентности теплоты и работы: если над системой совершается работа, то она может быть определена через изменение характеристик, характеризующих количество теплоты, полученной либо отданное системой. 2.Самопроизвольный переход теплоты в системе является односторонним (однонаправленным). Происходит от нагретых тел к холодным.
Выводы термодинамики не зависят от наших представлений о микроструктуре вещества, поскольку они – следствия основных положений термодинамики, надёжность выводов определяется надёжностью исходных принципов.
Термодинамика и МКТ (молекулярно-кинетическая теория) оперируются своим набором понятий и величин.
Система
– это
любое тело
или совокупность тел, свойства которых
рассматриваются в данной задаче. Если
тело не входит в систему, то оно называется
внешним
телом. Если
взаимодействием системы с внешними
телами можно пренебречь, то такую
систему называют
замкнутой, т.е.
система изолирована. С истема
будет незамкнутой (неизолированной),
если есть
взаимодействие с внешними телами.
истема
будет незамкнутой (неизолированной),
если есть
взаимодействие с внешними телами.
Состояние системы определяется совокупностью измеренных физ. величин, которые называются параметрами системы. Они позволяют полностью описать состояние системы. В термодинамики это P,T,V. (P,Т – внутренние параметры, их величина зависит от свойств самой системы. V – внешний параметр. Это величина характеризует свойство системы в зависимости от наличия взаимодействия с внешними телами либо от величины взаимодействия внешних сил.)
Состояния системы разделяют на равновесные, если при отсутствии внешних воздействий все параметры системы сохраняют свои значения сколь угодно долго. Неравновесные, если параметры системы будут изменяются во времени.
Процесс - переход из одного состояния системы в другое. Процессы могут быть равновесные (если в ходе изменения состояния системы в любой момент времени состояние системы является равновесным); если переход из одного состояния в другое может происходить достаточно медленно, то состояние в каждый момент времени можно считать равновесным. Большинство процессов в системе неравновесные.
Только равновесные процессы можно изображать графически в системе координат, которые отражают термодинамические параметры, неравновесные процессы представить т.о. нельзя.
Равновесные процессы = квазистатические = медленно изменяющиеся.
Внутренняя энергия U системы - это сумма кинетической энергии хаотического движения частиц и потенциальной энергий их взаимодействия друг с другом. Внутренняя энергия является функцией состояния системы. Это означает, что всякий раз, когда система оказывается в состоянии с заданными значениями V и Т, ее внутренняя энергия принимает присущее этому состоянию значение, независимо от того, каким способом система приведена в это состояние.
Существует
некая функциональная зависимость между
термодинамическим состоянием системы.
И эта функция есть уравнение состояния
системы.
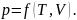
Состояние системы можно изменить 2 способами:
1. совершить некую работу над системой или предоставить системе возможность самой совершать работу.
2. осуществить теплообмен системы с внешними телами.
Идеальный
газ – это газ, подчиняющийся
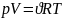
Первое начало термодинамики Q=∆U+A
Количество теплоты, которое сообщается системе идёт на приращение её внутренней энергии и на совершение системой работы над внешними телами.
1
 .Изотермический
процесс: Т=соnst;
PV=const
⇒
P=const/V
(Закон
Бойля-Мариотта: PV=const)
.Изотермический
процесс: Т=соnst;
PV=const
⇒
P=const/V
(Закон
Бойля-Мариотта: PV=const)
U(T)=νCvT⇒dU=0;δQ=
δA
⇒
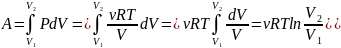
2
 .Изобарический:
P=const;
V/T
= const
⇒
V=T
const
(Закон
Гей-Люссака V/T
= const)
.Изобарический:
P=const;
V/T
= const
⇒
V=T
const
(Закон
Гей-Люссака V/T
= const)
δQ=dU+
δA;
δQ=
νCvT+δA;
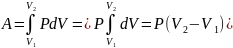 ;
U=νCv∆T
;
U=νCv∆T
3 .Изохорный
процесс: V=
const
Р/T
= const
⇒
Р=T
const
(Закон Шарля
Р/T
= const)
.Изохорный
процесс: V=
const
Р/T
= const
⇒
Р=T
const
(Закон Шарля
Р/T
= const)
 dV≡0
⇒
δA≡0;
δQ=
dU;
dV≡0
⇒
δA≡0;
δQ=
dU;
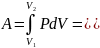 0;
∆U=νCv∆T
0;
∆U=νCv∆T
4.Адиабатический процесс - процесс который происходит без теплообмена с окружающей средой.
И
 зменение
внутренней энергии системы численно
равно значению работы, взятой с
противоположным знаком. Если система
совершила работу, то значение ∆U
– убыло. В адиабатном процессе вся
работа совершается за счёт внутренней
энергии газа.
зменение
внутренней энергии системы численно
равно значению работы, взятой с
противоположным знаком. Если система
совершила работу, то значение ∆U
– убыло. В адиабатном процессе вся
работа совершается за счёт внутренней
энергии газа.
PVγ=const – Уравнение Пуассона или уравнение адиабаты.
ТVγ-1=const ТγР1-γ=const - выражения для уравнения Пуассона
Адиабатический процесс при Q=0:
δQ=0 ⇒ dU=-δA ⇒ U=-A ⇒ A=-U=-νCv(T2-T1)
∆U=νCv∆T
