
- •2. Второе начало термодинамики. Энтропия изолированной, закрытой и открытой систем.
- •3.Первое начало термодинамики. Тепловые эффекты химических реакций. Закон Гесса.
- •Закон Гесса
- •4 Вопрос. Система и внешняя среда. Изолированная, закрытая, открытая системы. Внутренняя энергия системы.
- •7.Функция состояния
- •8 Вопрос. Понижение температуры замерзания и повышение температуры кипения в зависимости от их концентрации.
- •9.Связь между энтальпией и внутренней энергией.
- •10. Электродные процессы. Возникновение потенциала на границе раздела фаз.
- •11.Окислительно-восстановительные электроды и цепи. Определитель окислительно-восстановительных потенциалов.
- •12. Осмотическое давление. Закон Вант-Гоффа.
- •13. Ионная сила растворов, активность, коэффициент активность электролитов.
- •14. Потенциометрический метод определения рН. Электроды с водородной функцией.
- •16 .Электроды 1-го рода.
- •17. Электроды II-го рода.
- •18. Слабые электролиты. Константа электролитической диссоциации. Закон разведения.
- •19.Адсорбция на твёрдых поверхностях. Уравнение Фрейндлиха, уравнение Ленгмюра.
- •20.Определение концентрации ионов в растворе методом измерения эдс гальванических цепей.
- •21. Электролитическая диссоциация воды. Шкала кислотности по отношениюк воде. Ионное произведение воды. Понятие рН и использование егов агрономии.
- •22. Электроды первого и второго рода. Уравнение Нернста для этих электродов.
- •24. Концентрационные цепи.
- •24. Нормальные потенциалы и ряд напряжений
- •25.Буферные растворы, их состав и механизм действия.
- •26. Диффузионные потенциалы.
- •27.Закон независимости движения ионов.
- •28. Теория электролитической диссоциации.
- •29.Изменение давления насыщенного пара над растворителем и над раствором в зависимости от температуры. Первый закон Рауля.
- •30. Удельная электропроводность и электролитическая подвижность ионов.
- •31. Развитие понятий кислота и основание. Теория Брэнстеда.
- •32. Электрокинетические свойства коллоидных систем. Электрофорез и электроосмос. Электрокинетический потенциал.
- •33. Поверхностно-активные вещества. Смачивание и его мера. Значение смачивания при действии пестецидов для борьбы с сорняками, с/х вредителями и болезнями
- •34. Строение мицеллы лиофобных коллоидных растворов.
- •35. Методы получения и очистки коллоидных систем.
- •36.Молекулярн-кинетические свойства коллоидных систем: броуновское движение, диффузия. Осмос в коллоидных системах.
- •37.Тердинамический и электрокинетический потенциал.
- •38. Обменная адсорбция.
- •39. Кинетическая и агрегативная устойчивость коллоидных систем.
- •40. Нарушение устойчивости гидрофобных коллоидов. Правила значимости и валентности.
- •41. Вязкость коллоидных растворов. Зависимость вязкости растворов вмс от pH.
- •42. Коагуляция лиофобных коллоидных растворов электролитами.
- •43.Теория электролитической диссоциации
- •48.Основные особенности коллоидного состояния вещества.
- •49. Вязкость. Уравнение Эйнштейна н Думанского.
- •53.Гидрофильные и гидрофобные поверхности. Смачивание и его мера.
- •54. Ориентация молекул в поверхностном слое.
- •55. Поверхностное натяжение. Адсорбции на поверхности растворов. Уравнение Гиббса.
13. Ионная сила растворов, активность, коэффициент активность электролитов.
Мерой электростатического взаимодействия ионов в растворе является ионная сила раствора (µ), равная полусумме произведений молярных концентраций всех присутствующих в растворе ионов на квадраты их зарядов:
µ = 0,5 ΣCi Zi
где: Ci – молярная концентрация i-го иона, Zi - заряд i -го иона.
На величину электростатического взаимодействия ионов в растворе не влияют электронейтральные молекулы (неэлектролиты или слабые электролиты), поэтому их не учитывают при вычислении ионной силы раствора.
Легко показать, что для бинарных электролитов с однозарядными ионами (NaCl, HCl, HI, HNO3) ионная сила раствора равна молярной концентрации этого электролита, т.е. µ (NaCl) = С(NaCl). В случае бинарных электролитов с двухзарядными ионами (FeSO4, MgSO4) ионная сила раствора в четыре раза больше концентрации этого электролита, т.е. µ (FeSO4) = 4С(FeSO4). Для трехионных электролитов (K2SO4, MgCl2) ионная сила раствора в три раза больше концентрации этого электролита, т.е. µ(K2SO4) = 3С(K2SO4).
Ионная сила раствора, содержащего несколько сильных электролитов, равна сумме ионных сил, создаваемых каждым из них.
Например, ионная сила раствора, содержащего хлорид и сульфат натрия, равна: µ (NaCl + Na2SO4) = С(NaCl) + 3С(Na2SO4).
Акти́вность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
С увеличением ионной силы раствора коэффициент активности уменьшается. Однако, достигнув определенного минимального значения, коэффициент активности при дальнейшем увеличении ионной силы возрастает.
Активность
отличается от общей концентрации на
некоторую величину. Отношение активности
(![]() )
к общей концентрации вещества в растворе
называется коэффициентом активности:
)
к общей концентрации вещества в растворе
называется коэффициентом активности:

Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального. Отклонения от идеальности могут быть обусловлены различными химическими и физическими причинами — дипольные взаимодействия, поляризация, образование водородных связей, ассоциация, диссоциация, сольватация и др
Зависимость коэффициента активности иона от ионной силы очень разбавленного водного раствора электролита выражается следующей формулой Дебая и Хюккеля:

где z — заряд иона.
14. Потенциометрический метод определения рН. Электроды с водородной функцией.
В настоящее время наиболее распространен потенциометрический метод определения рН, поскольку он является наиболее точным и быстрым. Метод основан на измерении ЭДС гальванической цепи, составленной из электрода, обладающего водородной функцией, и электрода сравнения. Электродами с водородной функцией называю электроды, чей потенциал полностью обусловлен активностью ионов водорода в растворе. Существует ряд электродов, обладающих водородной функцией (водородный, хингидронный, стеклянный), но в настоящее время в лабораторной практике широко применяется стеклянный электрод с водородной функцией, т.к. он обладает рядом преимуществ. Например, одним из преимуществ стеклянного электрода является то, что он позволяет определять рН раствора любого химического соединения в достаточно широком диапазоне значений.
Схематически стеклянный электрод, обладающий водородной функцией, записывается следующим образом:
Ag
| AgCl,
0,1н HCl
| |
|
 .
.
 Для
измерения рН раствора составляют цепь
из стеклянного и хлорсеребряного
электродов. Хлорсеребряный электрод
является электродом сравнения. Таким
образом, стеклянно-хлорсеребряная цепь
записывается так:
Для
измерения рН раствора составляют цепь
из стеклянного и хлорсеребряного
электродов. Хлорсеребряный электрод
является электродом сравнения. Таким
образом, стеклянно-хлорсеребряная цепь
записывается так:
Ag
| AgCl,
0,1н НСl
| |
|

 |KClнасыщ,
AgCl|
Ag.
|KClнасыщ,
AgCl|
Ag.
Величина потенциала стеклянного электрода (ст) связана с концентрацией Н+- ионов исследуемого раствора уравнением Нернста:
 или
или
Н+ст. = Н+ст. + 0,0579 lgаН+
где: 0ст – потенциал асимметрии стеклянного электрода, величина переменная (в отличие от металлов) и поэтому требующая корректировки по буферным растворам.
Расчет рН растворов при использовании стеклянно-хлорсеребряной цепи потенциометрическим методом заключается в следующем. ЭДС любой гальванической цепи равна разности электродных потенциалов:
Е = Н+ст. - хл.
подставим в данное уравнение значение электродного потенциала стеклянного электрода:
Е = Н+ст. + 0.0579 lgаН+ - хл.
решим данное уравнение относительно рН:
-0.0579 lgаН+ = Н+ст. - хл. – Е
а т.к. -lgаН+ = рН , то
рН = Н+ст. - хл. – Е / 0,0579
15.Буферные системы, буферная ёмкость.
Одним из характерных свойств внутренней системы организмов является постоянство концентрации водородных ионов (изогидрия). Так, например, рН крови человека – 7,36. Сохранение этого показателя обеспечивается совместным действием ряда физико-химических и физиологических механизмов, из которых очень важная роль принадлежит буферным системам.
Буферными системами называются растворы, обладающие свойством достаточно стойко сохранять постоянство концентрации водородных ионов как при добавлении к ним небольшого количества сильных кислот или щелочей, так и при разведении.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) кислотные - слабая кислота и ее соль, образованная этой кислотой с сильным основанием;
б) основные - слабое основание и его соль, образованная этим основанием и сильной кислотой.
На практике часто применяются следующие буферные смеси:
СН3 СООН
СН3СООNa - ацетатный буфер;
Н2СО3
NaHCO3 - бикарбонатный буфер;
NH4OH
NH4Cl - аммиачный буфер
КН2PO4
Na2HPO4 - фосфатный буфер
Pt – COOH – белок-кислота
Pt – COONa – белок-соль - белковый буфер (Pt – протеин-белок).
Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система и стремится сохранить при добавлении кислот или щелочей. Рассмотрим, что определяет постоянство рН, например, ацетатной буферной смеси
СН3СООН Н+ + СН3СОО -
СН3СООNa СН3СОО- + Na+
В ацетатном буферном растворе концентрация водородных ионов будет зависеть от степени диссоциации молекул кислоты. Согласно закону действия масс, константа диссоциации уксусной кислоты будет:
К
=
 ,
откуда
,
откуда
[H+
]
= К×
При добавлении к слабодиссоциированной уксусной кислоте (К = 1,86× 10-5) ее сильнодиссоциированной соли происходит резкое увеличение концентрации общего аниона (СН3СОО -). В соответствие с законом действия масс это вызывает смещение равновесия влево, т.е. приводит к увеличению недиссоциированных молекул кислоты:
СН3СООН СН3СОО - + Н+
Слабая диссоциация уксусной кислоты еще в большей степени будет подавлена и концентрация недиссоциированных молекул кислоты может быть принята равной общей концентрации кислоты. Так как соль полностью диссоциированна на ионы, то общая концентрация анионов может быть принята за общую концентрацию соли в буферном растворе. Исходя из этого, концентрацию ионов водорода в буферной смеси можно представить в следующем виде:
[H+
]
= Кк×
Для основного буфера, каким является, например аммиачный, соответственно будет
[OH
-]
= Ко×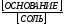
Данные выражения являются основным уравнением буферных растворов. В логарифмической форме эти уравнения принимают вид:
pH = pKк + lg[соль] – lg[кислота].
рH = pKо + lg[основание] - lg[соль].
Таким образом, рН буферных смесей зависит от константы диссоциации кислоты или основания и от соотношения концентрации компонентов буферных смесей. Используя основное уравнение буферного раствора, можно вычислить рН любого буферного раствора, зная константу электролитической диссоциации кислоты или основания и концентрации кислоты и соли, а при одинаковых концентрациях их объемные отношения.
Предел, в котором проявляется буферное действие буферной системы характеризуется буферной емкостью. Численное значение буферной емкости (Б) определяется числом моль сильной кислоты или сильного основания, которое необходимо добавить к 1 л буферной смеси, чтобы изменить значение рН на 1:

где: рН – изменение рН при титровании буфера кислотой или щелочью, наиболее близкое к 1 (рН = рН1 – рН0).
