
- •2. Второе начало термодинамики. Энтропия изолированной, закрытой и открытой систем.
- •3.Первое начало термодинамики. Тепловые эффекты химических реакций. Закон Гесса.
- •Закон Гесса
- •4 Вопрос. Система и внешняя среда. Изолированная, закрытая, открытая системы. Внутренняя энергия системы.
- •7.Функция состояния
- •8 Вопрос. Понижение температуры замерзания и повышение температуры кипения в зависимости от их концентрации.
- •9.Связь между энтальпией и внутренней энергией.
- •10. Электродные процессы. Возникновение потенциала на границе раздела фаз.
- •11.Окислительно-восстановительные электроды и цепи. Определитель окислительно-восстановительных потенциалов.
- •12. Осмотическое давление. Закон Вант-Гоффа.
- •13. Ионная сила растворов, активность, коэффициент активность электролитов.
- •14. Потенциометрический метод определения рН. Электроды с водородной функцией.
- •16 .Электроды 1-го рода.
- •17. Электроды II-го рода.
- •18. Слабые электролиты. Константа электролитической диссоциации. Закон разведения.
- •19.Адсорбция на твёрдых поверхностях. Уравнение Фрейндлиха, уравнение Ленгмюра.
- •20.Определение концентрации ионов в растворе методом измерения эдс гальванических цепей.
- •21. Электролитическая диссоциация воды. Шкала кислотности по отношениюк воде. Ионное произведение воды. Понятие рН и использование егов агрономии.
- •22. Электроды первого и второго рода. Уравнение Нернста для этих электродов.
- •24. Концентрационные цепи.
- •24. Нормальные потенциалы и ряд напряжений
- •25.Буферные растворы, их состав и механизм действия.
- •26. Диффузионные потенциалы.
- •27.Закон независимости движения ионов.
- •28. Теория электролитической диссоциации.
- •29.Изменение давления насыщенного пара над растворителем и над раствором в зависимости от температуры. Первый закон Рауля.
- •30. Удельная электропроводность и электролитическая подвижность ионов.
- •31. Развитие понятий кислота и основание. Теория Брэнстеда.
- •32. Электрокинетические свойства коллоидных систем. Электрофорез и электроосмос. Электрокинетический потенциал.
- •33. Поверхностно-активные вещества. Смачивание и его мера. Значение смачивания при действии пестецидов для борьбы с сорняками, с/х вредителями и болезнями
- •34. Строение мицеллы лиофобных коллоидных растворов.
- •35. Методы получения и очистки коллоидных систем.
- •36.Молекулярн-кинетические свойства коллоидных систем: броуновское движение, диффузия. Осмос в коллоидных системах.
- •37.Тердинамический и электрокинетический потенциал.
- •38. Обменная адсорбция.
- •39. Кинетическая и агрегативная устойчивость коллоидных систем.
- •40. Нарушение устойчивости гидрофобных коллоидов. Правила значимости и валентности.
- •41. Вязкость коллоидных растворов. Зависимость вязкости растворов вмс от pH.
- •42. Коагуляция лиофобных коллоидных растворов электролитами.
- •43.Теория электролитической диссоциации
- •48.Основные особенности коллоидного состояния вещества.
- •49. Вязкость. Уравнение Эйнштейна н Думанского.
- •53.Гидрофильные и гидрофобные поверхности. Смачивание и его мера.
- •54. Ориентация молекул в поверхностном слое.
- •55. Поверхностное натяжение. Адсорбции на поверхности растворов. Уравнение Гиббса.
11.Окислительно-восстановительные электроды и цепи. Определитель окислительно-восстановительных потенциалов.
Окислительно-восстановительным электродом называется система, состоящая из инертного металла, опущенного в раствор двух солей, который содержит одноименные катионы или анионы переменной степени окисления.
Гальванические цепи, в состав которых входят окислительно-восстановительный электрод и электрод с известным потенциалом (электрод сравнения), называются окислительно-восстановительными. Окислительно-восстановительный электрод состоит из пластинки индифферентного металла (платина или золото), находящегося в контакте с раствором, содержащий ионы одного и того же металла, но разной валентности, или с веществами различной степени окисления.
Схематически такие цепи записываются:
Pt| Mx+,My+ || электрод с известным потенциалом (электрод сравнения)
Например: Pt|Fe2+,Fe3+ || KClнасыщ, AgCl|Ag
Величина окислительно-восстановительного потенциала рассчитывается по уравнению Нернста - Петерса:

где
 -
нормальный (стандартный)
окислительно-восстановительный
потенциал, аокисл
- активность окисленной формы, авосст
- активность восстановленной формы.
-
нормальный (стандартный)
окислительно-восстановительный
потенциал, аокисл
- активность окисленной формы, авосст
- активность восстановленной формы.
Стандартным
(нормальным) окислительно-восстановительным
потенциалом
называется потенциал, возникающий в
стандартных условиях на индифферентном
электроде при соотношении
 ,
равном 1.
,
равном 1.
12. Осмотическое давление. Закон Вант-Гоффа.
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Эту зависимость Вант-Гофф уподобил поведению идеального газа:
|
|
|
|
По Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде
|
|
𝜋 |
|
Так как объем одного моля газообразного вещества при нормальных условиях равен 22,4 литра, то осмотическое давление раствора, содержащего 1 моль вещества, равно 22,4 атм.
Измерение осмотического давления раствора используется для определения молекулярных масс даже разбавленных растворов, что позволяет оценивать молекулярные массы растворимых высокомолекулярных соединений, в частности, биополимеров. Заменив C (B) в формуле Вант-Гоффа соотношением (m (B) ∙ 1000 / μ (B) ∙ V), получим уравнение, позволяющее вычислять молекулярные массы растворенных веществ:
|
|
|
|
m (B) – масса растворенного вещества, V – объем раствора.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворенного вещества, изотоничность является следствием одинакового числа частиц в растворе.
Поскольку при растворении реальное число частиц может отличаться от числа растворенных молекул, Вант-Гофф ввел понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворенных молекул:
|
|
|
(6.1) |
В бензольном растворе уксусной кислоты i < 1, ибо в этом растворе число частиц меньше числа молекул, в результате реакции ассоциации в соответствие с уравнением
|
|
|
|
Если же в растворе преобладает не ассоциативный, а диссоциативный или ионизационный механизмы взаимодействия, то i > 1. Так, в водном растворе уксусная кислота диссоциирует CH3COOH = CH3COO– + H+, и число частиц становится больше числа молекул.

 -
для не электролитов
-
для не электролитов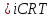 - для электролитов
- для электролитов