
- •2. Второе начало термодинамики. Энтропия изолированной, закрытой и открытой систем.
- •3.Первое начало термодинамики. Тепловые эффекты химических реакций. Закон Гесса.
- •Закон Гесса
- •4 Вопрос. Система и внешняя среда. Изолированная, закрытая, открытая системы. Внутренняя энергия системы.
- •7.Функция состояния
- •8 Вопрос. Понижение температуры замерзания и повышение температуры кипения в зависимости от их концентрации.
- •9.Связь между энтальпией и внутренней энергией.
- •10. Электродные процессы. Возникновение потенциала на границе раздела фаз.
- •11.Окислительно-восстановительные электроды и цепи. Определитель окислительно-восстановительных потенциалов.
- •12. Осмотическое давление. Закон Вант-Гоффа.
- •13. Ионная сила растворов, активность, коэффициент активность электролитов.
- •14. Потенциометрический метод определения рН. Электроды с водородной функцией.
- •16 .Электроды 1-го рода.
- •17. Электроды II-го рода.
- •18. Слабые электролиты. Константа электролитической диссоциации. Закон разведения.
- •19.Адсорбция на твёрдых поверхностях. Уравнение Фрейндлиха, уравнение Ленгмюра.
- •20.Определение концентрации ионов в растворе методом измерения эдс гальванических цепей.
- •21. Электролитическая диссоциация воды. Шкала кислотности по отношениюк воде. Ионное произведение воды. Понятие рН и использование егов агрономии.
- •22. Электроды первого и второго рода. Уравнение Нернста для этих электродов.
- •24. Концентрационные цепи.
- •24. Нормальные потенциалы и ряд напряжений
- •25.Буферные растворы, их состав и механизм действия.
- •26. Диффузионные потенциалы.
- •27.Закон независимости движения ионов.
- •28. Теория электролитической диссоциации.
- •29.Изменение давления насыщенного пара над растворителем и над раствором в зависимости от температуры. Первый закон Рауля.
- •30. Удельная электропроводность и электролитическая подвижность ионов.
- •31. Развитие понятий кислота и основание. Теория Брэнстеда.
- •32. Электрокинетические свойства коллоидных систем. Электрофорез и электроосмос. Электрокинетический потенциал.
- •33. Поверхностно-активные вещества. Смачивание и его мера. Значение смачивания при действии пестецидов для борьбы с сорняками, с/х вредителями и болезнями
- •34. Строение мицеллы лиофобных коллоидных растворов.
- •35. Методы получения и очистки коллоидных систем.
- •36.Молекулярн-кинетические свойства коллоидных систем: броуновское движение, диффузия. Осмос в коллоидных системах.
- •37.Тердинамический и электрокинетический потенциал.
- •38. Обменная адсорбция.
- •39. Кинетическая и агрегативная устойчивость коллоидных систем.
- •40. Нарушение устойчивости гидрофобных коллоидов. Правила значимости и валентности.
- •41. Вязкость коллоидных растворов. Зависимость вязкости растворов вмс от pH.
- •42. Коагуляция лиофобных коллоидных растворов электролитами.
- •43.Теория электролитической диссоциации
- •48.Основные особенности коллоидного состояния вещества.
- •49. Вязкость. Уравнение Эйнштейна н Думанского.
- •53.Гидрофильные и гидрофобные поверхности. Смачивание и его мера.
- •54. Ориентация молекул в поверхностном слое.
- •55. Поверхностное натяжение. Адсорбции на поверхности растворов. Уравнение Гиббса.
Закон Гесса
Н0298K
= 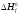 298К
(продукты)
-
298К
(продукты)
-  298К
(реагенты)
298К
(реагенты)
Таким образом, стандартная энтальпия химической реакции равна разности сумм стандартных энтальпий образования всех продуктов и всех реагентов. Так записывается математически закон Гесса.
Если из данных исходных реагентов можно различными путями получить одни и те же конечные продукты, то, независимо от путей получения продуктов, т.е. от вида и количества промежуточных реакций, суммарный тепловой эффект для всех путей будет одним и тем же. Иначе говоря, тепловой эффект химической реакции не зависит от пути перехода "реагенты - продукты", т.е. от промежуточных реакций, а зависит только от вида и состояния продуктов и реагентов. Это положение было постулировано русским ученым Г.И. Гессом в 1840 году и известно как закон Гесса, являющийся основным законом термохимии.
Следствия из закона Гесса:
-
Закон Лавуазье-Лапласа. Тепловой эффект реакции разложения точно равен и противоположен по знаку тепловому эффекту реакции соединения.
Пример:
Са
+
 О2
=
СаО
+ 634,71 кДж
О2
=
СаО
+ 634,71 кДж
СаО
= Са +
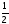 О2
-
634,71 кДж
О2
-
634,71 кДж
Qразл + (-Qсоед ) = 0.
-
Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между тепловыми эффектами представляет тепловой эффект перехода из одного начального состояния в другое.
Пример:
С + О2 = СО2 + 409,20 кДж (1)
СО + ½ О2 = СО2 + 284,93 кДж (2)
Вычитая из (1) уравнение (2), можно вычислит тепловой эффект реакции сжигания углерода до окиси углерода:
С + ½ О2 = СО + 124,27 кДж
Таким образом, можно определять тепловые эффекты таких реакций, которые или нереализуемы, или не могут быть проведены чисто и до конца.
-
Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница между тепловыми эффектами представляет тепловой эффект перехода из одного конечного состояния в другое.
Пример:
Суг + О2 = СО2 + 409,20 кДж
Сгр + О2 = СО2 + 393,51 кДж
Таким образом, можно рассчитать тепловой эффект перехода от угля к графиту, который будет равен 409,00 – 393,51=15,69 кДж/моль.
4 Вопрос. Система и внешняя среда. Изолированная, закрытая, открытая системы. Внутренняя энергия системы.
Системой называют ограниченную каким-либо образом часть физического мира, всякий материальный объект, обособленный физическими или воображаемыми границами раздела от окружающей среды и подвергнутый теоретическому и (или) экспериментальному изучению.
Системы, в которых исключён какой бы то ни было обмен веществом или энергией с окружающей средой, называют изолированными. Систему называют закрытой, если она может обмениваться с окружающей средой энергией и не может обмениваться веществом. В качестве примера можно привести запаянную ампулу с веществом, которая попеременно помещается в холодную и горячую среду. Масса содержимого ампулы останется постоянной, хотя она будет получать и отдавать энергию. Системы, которые могут обмениваться веществом и энергией с окружающей средой, называют открытыми. К ним относятся, например, все живые организмы.
Следует заметить серьёзные осложнения, которые возникают при применении термодинамики к биохимическим процессам. Это связанно с тем, что, как правило, термодинамика имеет дело с закрытыми системами, находящимися в равновесии, а живые организмы относятся к открытым системам, в которых равновесие обычно отсутствует. Они находятся в так называемом стационарном состоянии, когда концентрация частиц поддерживается постоянной за счёт непрерывного притока и оттока веществ из системы; любая клетка в равновесном состоянии- это уже мёртвая клетка.
Обмен энергией между системой и внешней средой может проявляться в различных формах. Механическая, тепловая, электрическая энергии и энергия излучения прямо или косвенно превращаются друг в друга. В 1843 г. Дж. Джоуль осуществил первую количественную проверку эквивалентности тепловой энергии, или теплоты, и механической энергией. При этом рассматривались превращения, в которых участвуют только тепловая энергия Q и механическая работа (энергия) А; эти превращения называются термомеханическими.
Единица работы( энергии) А определяется на основании уравнения A=Fl,
Так количество теплоты Q эквивалентно некоторой работе А, теплота выражается в единицах работы, т.е. в джоулях.
Для проведения работ необходимо ввести знак, учитываемые при рассмотрении обмена между системой и внешней средой.
Внутренняя
энергия - это энергия системы за вычетом
ее полной механической энергии (которая
складывается из кинетической энергии
системы как целого и ее потенциальной
энергии в поле внешних сил):
![]() Внутренняя
энергия системы складывается из:
а)
кинетической энергии
непрерывного хаотическогодвижения
молекул;
б) потенциальной энергии
взаимодействия молекул между собой;
в)
внутримолекулярной энергии (энергии
химических связей, ядерной энергии и
т.п.).
Внутренняя
энергия системы складывается из:
а)
кинетической энергии
непрерывного хаотическогодвижения
молекул;
б) потенциальной энергии
взаимодействия молекул между собой;
в)
внутримолекулярной энергии (энергии
химических связей, ядерной энергии и
т.п.).
Для
идеального газа внутренняя энергия
равна суммарной кинетической
энергии хаотического движения
всех N молекул газа:
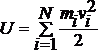 .
.
Внутренняя энергия системы аддитивна, т.е. складывается из внутренних энергий ее частей.
Внутренняя энергия системы является функцией состояния. Поэтому приращение внутренней энергии (как и приращение всех функций состояния) всегда будет полным дифференциалом dU.
При циклическом процессе, когда система приходит в исходное состояние, ее внутренняя энергия не меняется.
5. Третье начало термодинамики. Свободная энергия Гиббса и свободная энергия Гельмгольца.
Третье начало термодинамики.
Энтропия чистых веществ, существующих в виде идеальных кристаллов, при температуре абсолютного нуля равна 0.
Функция Н-ТS обозначается буквой G и называется свободной энергией Гиббса
G= H─TS
Функция G= H-TS также называется изобарно-изотермическим потенциалом или изобарным потенциалом.
Свободная энергия G – функция состояния, поэтому изменение ∆G этой функции при конечном процессе равно: ∆G= ∆H─T∆S─S∆T
При постоянной температуре ∆T=0, откуда ∆G= ∆H-T∆S
Если процесс идет при постоянной температуре и объеме, т.е ∆U=Qv, то можно записать
Обратимый процесс :∆U─ T∆S=0, необратимый процесс: ∆U─ T∆S<0
Функция U─TS обозначается буквой F- это функция состояния; она называется свободной энергией Гельмгольца:
F= U─TS
Функция U─TS играет большую роль при изучении равновесия в изотермических процессах; ее называют также изохорно-изотермическим потенциалом, изохорным потенциалом или энергией Гельмгольца.
При постоянных температуре и объеме имеем:
Обратимый процесс: ∆F=0, необратимый процесс ∆F<0
В этих условиях ∆F=0─критерий равновесия, а ∆F<0 ─ критерий необратимости процесса.
6. Свободная энергия и направление химических реакций.
Необратимому процессу, т.е самопроизвольной реакции, соответствует отрицательное изменение свободной энергии. Если изменение свободной энергии равно нулю, то начальное и конечное состояние могут существовать в равновесии. Если изменение свободной энергии положительно, то самопроизвольно реализуется обратная реакция.
Таким образом, в общем виде для химической реакции:
aA+ bB→1cC+dD
←2
Можно записать:
1) ∆G=0; система находится в динамическом равновесии, т.е скорость реакции, идущей в направление 1, равна скорости реакции, идущей в направлении 2;
2) ∆G<0; реализуется самопроизвольный процесс в направлении 1;
3) ∆G>0; реализуется самопроизвольный процесс в направлении 2
Исходя из сказанного, можно сделать вывод, что определение знака ∆G позволяет установить направление данной хим. Реакции. Однако при этом нужно знать значение ∆H, ∆S и Т, так как ∆G=∆H─ Т S.
Рассмотрим, как применяется знак ∆G ( или =∆H─ Т ∆S) при измени знака ∆Н и ∆S.
1. Экзотермические реакции, протекающие с возрастанием энтропии.
Эти реакции происходят необратимо( самопроизвольно). К ним относится, например, разложение молекулы на несколько молекул. Число микроскопических состояний системы, связанных с данным микроскопическим состоянием, растет.
В качестве примера приведем распад пероксида водорода при 298К и атмосферном давлении:
2Н2О2(г)→2Н2О(г)+ О2(г) (∆H= -211,43 кДж, ∆S= 129Дж, ∆G= - 250,37кДж)
При сгорании любого органического вещества образуется диоксид углерода и вода – это экзотермическая реакция. Реакция сопровождается значительным изменением энтальпии, при этом изменение свободной энергии отрицательно.
2. Эндотермические реакции, протекающие с понижением энтропии.
Эти реакции протекают необратимо. В качестве примера приведем реакцию азота с кислородом при 298К и атмосферном давлении:
N2(г)+ 2О2→2 N О2(г) (∆H= -67,83 кДж, ∆S= 122Дж, ∆G= 103,83кДж)
3. Экзотермические реакции, протекающие с понижением энтропии.
Так как изменение энтальпии мало зависит от температуры, реакции такого типа более вероятны при низких температурах, т.е. когда член Т∆S не значителен.
Так, реакция синтеза аммиака возможна при 298К и атмосферном давлении:
3Н2(г)+N2(г)→2 N Н3(г) (∆H= -92,53 кДж, ∆S= 195, ∆G= 33,49кДж) Повышение температуры не благоприпяствует реакции образования аммиака.
4. Эндорермические реакции, протекающие с возрастание энтропии.
Они могут осуществляться при высокой температуре; в этих условиях член Т∆S может быть больше, чем ∆H. Так, при 298К и атмосферном давлении реакция будет сопровождаться положительным изменением свободной энергии, так как ∆H= 58,20 кДж, ∆S= 177Дж, ∆G= 5,44кДж. При 298К величина ∆G отрицательна и реакция протекает спонтанно.
N2 О49(г) →2 N О2(г)
