
- •2. Второе начало термодинамики. Энтропия изолированной, закрытой и открытой систем.
- •3.Первое начало термодинамики. Тепловые эффекты химических реакций. Закон Гесса.
- •Закон Гесса
- •4 Вопрос. Система и внешняя среда. Изолированная, закрытая, открытая системы. Внутренняя энергия системы.
- •7.Функция состояния
- •8 Вопрос. Понижение температуры замерзания и повышение температуры кипения в зависимости от их концентрации.
- •9.Связь между энтальпией и внутренней энергией.
- •10. Электродные процессы. Возникновение потенциала на границе раздела фаз.
- •11.Окислительно-восстановительные электроды и цепи. Определитель окислительно-восстановительных потенциалов.
- •12. Осмотическое давление. Закон Вант-Гоффа.
- •13. Ионная сила растворов, активность, коэффициент активность электролитов.
- •14. Потенциометрический метод определения рН. Электроды с водородной функцией.
- •16 .Электроды 1-го рода.
- •17. Электроды II-го рода.
- •18. Слабые электролиты. Константа электролитической диссоциации. Закон разведения.
- •19.Адсорбция на твёрдых поверхностях. Уравнение Фрейндлиха, уравнение Ленгмюра.
- •20.Определение концентрации ионов в растворе методом измерения эдс гальванических цепей.
- •21. Электролитическая диссоциация воды. Шкала кислотности по отношениюк воде. Ионное произведение воды. Понятие рН и использование егов агрономии.
- •22. Электроды первого и второго рода. Уравнение Нернста для этих электродов.
- •24. Концентрационные цепи.
- •24. Нормальные потенциалы и ряд напряжений
- •25.Буферные растворы, их состав и механизм действия.
- •26. Диффузионные потенциалы.
- •27.Закон независимости движения ионов.
- •28. Теория электролитической диссоциации.
- •29.Изменение давления насыщенного пара над растворителем и над раствором в зависимости от температуры. Первый закон Рауля.
- •30. Удельная электропроводность и электролитическая подвижность ионов.
- •31. Развитие понятий кислота и основание. Теория Брэнстеда.
- •32. Электрокинетические свойства коллоидных систем. Электрофорез и электроосмос. Электрокинетический потенциал.
- •33. Поверхностно-активные вещества. Смачивание и его мера. Значение смачивания при действии пестецидов для борьбы с сорняками, с/х вредителями и болезнями
- •34. Строение мицеллы лиофобных коллоидных растворов.
- •35. Методы получения и очистки коллоидных систем.
- •36.Молекулярн-кинетические свойства коллоидных систем: броуновское движение, диффузия. Осмос в коллоидных системах.
- •37.Тердинамический и электрокинетический потенциал.
- •38. Обменная адсорбция.
- •39. Кинетическая и агрегативная устойчивость коллоидных систем.
- •40. Нарушение устойчивости гидрофобных коллоидов. Правила значимости и валентности.
- •41. Вязкость коллоидных растворов. Зависимость вязкости растворов вмс от pH.
- •42. Коагуляция лиофобных коллоидных растворов электролитами.
- •43.Теория электролитической диссоциации
- •48.Основные особенности коллоидного состояния вещества.
- •49. Вязкость. Уравнение Эйнштейна н Думанского.
- •53.Гидрофильные и гидрофобные поверхности. Смачивание и его мера.
- •54. Ориентация молекул в поверхностном слое.
- •55. Поверхностное натяжение. Адсорбции на поверхности растворов. Уравнение Гиббса.
53.Гидрофильные и гидрофобные поверхности. Смачивание и его мера.
По виду избирательного смачивания все твёрдые тела подразделяют на три основные группы:
1) Гидрофильные (или олеофобные) материалы, которые лучше смачиваются водой: кальций, кварц, большинство силикатов и окисленных минералов, галогениды щелочных металлов.
Гидрофильные в-ва интенсивно взаимодействуют с молекулами воды. Гидрофильность характеризуется величиной адсорбционной связи (см. Адсорбция)B-B с молекулами воды, образованием с ними неопределённых соединений и распределением кол-ва воды по величинам энергии связи. Гидрофильность преимущественно определяется величиной энергии связи адсорбционного монослоя, т. к. последующие слои связаны с в-вом гораздо слабее. Гидрофильность может выражаться теплотой адсорбции водяного пара или теплотой смачивания, а также работой смачивания единицы поверхности в-ва.
Абсолютно гидрофобных ("водоотталкивающих") в-в нет; даже наиболее гидрофобные - углеводородные и фторуглеродные - поверхности адсорбируют воду. Поэтому гидрофобность рассматривают как малую степень гидрофильности.
Г. и г. могут быть оценены, как и смачиваемость поверхности водой (в воздушной среде), величиной угла смачивания q: для гидрофильных поверхностей <90° (для абсолютно гидрофильных поверхностей q=0); для гидрофобных поверхностей 90°< <180° (напр., для парафина 105°). На трёхфазной границе твёрдого тела с водой и углеводородной жидкостью при <90° (в водной фазе) поверхность олеофобна, т.е. не смачивается маслом, а при =180° - предельно олеофильна.
Гидрофильными являются вещества с полярными хим. связями: галогениды, оксиды и их гидраты, карбонаты, сульфаты, фосфаты, силикаты и алюмосиликаты (глины, стекла), а также клеточные мембраны. Чистые поверхности металлов, углерода, полупроводников, вещества, состоящие из слабо полярных молекул, листья растений, кожа животных, хитиновый покров насекомых гидрофобны. Все полярные группы, входящие в состав молекул ПАВ - поверхностно-активных веществ - COOH, -NH2,-SO3Na и др., гидрофильны; связанные с ними углеводородные радикалы - гидрофобны.
Гидрофильность твёрдых тел может резко понижаться (происходит их гидрофобизация) при адсорбции (особенно при хемосорбции) на их поверхности молекул ПАВ, ориентированных полярными группами в сторону поверхности, а углеводородными цепями - в окружающую среду (напр., при адсорбции жирных кислот, их солей и др. органич. ПАВ на поверхности минералов). Обратная ориентация адсорбированных молекул ПАВ приводит к гидрофилизации гидрофобных поверхностей.
2) Гидрофобные ( олеофильные) материалы, которые лучше смачиваются неполярной жидкостью (мылом): графит, уголь, сера.
3) Абсолютно гидрофобные тела; в эту группу входят парафин, тефлон, битумы.
Смачивание, явление, возникающее при соприкосновении жидкости с поверхностью твёрдого тела или другие жидкости. Оно выражается, в частности, в растекании жидкости по твёрдой поверхности, находящейся в контакте сгазом (паром) или другой жидкостью, пропитывании пористых тел и порошков, искривлении поверхности жидкости у поверхности твёрдого тела. Так, смачивание вызывает образование сферического мениска в капиллярной трубке, определяет форму капли на твёрдой поверхности или форму газового пузырька, прилипшего к поверхности погруженного в жидкость тела. Смачивание часто рассматривают как результат межмолекулярного (вандерваальсова) взаимодействия в зоне контакта трёх фаз (тел, сред). Однако во многих случаях, например при соприкосновении жидких металлов с твёрдыми металлами, окислами, алмазом, графитом, смачивание обусловлено не столькомежмолекулярным взаимодействием, сколько образованием химических соединений, твёрдых и жидких растворов,диффузионными процессами в поверхностном слое смачиваемого тела. Тепловой эффект, сопровождающий соприкосновение жидкости со смачиваемой поверхностью, называется теплотой смачивания.
Мерой смачивания обычно служит краевой угол ϴ между смачиваемой поверхностью и поверхностью жидкости на периметре смачивания (рис. 1). Угол отсчитывают со стороны жидкости. При статическом (равновесном)смачивании он связан с поверхностным натяжением жидкости (σж), поверхностным натяжением твёрдого тела (т) имежфазным натяжением на границе твёрдое тело — жидкость (σтж) уравнением Юнга: cos ϴ = (σт — σтж)/(ж. Величиной угла оценивают лиофильность и лиофобность поверхностей по отношению к различным жидкостям. На лиофильной поверхности жидкость растекается, т. е. имеет место частичное (0° < ϴ < 90°) или полное смачивание (ϴ →0°); на лиофобной — растекания не происходит (ϴ >90°) (см. рис. 2). Краевой угол зависит от соотношения сил сцепления молекул жидкости с молекулами или атомами смачиваемого тела (адгезия) и сил сцепления молекулжидкости между собой (когезия). Обратимую работу адгезии и когезии вычисляют соответственно по уравнениям: Wa=σж (1 + cos ϴ) и Wk= 2σж. При Wa<WK всегда ϴ>0°, причём с увеличением отношения Wa<Wk улучшается смачивание. Разность S = Wa/Wk называется коэффициентом растекания. Часто наблюдаемая задержка в установлении равновесных краевых углов называется гистерезисом смачивания. Различают кинетический (динамический) и статический гистерезис смачивания. Причиной гистерезиса может быть шероховатость поверхности, особенности структуры поверхностного слоя, релаксационные процессы в жидкой фазе и др. Если твёрдое тело соприкасается одновременно с двумя несмешивающимися жидкостями, происходит избирательное смачивание. Эффективные регуляторы смачивания — поверхностно-активные вещества, которые могут как улучшать, так и ухудшатьсмачивание.
Смачивание имеет важное значение в природе, промышленной технологии, быту. Хорошее смачивание необходимо при крашении и стирке (см. Моющее действие), обработке фотографических материалов, нанесении лакокрасочных покрытий, пропитке волокнистых материалов, склеивании, пайке, амальгамировании и т. д. Снизить смачивание до минимума стремятся при получении гидрофобных покрытий, гидроизоляционных материалов и др. В некоторых случаях, например при флотации и эмульгировании твёрдыми эмульгаторами, требуется сохранение краевых углов в определённом интервале значений. Смачивание играет первостепенную роль в металлургических процессах, придиспергировании твёрдых тел в жидкой среде. Оно влияет на распространение грунтовых вод, увлажнение почв, разнообразные биологические и другие природные процессы. В развитие теории и разработку прикладных вопросовсмачивания большой вклад внесли П. А. Ребиндер, А. Н. Фрумкин, Б. В. Дерягин и др.

Рис. 2. Положение капли (пузырька) на твердой поверхности при различных условиях смачивания; г — газ; ж —жидкость; т — твёрдое тело.
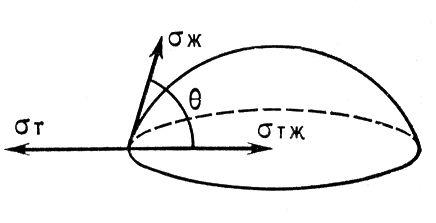
Рис. 1. Капля на твердой поверхности.
