
- •2. Второе начало термодинамики. Энтропия изолированной, закрытой и открытой систем.
- •3.Первое начало термодинамики. Тепловые эффекты химических реакций. Закон Гесса.
- •Закон Гесса
- •4 Вопрос. Система и внешняя среда. Изолированная, закрытая, открытая системы. Внутренняя энергия системы.
- •7.Функция состояния
- •8 Вопрос. Понижение температуры замерзания и повышение температуры кипения в зависимости от их концентрации.
- •9.Связь между энтальпией и внутренней энергией.
- •10. Электродные процессы. Возникновение потенциала на границе раздела фаз.
- •11.Окислительно-восстановительные электроды и цепи. Определитель окислительно-восстановительных потенциалов.
- •12. Осмотическое давление. Закон Вант-Гоффа.
- •13. Ионная сила растворов, активность, коэффициент активность электролитов.
- •14. Потенциометрический метод определения рН. Электроды с водородной функцией.
- •16 .Электроды 1-го рода.
- •17. Электроды II-го рода.
- •18. Слабые электролиты. Константа электролитической диссоциации. Закон разведения.
- •19.Адсорбция на твёрдых поверхностях. Уравнение Фрейндлиха, уравнение Ленгмюра.
- •20.Определение концентрации ионов в растворе методом измерения эдс гальванических цепей.
- •21. Электролитическая диссоциация воды. Шкала кислотности по отношениюк воде. Ионное произведение воды. Понятие рН и использование егов агрономии.
- •22. Электроды первого и второго рода. Уравнение Нернста для этих электродов.
- •24. Концентрационные цепи.
- •24. Нормальные потенциалы и ряд напряжений
- •25.Буферные растворы, их состав и механизм действия.
- •26. Диффузионные потенциалы.
- •27.Закон независимости движения ионов.
- •28. Теория электролитической диссоциации.
- •29.Изменение давления насыщенного пара над растворителем и над раствором в зависимости от температуры. Первый закон Рауля.
- •30. Удельная электропроводность и электролитическая подвижность ионов.
- •31. Развитие понятий кислота и основание. Теория Брэнстеда.
- •32. Электрокинетические свойства коллоидных систем. Электрофорез и электроосмос. Электрокинетический потенциал.
- •33. Поверхностно-активные вещества. Смачивание и его мера. Значение смачивания при действии пестецидов для борьбы с сорняками, с/х вредителями и болезнями
- •34. Строение мицеллы лиофобных коллоидных растворов.
- •35. Методы получения и очистки коллоидных систем.
- •36.Молекулярн-кинетические свойства коллоидных систем: броуновское движение, диффузия. Осмос в коллоидных системах.
- •37.Тердинамический и электрокинетический потенциал.
- •38. Обменная адсорбция.
- •39. Кинетическая и агрегативная устойчивость коллоидных систем.
- •40. Нарушение устойчивости гидрофобных коллоидов. Правила значимости и валентности.
- •41. Вязкость коллоидных растворов. Зависимость вязкости растворов вмс от pH.
- •42. Коагуляция лиофобных коллоидных растворов электролитами.
- •43.Теория электролитической диссоциации
- •48.Основные особенности коллоидного состояния вещества.
- •49. Вязкость. Уравнение Эйнштейна н Думанского.
- •53.Гидрофильные и гидрофобные поверхности. Смачивание и его мера.
- •54. Ориентация молекул в поверхностном слое.
- •55. Поверхностное натяжение. Адсорбции на поверхности растворов. Уравнение Гиббса.
1. Первое начало термодинамики. Изменение внутренней энергии при постоянных объеме и давлении. Энтальпия.
Первое начало термодинамики. Энергия данной системы не исчезает и не появляется вновь, а только переходит из одной формы в другую в строго эквивалентных количествах.
Математически этот закон выражается уравнением:
Е = const,
где Е – энергия, - сумма, const – сокращенное constans – постоянный, неизменный.
Первое начало термодинамики устанавливает связь между количеством энергии, полученной или выделенной системой в каком-либо процессе в виде теплоты Q, количеством произведенной или полученной работы W и изменением внутренней энергии системы U:
U = W ± Q,
Процессы при постоянном объеме
Если процесс изохорный, т.е. если он совершается при постоянном объеме (V = const), то работа не совершается, поскольку при V = const, V = 0 и, следовательно:
W = -P V = 0
Знак минус в этом уравнении указывает на то, что система работает против сил внешней среды. В этом случае:
U = Q ,
где Qv - количество энергии (Дж/моль или кал/моль), выделенной или поглощенной системой в виде теплоты в ходе процесса при постоянном объеме. Теплота процесса равна изменению внутренней энергии системы и зависит только от конечного и начального состояния системы, т.е.
В реальной жизни часто встречаются изобарные процессы, протекающие при постоянном давлении (Р = const), например, химические реакции, идущие при атмосферном давлении. Изменение внутренней энергии системы в этом случае будет равно
U = U2 – U1 = W + Qp
где Qp - количество энергии (Дж/моль или кал/моль), выделенной или поглощенной системой в виде теплоты в ходе процесса при постоянном давлении. Поскольку в ходе процессов, идущих при Р = const объем системы изменяется, то работа в таких процессах будет равна величине
W = -P (V2 - V1)
Отсюда:
U2 – U1 = Qp – P(V2 - V1).
В результате тепловой эффект процесса, протекающего при Р = const будет равен Qp = U2 – U1 + P (V2 - V1)
Qp = (U2 + PV2) – (U1 + PV1).
U2 – U1 = U = Q
Процессы при постоянном давлении. Энтальпия.
Величина (U + PV) обозначается буквой Н и называется энтальпией. Энтальпия, также как внутренняя энергия, является функцией состояния, т.е. изменение энтальпии (Н = H2 – Н1) при переходе системы из состояния 1 в состояние 2 при постоянном давлении не зависит от пути перехода, а зависит только от величин энтальпии в конечном (2) и начальном (1) состояниях. Таким образом, тепловой эффект процесса, идущего при постоянном давлении будет равен:
Qp = H2 – Н1 = Н
Первое начало термодинамики дает только энергетическую оценку процессов, протекающих при постоянном объеме или постоянном давлении, но не дает никаких указаний о направлении процесса и предела, до которого изучаемый процесс может идти самопроизвольно
2. Второе начало термодинамики. Энтропия изолированной, закрытой и открытой систем.
Второе начало термодинамики. Энергия самопроизвольно перемещается от системы с более высоким потенциалом к системе с более низким потенциалом энергии того же вида, до тех пор, пока не наступит термодинамическое равновесие.
Изменение
энтропии равно тепловому эффекту
процесса, деленному на абсолютную
температуру, при которой он происходит,
и измеряется в
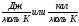 .
Для обратимых
изотермических превращений изменение
энтропии равно
.
Для обратимых
изотермических превращений изменение
энтропии равно
∆ S
=
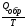 ,
,
где Qобр – часть общего количества энергии, выделенной системой в виде тепла. Таким образом, если S = 0, то процесс обратимый. Данное уравнение является математическим выражением второго начала термодинамики для обратимых процессов, происходящих в изолированной системе.
Для необратимых химических процессов, протекающих в изолированной системе, второе начало термодинамики имеет следующий вид:
∆ S
>
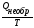
Таким образом, если в изолированной системе протекает самопроизвольный (необратимый) процесс, то S > 0.
Процессы, для которых
∆ S
<
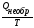
самопроизвольно осуществляться в изолированной системе при постоянной температуре не будут. Энтропия как критерий направленности самопроизвольных (необратимых) процессов может быть использована только для характеристики процессов в изолированных системах.
Физический смысл энтропии сводится к характеристике меры хаоса (беспорядка) в системе. Чем больше изменение энтропии в системе, тем меньше полезной работы может совершить данная система.
3.Первое начало термодинамики. Тепловые эффекты химических реакций. Закон Гесса.
Тепловые эффекты химических реакций.
Рассмотрим закрытую термодинамическую систему, в которой происходит химическая реакция по следующему стехиометрическому уравнению:
аА+bB→cC+dD
В начальном состоянии, внутренняя энергия которгого U1, имеется а моль реагента А и b моль реагента В. В конечном состоянии с внутренней энергией U2 образуется с моль продукта С и d моль продукта D. Теплота этой реакции при температуре Т- это тепловая энергия, которая выделяется или поглощается при взаимодействии реагентов А и В в стехиометрических пропорциях с образованием продуктов С и D; реагенты и продукты реакции находятся при одной и той же температуре Т.
Теплота реакции при постоянном объеме( Qv)
Это тепловая энергия, которая выделяется или поглощается в ходе реакции. В этом случае Qv соответствует изменению внутренней энергии между начальным и конечным состояниями:
∆U= U2- U1=Qv
Если величина Qv положительна, то реакция эндотермическая; система поглощает тепловую энергию в ходе реакции, внутренняя энергия реагентов ( А и В) меньше внутренней энергии продуктов ( C и D).
Если величина Qv отрицательна, то реакция экзотермическая: сиситема выделяет тепловую энергию в ходе реакции, внутренняя энергия реагентов выше внутренней энергии продуктов.
Реакции при постоянном объеме могут идти, например, в следующих условиях: 1) в закрытом сосуде;2) между твердыми телами и жидкостями без выделения газа; 3) между газами, если число молекул остается постоянным; например,
Н2(г)+ Сl2( г)→2HCl(г)
Теплотой реакции при постоянном давлении Qp при температуре Т называется тепловая энергия, которая выделяется или поглощается в ходе реакции при потоянном давлении; реагенты и продукты реакции приводятся в стехиометрических количествах при температуре Т начального состояния.
Теплота реакции равна изменению энтальпии ∆Н:
Qp=∆Н
Если величина Qp положительна, то реакция эндотермическая: энтальпия продуктов реакции выше энтальпии реагентов. Если величина Qp отрицательная, то реакция экзотремическая: энтальпия продуктов реакции ниже энтальпии реагентов.
Стандартное состояние
Для любого чистого вещества это физическое состояние, в котором вещество наиболее устойчиво при давлении 101,3 кПа и определенной температуре( 298К)
Соотношение между Qp и Qv для реакции между идеальными газами
Если реакция происходит между идеальными газами , то можно установить соотношение между Qpи Qv реакция: аА+bB→cC+dD где реагенты и продукты находятся при одинаковой температуре и в стехиометрических количествах.
Если реакция идет при постоянном давлении р и если V2 и V1- соответственно объемы конечного и начального состояний, то изменение внутренней энергии ∆U=Q+А= Qp-р(V2- V1)
Если реакция протекает при постоянном объеме и образующиеся продукты занимают объем V при температуре Т и давлении р', то изменение внутренней энергии реакции будет ∆U'= Qv
Согласно закону Джоуля внутренняя энергия идеального газа зависит только от температуры.
Qp= Qv+∆nRT
∆n- разница между количеством вещества( молей) образовавшихся газообразных продуктов и количеством вещества ( молей) газообразных реагентов; R- универсальная газовая постоянная.
Это соотношение устанавливает связь между теплотой реакции при постоянном давлении(Qpили ∆Н) и теплотой реакции при постоянном объеме(Qvили ∆U).
