
- •Изониазид
- •Фтивазид Phthivazidum (Фтивазид)
- •Nialamidum (Ниаламид)
- •Апоморфин реакции обнаружения Реакции с реактивами группового осаждения алкалоидов
- •Количественный анализ:
- •Качественные реакции
- •Ампициллин
- •Бензилпенициллин
- •Меркаптопурин.
- •Метотрексат.
- •Рибафлавин
- •Тетрациклин
- •Метациклин
- •Гистамин (Нistaminum) c5h9n3
- •Ранитиди́н (Ranitidin) c13h22n4o3s
- •Хлоропирамин «Супрастин» c16h20ClN3
- •Димедрол -Дифенгидрамин (Diphenhydramine) c17h21no
- •Дротаверина гидрохлорид (Ho-шпa)
- •Количественное определение
- •Специфические реакции
- •Количественное определение
- •Количественное определение
- •Хинозол
- •Метилурацил - Methyluraciium.
- •Частные реакции
- •Количественное определение
- •Кокарбаксалазы гидрохлорид
- •Количественное определение
- •Barbital — барбитал
Camphora — камфора бициклический терпен
Горит светлым пламенем, флуоресцирует в УФ-свете.
Ввиду наличия в молекуле двух асимметрических атомов углерода существуют d-камфора (правовращающий изомер), /-камфора (левовращаюший изомер) и рацемическая камфора.
Качественные реакции: 1)реакция конденсации с ароматическими альдегидами (например, с ванилином) в присутствии концентрированной H2SО4. Продукт реакции окрашен в малиновый цвет за счет наличия в структуре системы сопряженных двойных связей.


2)При конденсации камфоры с пара-диметиламинобензальдегидом, образуется продукт конденсации, окрашенный в красный цвет, с фурфуролом - в фиолетовый:


3) Реакции присоединения-отщепления на кето-группу.
При взаимодействии кетогруппы с гидроксиламином образуются оксимы, а с производными гидразина – гидразоны(оранж-желтый).Образующиеся продукты - кристаллические вещества, характеризующиеся четкой Тпл, что можно использовать для характеристики подлинности или при количественном анализе ЛС:


4) Подлинность камфоры можно подтвердить по температурам плавления и УФ-спектрам других производных камфоры.
5) с использованием метода УФ-спектрофотометрии. 6)ГЖХ метод
Для количественного определения камфоры используют оксимный способ, основанный на взаимодействии камфоры с определенным количеством гидрохлорида гидроксиламина
Количественное определение камфоры может быть также выполнено гравиметрическим методом по содержанию 2,4-динитрофенилгидразона. Также методом ГЖХ
Bromcamphora гасеmata — бромкамфора рацемическая бициклический терпен
Испытание подлинности для бромкамфоры.
2) УФ-спектрофотометрия.
3)ИК-спектр испытуемого вещества
4)При нагревании бромкамфоры с концентрированной серной кислотой раствор приобретает красно-бурое окрашивание. После охлаждения и осторожного добавления воды жидкость сохраняет красно-бурый цвет.
1)Испытание на подлинность и количественное определение бромкамфоры (по ФС) основано на отщеплении атома брома от органической части молекулы. Этот процесс происходит в сравнительно «мягких» условиях при нагревании бромкамфоры в присутствии цинковой пыли и гидроксида натрия в течение 1-2 мин:
В фильтрате затем обнаруживают бромид-ионы по реакции с хлорамином.
![]()
Для количественного определения 1)навеску бромкамфоры кипятят в присутствии 30%-ного раствора гидроксида калия и цинковой пыли в течение 30 мин, после чего используют обратное аргентометрическое титрование дли определения образовавшегося эквивалентного количества бромида калия.
2)Устанавливают содержание бромкамфоры и методом сжигания в кислороде.
3)ИК спектрометрия
Бромкамфору хранят по списку Б при температуре не выше 25°С, в банках оранжевого стекла, в защищенном от света месте.
Фурацилин (нитрофурал) NitrofuralПроизводные 5-нитрофурана
Ввиду наличия не только нитро-, но и имидной группы нитрофурал проявляет в растворах кислотные свойства и лучше других растворяется в щелочах.
Для испытания подлинности используют 1)УФ и ИК-спектры производных нитрофурана.
2)Нитрофурал при использовании разбавленных растворов щелочей образует ацисоль, окрашенную в оранжево-красный цвет:
![]()
3)При нагревании нитрофурала в растворах гидроксидов щелочных металлов происходит разрыв фуранового цикла. аммиак обнаруживают по изменению окраски влажной красной лакмусовой бумаги:
+ H2N-NH2 + Na2C03 + NH3
Эта реакция может быть использована для отличия нитрофурала от нитрофурантоина и фуразолидона.
4) спиртовый раствор гидроксида калия в сочетании с ацетоном: нитрофурал приобретает темно-красное окрашивание
5)Нитрофурал идентифицируют с помощью общей реакции образования 2,4-динитрофенилгидразона (температура плавления 273°С). Он выпадает в осадок при кипячении раствора лекарственного вещества в диметилформамиде с 2,4 динитрофенилгидразина и раствора хлороводородной кислоты.
6)Раствор нитрофурала в диметилформамиде после добавления свежеприготовленного 1%-ного раствора нигропруссида натрия и I М раствора гидроксида натрия дает красное окрашивание.
7)Производные нитрофурана образуют в слабощелочной среде окрашенные нерастворимые комплексные соединения с солями серебра, мели, кобальта и других тяжелых металлов. Комплексные соединения нитрофурала не извлекаются хлороформом.
8)Окислительно-восстановительные реакции (образования «серебряного зеркала», с реактивом Феллинга) могут быть выполнены после щелочного гидролиза, сопровождающегося образованием альдегидов.
Количественное определение 1)проявляющего восстановительные свойства нитрофурала выполняют йодометрическим методом, основанным на окислении йодом в щелочной среде (для улучшения растворимости к навеске прибавляют хлорид натрия и смесь подогревают). Титрованный раствор иола в щелочной среде образует гипойодит:
12 + 2NaOH > Nal + NalO + Н20
Гипойодит окисляет нитрофурал до 5-нитрофурфурола:
![]()
![]()
NaI + NaIO + H2SO→I2 + Na2S04 + Н20
I2 + 2Na2S203 →2NaI + Na2S4O6
2) броматометрическим методом, основанным на окислении гидразиновой группы в присутствии концентрированных кислот H2N - NH2 →N2 + 2Н20
3) фотоколориметрическим методом, основанным на использовании цветных реакций с едкой щелочью в различных растворителях.
Фуразолидон Furazolidon Производные 5-нитрофурана
Для испытания подлинности используют 1)ИК-спектры 2)УФ спектры.
3 )Раствор
фуразолидона с щелочами, но при нагревании
приобретает бурое окрашивание за счет
разрыва лактонного цикла и образования
ацисоли
)Раствор
фуразолидона с щелочами, но при нагревании
приобретает бурое окрашивание за счет
разрыва лактонного цикла и образования
ацисоли
Эта реакция может быть использована для отличия нитрофурала от нитрофурантоина и фуразолидона.
4)Фуразолидон и нитрофурантоин можно отличить друг от друга по различной окраске продуктов взаимодействия с емкими щелочами в среде неводных растворителей основного характера, например диметилформамида. В качестве реактива используют водно-епиртовый раствор гидроксида калия. Фуразолидон приобретает красно-фиолетовое окра шивание. переходящее в темно-синее, а затем в фиолетовое или красно-фиолетовое.
5)Характерные цветные реакции, позволяющие отличать друг от друга производные 5-нитрофурана, дает спиртовый раствор гидроксида калия в сочетании с ацетоном: фуразолидон — постепенно появляющееся красное окрашивание, переходящее в бурое.
6)фуразолидон идентифицируют с помощью общей реакции образования 2,4-динитрофенилгидразона (температура плавления 273°С). Он выпадает в осадок при кипячении раствора лекарственного вещества в диметилформамиде с насыщенным раствором 2,4 динитрофенилгидразина и 2 М раствора хлороводородной кислоты.
7)Фуразолидон в диметилформамиде после добавления свежеприготовленного 1%-ного раствора нитропруссида натрия и I М раствора гидроксида натрия дает оливково-зеленое окрашивание.
8)Производные нитрофурана образуют в слабощелочной среде окрашенные нерастворимые комплексные соединения с солями серебра, мели, кобальта и других тяжелых металлов. Комплексные соединения фуразолидона не извлекаются хлороформом.
9)Окислительно-восстановительные реакции (образования «серебряного зеркала», с реактивом Фелинга) могут быть выполнены после щелочного гидролиза, сопровождающегося образованием альдегидов.
Фуразолидон количественно определяют методом 1)неводного титрования в диметилформамиде. Титруют 0,1 М раствором метилата натрия (индикатор тимоловый синий).
2) фотоколориметрическим методом, основанным на использовании цветных реакций с едкой щелочью в различных растворителях.
Натрия кромогликат (кромолин-натрий, интал) Производные бензо-у-пирона
Подлинность натрия кромогликата устанавливают с помощью 1)ИК-спектров, УФ-спектров
2)Натрия кромогликат дает положительную реакцию на ион натрия, который обнаруживают по реакции с цинкуранилацетатом (образуется желтый крист ос).
3)При добавлении к раствору натрия кромогликата в метаноле раствора 4-аминоантипирина через 5 мин появляется интенсивное желтое окрашивание.
Количественное определение натрия кромогликата выполняют методом неводного титрования (МФ) в смеси пропиленгликоля, 2-пропанола и диоксана (25:5:30). Титрант — 0,1 М раствор хлорной кислоты в диоксане. Конечную точку титрования устанавливают потенциометрическим методом. выполняют количественное спсктро- фотометрическое определение натрия кромогликата.
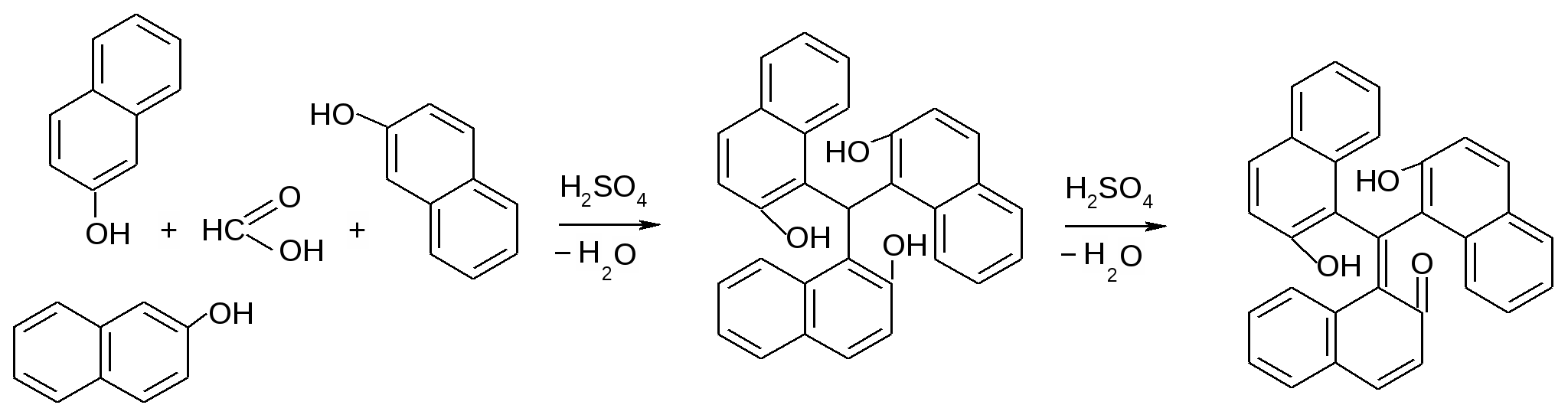
Рутин (рутозид) Флавоноиды (витамины группы Р)
Являясь многоатомными фенолами, они растворимы в разбавленных растворах едких щелочей.
По химической структуре рутин относится к гликозидам. Сахарная часть его молекулы — дисахарид — включает D-глюкозу и L-рамнозу. Агликоном является кверцетин, который применяют в виде индивидуального лекарственного вещества с Р-витаминной активностью.
Для испытания на подлинность флавоноидов используют 1)ИК-, УФ-спектрофотометрию, ПМР-спектроскопию.
2)Для испытания подлинности рутозида используют цветную реакцию с раствором гидроксида натрия (желто-оранжевое окрашивание). Окраска обусловлена превращением флавоноида в халкон с раскрытием пиранового цикла

3) при действии на рутозид порошком магния и концентрированной хлороводородной кислотой в спиртовой среде (красное окрашивание). Это испытание известно под названием цианиновой реакции. Она основана на образовании окрашенных пирилиевых солей при восстановлении водородом флавоноидов, в том числе рутозида
![]()
![]()
4)Наличие фенольных гидроксилов в молекуле рутозида легко установить цветной реакцией с хлоридом железа (III) (темно-зеленое окрашивание). При действии на спиртовый раствор рутозида 10% раствором молибдата аммония образуется комплексное соединение лимонно-желтого цвета с максимумом поглощения в области 380-390 нм.
5)Рутозид образует комплексные соединения с солями других тяжелых металлов, например с солями свинца (выпадает оранжевый осадок). Присутствие в его молекуле фенольного гидроксила обусловливает положительную реакцию с раствором формальдегида в серной кислоте (красно-оранжевое окрашивание) и реакцию образования азосоединения с солью диазония (красно-бурая окраска). Окрашенные продукты получаются при взаимодействии рутозида с нитритом натрия в присутствии серной кислоты.
6)Подлинность рутозида подтверждают также путем кислотного гидролиза, который происходит в результате кипячения (с обратным холодильником) в присутствии серной кислоты. Образующийся кверцетин, перекристаллизованный из этанола, имеет температуру плавления 308"С. Эту методику используют для гравиметрического определения рутозида.
Наличие глюкозы в молекуле рутозида обнаруживают после гидролиза в кислой среде с помощью реактива Фелинга.
Количественное определение рутозида выполняют методом1)УФ-спектрофотометрии. 2)фотометрического
.
Кверцетин Quercetin Флавоноиды (витамины группы Р)
Для испытания на подлинность флавоноидов используют 1)ИК-, УФ-спектрофотометрию, ПМР-спектроскопию.
2)используют цветную реакцию с раствором гидроксида натрия (желто-оранжевое окрашивание). Окраска обусловлена превращением флавоноида в халкон с раскрытием пиранового цикла
3)Цветная реакция происходит при действии на кверцетин порошком магния и концентрированной хлороводородной кислотой в спиртовой среде (красное окрашивание). Это испытание известно под названием цианиновой реакции. Она основана на образовании окрашенных пирилиевых солей при восстановлении водородом флавоноидов
4)Наличие фенольных гидроксилов в молекуле кверцетина легко установить цветной реакцией с хлоридом железа (III) (темно-зеленое окрашивание).
5)Присутствие в молекуле кверцетина фенольного гидроксила обусловливает положительную реакцию с раствором формальдегида в серной кислоте (красно-оранжевое окрашивание) и реакцию образования азосоединения с солью диазония (красно-оранж окраска). Окрашенные продукты получаются при взаимодействии кверцетина с нитритом натрия в присутствии серной кислоты.
Количественное определение выполняют методом 1)УФ-спектрофотометрии. 2)фотометрического определения с использованием рассмотренных выше цветных реакций.
Platyphylline Hydrotartrate — платифиллина гидротартрат ПРОИЗВОДНЫЕ ПИРРОЛИЗИДИНА
Подлинность устанавливают по1) ИК-спектру и ГЖХ метод.
2) дает положительную гидроксамовую реакцию. Суть: образование гидроксамовой кислоты при взаимодействии сложного эфира с гидроксиламином. От последующего воздействия солями железа (III) образуется окрашенная в красно-фиолетовый цвет внутри комплексная соль — гидроксамат железа (III)
3) с помощью общеалкалоидных реактивов (третичная аминогруппа), из которых наиболее чувствительным является реактив Майера (белый осадок).
4)Платифиллина гидротартрат при окислении образует окрашенные соединения. Если к нескольким кристаллам платифиллииа гидротартрата прибавить раствор дихромата калия, раствор пергидроля в ацетоне (1:10) и хлороформ, слой последнего окрашивается в синий цвет. При последовательном прибавлении к раствору платифиллина гидротартрата капли раствора сульфата железа (II), пероксида водорода и щелочи появляется фиолетовое окрашивание.
5)Наличие винной кислоты устанавливают с помощью реакции, основанной на ее взаимодействии с ионом калия. Реакция сопровождается образованием белого осадка гидротартрата калия

6)Присутствие связанной винной кислоты можно установить по 'зеленому окрашиванию, которое возникает при нагревании на водяной бане смеси платифиллина гидротартрата с концентрированной серной кислотой в присутствии В-нафтола. Реакция основана на образовании глиоксаля и муравьиной кислоты в результате дегидратирующего действия концентрированной серной кислоты на винную кислоту

Если вместо В-нафтола использовать резорцин, то появляется красно-фиолетовая окраска ауринового красителя резорцина.
7)Наличие связанной винной кислоты устанавливают также с помощью 0,1 М раствора нитрата серебра, под действием которого выпадает осадок серебряной соли винной кислоты.
Количественное опр:неводное титрование, метод нейтрализации в присутствии хлороформа, обратное йодометрическое титрование, косвенное комплексонометрическое титрование,ГЖХ, спектрофотометрия, фотоколориметрия, экстракционно-фотометрический метод.
Серотонин (5-окситриптамин) — ПРОИЗВОДНЫЕ ИНДОЛА биогенный амин, образующийся в организме путем биосинтеза из триптофана. Серотонина адипинат- Производное индолилалкиламинов
Для испытания подлинности используют 1)ИК- и УФ-спектрофотометрию.
2) с нингидрином приобретает красное окрашивание. Аналогичное окрашивание возникает, если подействовать па него селенистой кислотой.
3)Пурпурно-красное окрашивание возникает в присутствии формальдегида, ванилина, зеленое — под действием бензойного и салицилового альдегидов, синее — от п-диметиламинобензальдегида.
4) под действием насыщенного раствора пикриновой кислоты образует оранжево-красный осадок пикрата. При добавлении диазореактива щелочной раствор серотонина адипината окрашивается в красно-коричневый цвет, т. к. образуется азокраситель:

5)Для выделения и обнаружения связанной с серотонином адипиновой кислоты к 10%-ному водному раствору прибавляют концентрированную хлороводородную кислоту. Выпавший через 10 минут осадок адипиновой кислоты после очистки и высушивания должен иметь температуру плавления 149-153°С
Количественное опр: неводное титрование(ледяная уксусная кислота, титрант-хлорная кислота, индикатор- кристалл. фиолетовый); потенциометрия; спектрофотометрия; фотоколориметрия.
Индометацин Производное индолилалкиламинов
Для испытания подлинности используют ИК- и УФ-спектрофотометрию.
Химические реакции: 1)+ гидроксида натрия+ раствора нитрита натрия и оставляют на 5 мин, после чего прибавляют 0,5 мл серной кислоты - появляется темно-желтое окрашивание.
2)прибавляют раствора нитрита натрия и через 5 минут - 0,5 мл концентрированной соляной кислоты. Появляется зеленое окрашивание.
3) прибавляют раствора гидроксида натрия, фильтруют. С фильтратом проводят реакции с хлоридом железа (III), сульфатом меди, нитратом кобальта.
Количественное определение
В лекарственных формах (капсулах) индометацин определяют спектрофотометрическим методом.
Известен способ определения индометацина методом ВЭЖХ. Хроматографируют с использованием подвижной фазы вода-смесь моно- и дизамещенного гидрофосфатов натрия в ацетонитриле (1:1). Детектируют при длине волны 254 нм, стандартный раствор — РСО индометацина.
В водно-органической среде (ацетон) проводится количественноеопределение индометацина методом алкалиметрии: титрант-NaOH, индикатор-фенолфталеин

Арбидол Производное индолилалкиламинов
Для испытания подлинности используют ИК- и УФ-спектрофотометрию.
Арбидол дает цветную реакцию на наличие третичного азота. При нагревании над пламенем сухой смеси арбидола со смесью для спекания остаток растворяют в воде, фильтруют и выполняют реакции на бромиды и сульфаты, образовавшиеся за счет наличия в молекуле арбидола атомов брома и серы:
![]()
Фильтрат, полученный после встряхивания арбидола с раствором азотной кислоты, дает положительную реакцию на хлориды.
Для количественного определения используют химические и физико-химические методы. Количественное определение арбидола выполняют методом неводного титрования. В качестве растворителя используют смесь уксусного ангидрида с муравьиной кислотой (арбидол),. Титрантом служит 0,1 М раствор хлорной кислоты, индикатором — кристаллический фиолетовый. Для установления конечной точки титрования используют также потенциометрию.
Эргометрин Ergometrine Maleate. Производные эрголина (эргоалкалоиды и их производные)
Для испытания подлинности используют 1)ИК- и УФ-спектрофотометрию, ВЭЖХ, ТСХ, ПМР. Для испытания подлинности используют также цветные и флуоресцентные реакции. Учитывая чувствительность эргоалкалоидов к свету, испытания выполняют в защищенном от света месте. 2)Голубую флуоресценцию в УФ-свете имеют водный раствор эргометрина малеата. 3)Водный раствор эргометрина малеата обесцвечивает бромную воду.
Количественное определение проводят методом неводного титрования 0,1 VI раствором хлорной кислоты в среде ледяной уксусной Процесс титрования выполняют с использованием индикатора кристаллического фиолетового или устанавливают конечную точку титрования потенциометрически.
С пектрофотометрию
в УФ области -оптическую плотность
измеряют при длине волны 545 нм.
пектрофотометрию
в УФ области -оптическую плотность
измеряют при длине волны 545 нм.
Эргометрина малеат является специфическими средствами, стимулирующими мускулатуру матки.
Метамизол-натрий производные пиразолона-5
Для испытания на подлинность производных пиразола используют ИК- и УФ-спектрофотометрию
реакции окисления. 1)С раствором хлорида железа (111) образует продукты окисления, окрашенные в синий цвет. Окраска быстро изменяется под влиянием различных факторов (температура, pH среды и т. д.).
2)При добавлении 0,1 М раствора йода раствор метамизола-натрия приобретает фиолетовую или красно-фиолетовую окраску, переходящую от избытка реактива в бурую.
3) Добавление к подкисленному серной кислотой 10%-ному водному раствору метамизола-натрия раствора хлорной извести приводит к появлению голубого окрашивания, переходящего в зеленое, а затем в желтое.
4)под действием концентрированной серной кислотой в присутствии нитрита натрия.— буро-желтое окрашивание.
5)При действии раствора дихромата калия в концентрированной серной кислоте зеленое окрашивание
6 )
при добавлении раствора серебра нитрита
– белый осадок, переходящий в темный;
при добавлении калия йодида в соляной
кислой среде, раствор окрашивается в
малиновый цвет. При прибавлении избытка
калия йодида окраска усиливается, а
затем выделяется бурый осадок йода:
)
при добавлении раствора серебра нитрита
– белый осадок, переходящий в темный;
при добавлении калия йодида в соляной
кислой среде, раствор окрашивается в
малиновый цвет. При прибавлении избытка
калия йодида окраска усиливается, а
затем выделяется бурый осадок йода:
7)Метамизол-натрий, в отличие от других производных пиразолона-5, дает положительную реакцию на ион натрия, а при нагревании на водяной бане с минеральными кислотами выделяет диоксид серы и формальдегид, которые обнаруживают по запаху:
После охлаждения прибавляют раствор хлорида железа (III); через 2 мин появляется темно-красное окрашивание.
7)Если реакцию с минеральными кислотами выполнять в присутствии концентрированной серной и салициловой кислот, то образуется (за счет выделяющегося формальдегида) ауриновый краситель, имеющий интенсивное красное окрашивание.
8)При окислении раствором йодата калия в присутствии хлороводородной кислоты раствор приобретает малиновое окрашивание. От избытка реактива окраска усиливается, а затем выделяется бурый осадок Йода. Происходит это за счет взаимодействия йодата калия с образующимся при гидролизе метамизола-натрия диоксидом серы
5S02 + 2К10з→ 4S03 + l2 + K2SO4
9)Серу обнаруживают также путем прокаливания в смеси карбонатов натрия и калия в течение 10 мин. Плав охлаждают, растворяют в азотной кислоте и фильтруют. Образовавшиеся сульфат-ионы обнаруживают с помощью раствора хлорида бария.
10) под действием раствора сульфата меди (И) приобретают зеленое окрашивание. Производные пиразола ввиду наличия основных свойств дают характерные реакции с осадительными (общеалкалоидными) реактивами. При нагревании метамизола-натрия с реактивом Миллона (раствор ртути в азотной кислоте) возникает темно-синее окрашивание
Количественное определение 1)Йодометрическое определение 2)Метамизол-натрий можно определить по сульфат-иону, который образуется в результате окисления 3%-ным раствором пероксида водорода. Затем титруют раствором хлорида бария. 3) методики косвенного комплексонометрического и ацидиметрического определения метамизола-натрия
Производные пиразола применяют в качестве болеутоляющих, жаропонижающих и противовоспалительных средств.
Бутадион фенилбутазон производные пиразола
Для испытания на подлинность производных пиразола используют ИК- и УФ-спектрофотометрию
используют реакции окисления.1) с хлоридом железа 3 в жестких условиях (действием концентрированной серной кислотой в присутствии нитрита натрия). При нагревании появляется оранжевое окрашивание, переходящее в более стойкое вишневое окрашивание, и выделяются пузырьки газа. Реакции окисления фенилбутазона обусловлены наличием в его молекуле остатка гидразобензола, который окисляется до окрашенных производных азобензола
2)При действии раствора дихромата калия в концентрированной серной кислоте— темно-красное.
3)Фенилбутазон можно идентифицировать реакциями осаждения солями: меди (осадок бледно-голубого цвета); серебра (белого цвега) и т. д. Для выполнения реакции вначале получают натриевую соль фенилбутазона, действуя раствором гидроксида натрия (происходит образование енольной формы)
Колич опр Йодхлорометрическое определение, основанное на реакции замещения, можно использовать для определения фенилбутазона, который растворяют при нагревании в 0,1 М растворе гидроксида натрия, нейтрализуют 0,1 М раствором хлороводородной кислоты и в среде натрия гидрокарбоната титруют 0,1 М раствором йодмонохлорида (индикатор крахмал):
Описан способ цериметрического определения фенилбутазона в водно-спиртовой среде в присутствии серной кислоты. В кислой среде при нагревании происходит гидролиз фенилбутазона с образованием гидразобензола, который окисляется сульфатом церим до азобензола
Количественное определение сновано на нейтрализации раствора навески в ацетоне 0,1 М раствором гидроксида натрия с применением индикатора фенолфталеина.Производные пиразола применяют в качестве болеутоляющих, жаропонижающих и противовоспалительных средств.
Антипирин феназон производный пиразола
Для испытания на подлинность производных пиразола используют ИК- и УФ-спектрофотометрию
используют реакции окисления. 1)с нитратом серебра положительной реакции не дает. 2)Феназон под действием концентрированной серной кислотой в присутствии нитрита натрия приобретает красно-оранжевое,
3)При действии раствора дихромата калия в концентрированной серной кислоте феназон приобретают зеленое окрашивание.
4)Подлинность феназона подтверждают реакцией образования окрашенной в красный цвет комплексной соли — феррифеназона и по реакции с йодом, вследствие которой получается осадок 4-йодофеназона.
5)Для отличия феназона от других производных пиразола ФС рекомендует реакцию образования окрашенного в изумрудно-зеленый цвет нитрозофеназона
6)Можно использовать специфичную для феназона цветную реакцию, основанную на образовании окрашенного соединения с раствором 2-нитроиндандиона(орнаж окраш). а также реакцию образования пиразолонового азокрасителя феназона альфа-нафтиламином(фиолет-красное окраш)
7)Феназон под действием раствора сульфата меди (И) приобретают зеленое окрашивание.
8)Производные пиразола ввиду наличия основных свойств дают характерные реакции с осадительными (общеалкалоидными) реактивами.
-с танином серый осадок
-с пикрин кислотой желтый осадок
-с сулемой HgCl2 белый осадок
-реактив Бушарда (KJ3) бурый осадок
-реактив Майера желто-орнаж осадок
Для количественного анализа используют реакции замещения, а также восстановительные, основные или кислотные свойства растворов производных пиразолона.
Йодометрическое определение феназона (обратное титрование) основано на его способности вступать с йодом в реакцию замещения за счет подвижного атома водорода в положении 4. Образующийся осадок 4-йодофеназона может адсорбировать некоторое количество йода. Поэтому
Осадок
растворяют в хлороформе. Добавляют
также ацетат натрия, чтобы предотвратить
обратную реакцию. Избыток йода
оттитровывают раствором тиосульфата
натрия
HI + CH3COONa > Nal + CH3COOH
Образование 4-йодофеназона лежит в основе йодхлорометрического определения феназона. Оно может быть выполнено прямым титрованием 0,1 М раствором йодмонохлорида (индикатор крахмал) в присутствии 1 капли 1%-ного раствора йодида калия или по избытку йодмонохлорида (обратное титрование) в присутствии 10 мл 10%-ного раствора йодида калия. Выделившийся при этом йод титруют 0,1 М раствором тиосульфата натрия (индикатор крахмал).
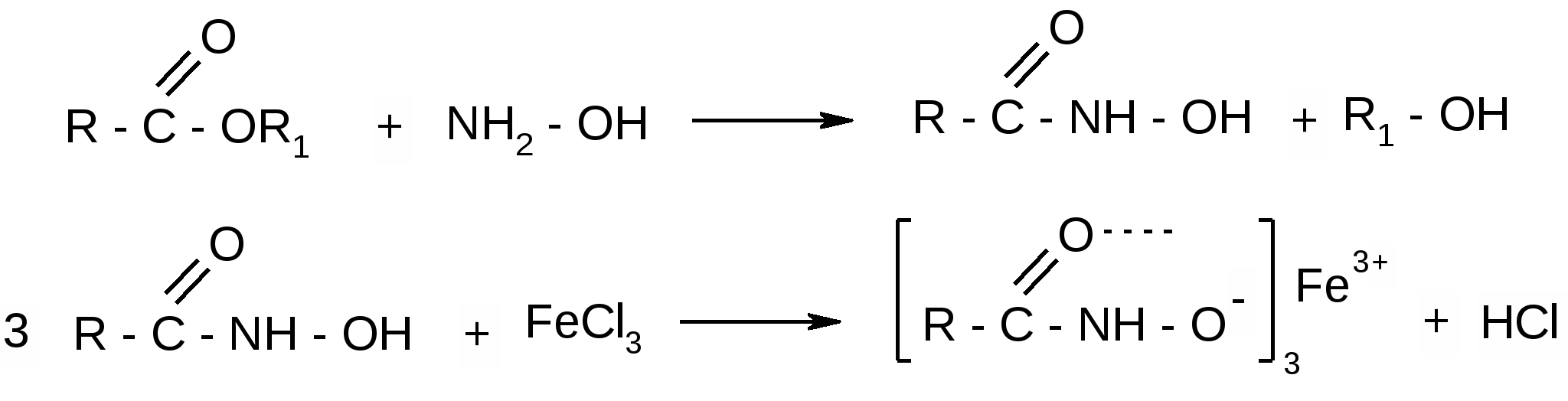
Изониазид
Гидразид-4-пиридинкарбоновый кислоты
Подлинность:
1.R-CONH-NH2 +NaOH à R-COONa +NH2-NH2

Происходит конденсация альдегида с гидразином с образованием альдазина, который растворяясь в кислоте, образует хиноидный катион вишнёво-красного цвета.
2. Образование серебряного зеркала:
R-CONH-NH2 + 4[Ag(NH3)2]NO3 → R-COOH + 4NH3↑ + 4NH4NO3 + 4Ag↓ +N2↑
2. С сульфатом меди при нагревании – восстанавливается медь. При этом вначале образуется соль изониазида голубого цвета, затем происходят гидролиз и окислительно-восстановительная реакция между гидразидом и солью двухвалентной меди, что сопровождается изменением окраски раствора от голубой до изумрудно-зелёной и грязно-жёлтой. При этом наблюдается выделение пузырьков азота (по Мелентьевой):

3. С сульфатом меди – голубой осадок, при нагревании переходящий в светло-зелёный, а затем в жёлто-зелёный. Выделяются пузырьки газа:

Cu2O (красно-жёлтый) переходит в кислой среде в Cu° (красный).
Нефармакопейные:
1. С реактивом Несслера – выпадает Hg°.
2. С КMnO4 – обесцвечивание.
3. С щелочным раствором нитропруссида натрия – оранжевое окрашивание, переходящее при добавлении НСl в вишнёвое.
Фтивазид Phthivazidum (Фтивазид)
3-Метокси-4-оксибензилиденгидразид изоникотиновой кислоты, или изоникотиноил-(3-метокси-4-оксибензаль)-гидразон.
Подлинность:1. Фтивазид обладает амфотерными свойствами. Это свойство фтивазида положено в основу реакции, подтверждающей его подлинность. Спиртовой раствор препарата, имеющий светло-желтый, цвет при прибавлении щелочи приобретает оранжево-желтое окрашивание. Если к этому раствору прибавлять по каплям соляную кислоту, окраска становится слабее, чем первоначальная. При дальнейшем прибавлении HCl восстанавливается превоначальное окрашивание (за счёт образования четвертичной соли с атомом азота в пиридиновом цикле):

3. Нагревание с HCl – сильный запах ванилина:

Количественное определение:
1. Неводное титрование в ледяной уксусной кислоте с индикатором кристаллическим фиолетовым:

Nialamidum (Ниаламид)
1-[2’-(Бензилкарбамоил)-этил]-2-изоникотиноилгидразид.
1. Неводное титрование в ледяной уксусной кислоте с индикатором кристаллическим фиолетовым:
Нефармакопейные:
1. Йодометрия после гидролиза в кислой среде:
В результате гидролиза в кислой среде образуются ванилин, изоникотиновая кислота и гидразин (см. реакцию выше).
5N2H4 + 4KIO3 + 4HCl à 5NaI + 2I2 + 4KCl + 12H2O
2I2
+ KIO3
+ 6HCl
![]() 5ICl
+ KCl + 3H2O
5ICl
+ KCl + 3H2O
Хлороформ извлекает йод и растворяет сопутствующие вещества. f=1/6
Атропина сульфат
(тропинового эфира (+), (-) троповой кислоты сульфат, моногидрат)
Атропин представляет собой сложный эфир тропина и троповой кислоты.
Подлинность
1. Обнаружение атропина по УФ- и ИК-спектрам. Атропин в 0,1 н. растворе серной кислоты имеет максимумы поглощения при 252, 258 и 264 нм; в ИК-области спектра основание атропина (диск с бромидом калия) имеет основные пики при 1720, 1035 и 1153 см-1.
2. Реакция Витали - Морена. Эта реакция основана на том, что при нагревании атропина с азотной кислотой он разлагается на тропин и троповую кислоту. При действии азотной кислоты на троповую кислоту образуется тринитропроизводное этой кислоты, имеющее желтую окраску:
![]()
При действии щелочи на тринитропроизводное троповой кислоты появляется фиолетовая окраска:
![]()
3. Реакция с n-диметиламинобензальдегидом и серной кислотой.. При наличии атропина появляется красная окраска, которая переходит в вишнево-красную, а затем в фиолетовую.
4. Реакция с солью Рейнеке. Сухой остаток исследуемого вещества растворяют в капле 0,1 н. раствора соляной кислоты. Рядом с полученным раствором помещают каплю свежеприготовленного 1 %-го раствора соли Рейнеке (NH4[Cr(NH3)2(SCN)4]). При соединении этих растворов образуется сиреневого цвета аморфный осадок, быстро переходящий в кристаллический. Образование сростков кристаллов с ромбовидными концами указывает на наличие атропина в пробе. Предел обнаружения: 0,1 мкг атропина в пробе.
5. Реакция с пикриновой кислотой. Атропин с 0,5 %-м раствором пикриновой кислоты дает светло-желтый кристаллический осадок в виде пластинок или сростков из них. Этот осадок появляется через 15-20 мин. Реакцию с пикриновой кислотой выполняют так, как и с солью Рейнеке. Предел обнаружения: 5 мкг атропина в пробе.
6.Реакция на сульфат-ионы с раствором бария хлорида; образуется белый осадок: SO42- + Ba2+ → BaSO4↓
7. Реакция образования бензальдегида. При нагревании атропина с раствором кислоты серной присутствии нескольких кристалликов калия бихромаита появляется запах миндаля:

aтропин тропин троповая кислота
Количественный
анализ 1.
Ацидиметрия
в неводной среде. Титруют в среде
безводной уксусной кислоты 0,1 моль/л
раствором хлорной кислоты (индикатор
кристаллический фиолетовый):Точку
эквивалентности определяют
потенциометрически:
 2.
Алкалиметрия
в
спирто-хлороформной среде.
2.
Алкалиметрия
в
спирто-хлороформной среде.
3. Фотоколориметрия (по реакции с пикриновой кислотой) в растворе для инъекций.
Скополамин
Количественное определение 1. Ацидиметрия в неводных средах в присутствии ацетата ртути (II). 2. Аргентометрия в уксуснокислой среде, индикатор бромфеноловый синий.
Гоматропина гидробромид
Качественные реакции:
Метод ГЖХ. Качественную оценку осуществляют по относительным объемам удерживания и индексам удерживания Ковача.
Гидролиз, Нитрование, окисление, обнаружение анионов, нейтрализации, обусловленных наличием в молекулах третичного атома азота, сложно-эфирной группы, фенильного радикала, связанных неорганических кислот.
Не дает реакции Витали-Морена, позволяет отличать его от других производных тропана.
1. Реакция на Вг-.
С раствором йода - бурый осадок перйодида.
С раствором КОН- белый осадок, растворимый в избытке реактива.
Основание гоматропина при нагревании со спиртовым раствором ртути дихлорида дает желтое окрашивание.
Количественные реакции: Количественное определение 1. Ацидиметрия в неводной среде. 2. Алкалиметрия в водно-спиртовой среде в присутствии хлороформа.
Морфин
Качественные реакции
Вещество |
Реактивы |
|||
Марки |
Фреде |
Манделина |
Раствор железа (III) хлорида |
|
формальдегид в концентрированной Н2SO4 |
Натрия молибдат в концентрированной Н2SO4 |
натрия ванадат в концентрированной Н2SO4 |
||
Морфин |
красно–фиолетовое розово-фиолетовое |
фиолетовое бледно–розовое |
фиолетовое бледно–розовое |
сине–фиолетовое |
Реакция с йодноватой кислотой (НIO3). При взбалтывании раствора морфина, слабо подкисленного серной кислотой, с раствором йодноватой кислоты или раствором иодата калия (KIO3), не содержащего йодидов, выделяется свободный йод, который при взбалтывании с хлороформом переходит в хлороформный слой, окрашивая его в фиолетовый цвет.
.

![]() KIO3
+ 5 KI
+ 6 HCl
® 3 I2
+ 6 KCl
+ 3 H2O
Реакция
с калия гексациано– (III) ферратом железа
(III) хлоридом
К
водному раствору исследуемого вещества
прибавляют несколько капель смеси
растворов калия гексациано– (III) феррата
и железа (III) хлорида. При наличии морфина
появляется синяя окраска или осадок
(образование берлинской лазури)
KIO3
+ 5 KI
+ 6 HCl
® 3 I2
+ 6 KCl
+ 3 H2O
Реакция
с калия гексациано– (III) ферратом железа
(III) хлоридом
К
водному раствору исследуемого вещества
прибавляют несколько капель смеси
растворов калия гексациано– (III) феррата
и железа (III) хлорида. При наличии морфина
появляется синяя окраска или осадок
(образование берлинской лазури)

![]() 3
K4[Fe(CN)6] + 4 FeCl3 ® Fe4[Fe(CN)6]3 + 12 KCl
С раствором йода в калия йодиде (реактив
Бушарда-Вагнера)
При
наличии морфина образуется кристаллический
осадок – сростки из прямоугольных
пластинок красно–оранжевого цвета.
3
K4[Fe(CN)6] + 4 FeCl3 ® Fe4[Fe(CN)6]3 + 12 KCl
С раствором йода в калия йодиде (реактив
Бушарда-Вагнера)
При
наличии морфина образуется кристаллический
осадок – сростки из прямоугольных
пластинок красно–оранжевого цвета.
КОДЕИН
:Реакции с реактивами группового осаждения алкалоидов
Вещество |
Реактивы |
|||
Марки |
Фреде |
Манделина |
Раствор железа (III) хлорида |
|
формальдегид в концентрированной Н2SO4 |
Натрия молибдат в концентрированной Н2SO4 |
натрия ванадат в концентрированной Н2SO4 |
||
Кодеин |
сине–фиолетовое |
фиолетово–зелёное |
зелёное ® синее |
¾ |
Микрокристаллическая реакция с раствором кадмия йодида. Выделяется белый аморфный осадок, кристаллизующийся через 10 – 20 мин. Под микроскопом видны призматические кристаллы, одиночные и собранные в сростки. ЭТИЛМОРФИН Этилморфин является моноэтиловым эфиром морфина. РЕАКЦИИ ОБНАРУЖЕНИЯ Реакции с реактивами группового осаждения алкалоидов
Вещество |
Реактивы |
|||
Марки |
Фреде |
Манделина |
Раствор железа (III) хлорида |
|
формальдегид в концентрированной Н2SO4 |
Натрия молибдат в концентрированной Н2SO4 |
натрия ванадат в концентрированной Н2SO4 |
||
Этилморфин |
зелёное ® синее ® сине–фиолетовое |
зелёно–синее |
зелёное ® синее |
¾ |
