
- •Будкевич р. Л., Макарова т. П.. Физическая и коллоидная химия
- •Содержание
- •§ 3. Разделы физической химии. Методы исследования
- •§ 1. Энергия. Закон сохранения и превращения энергии
- •§ 4. Эквивалентность теплоты и работы
- •§ 5. Зависимость давления насыщенного пара от температуры
- •Введение
- •§ 2. Краткий очерк истории развития физической химии
- •§ 3. Разделы физической химии. Методы исследования
- •Первый закон термодинамики § 1. Энергия. Закон сохранения и превращения энергии
- •§ 2. Предмет, метод и границы термодинамики
- •§ 3. Теплота и работа
- •§ 4. Эквивалентность теплоты и работы
- •§ 5. Внутренняя энергия
- •§6. Первое начало термодинамики
- •§ 7. Уравнения состояния
- •§ 8. Калорические коэффициенты
- •§ 9. Работа различных процессов
- •§ 10. Теплоемкость. Вычисление теплоты различных процессов
- •§ 11. Энтальпия
- •§ 12. Применение первого закона термодинамики к идеальным газам
- •Глава II. Второй закон термодинамики § 1. Самопроизвольные и несамопроизвольные процессы
- •§ 2. Второй закон термодинамики
- •§ 3. Методы расчета энтропии
- •§ 4. Постулат Планка. Абсолютные значения энтропии
- •Глава III. Энергия гельмгольца. Энергия гиббса. Приложения второго закона термодинамики § 1. Энергия Гельмгольца
- •§ 2. Энергия Гиббса
- •§ 3. Фазовые переходы. Уравнение Клапейрона-Клаузиуса
- •§ 4. Фазовые переходы первого рода. Плавление. Испарение
- •§ 5. Зависимость давления насыщенного пара от температуры
- •Глава IV. Термодинамика растворов (растворы) § 1. Растворы (определение). Концентрация
- •§ 2. О молекулярной структуре растворов
- •§ 3. О теориях растворов
- •Глава V. Равновесие: жидкий раствор – насыщенный пар § 1. Давление насыщенного пара бинарных жидких растворов
- •§ 2. Закон Рауля. Идеальные растворы. Предельно разбавленные растворы
- •§ 3. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля
- •§ 4. Диаграммы равновесия жидкость – пар в бинарных системах. Первый закон Коновалова. Фракционная перегонка
- •§ 5. Температура кипения растворов нелетучих веществ. Эбуллиоскопия. Температура замерзания растворов нелетучих веществ. Криоскопия
- •§ 6. Второй закон Коновалова. Азеотропные растворы
- •Глава VI. Равновесие жидких растворов с газами. Некоторые классы растворов § 1. Растворимость газов в жидкостях
- •§ 2. Влияние давления на растворимость газов. Закон Генри
- •§ 3. Зависимость растворимости газов от температуры
- •§ 4. Влияние третьего компонента на растворимость газов
- •§ 5. Совместная растворимость нескольких газов
- •Коллоидная химия глава VII. Предмет коллоидной химии §1. Определение предмета коллоидной химии
- •§2. Признаки объектов коллоидной химии
- •§3. Значение коллоидной химии
- •Глава VIII. Поверхностные явления и адсорбция §1. Поверхностное натяжение
- •§2. Когезионные и поверхностные силы
- •§3. Зависимость энергетических параметров поверхности от температуры
- •5. Самопроизвольное уменьшение поверхностной энергии и формирование поверхностного слоя
- •Глава IX. Адсорбция и поверхностное натяжение §1. Виды адсорбции, ее количественные характеристики и их связь с параметрами системы
- •§2. Фундаментальное адсорбционное уравнение Гиббса и примеры его применения
- •§3. Поверхностная активность. Поверхностно-активные и инактивные вещества
- •§4. Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
- •§5. Теория полимолекулярной адсорбции бэт
- •§6. Изотермы адсорбции и поверхностного натяжения растворов пав Уравнение Шишковского
- •§7. Классификация и общая характеристика поверхностно-активных веществ. Правило Дюкло – Траубе
- •§8. Хроматография. Основы метода
- •Глава х. Термодинамика и механизм мицеллообразования
- •Глава хi. Адгезия, смачивание и растекание жидкостей §1. Адгезия и работа адгезии
- •§2. Смачивание и краевой угол. Закон Юнга
- •§3. Связь работы адгезии с краевым углом
- •§4. Флотация
- •§5. Моющее действие пав. Роль пав в увеличении нефтеотдачи пластов
- •Глава XII. Капиллярные явления §1. Влияние кривизны поверхности на внутреннее давление. Закон Лапласа
- •§2. Капиллярные явления. Формула Жюрена
- •§3. Роль капиллярных явлений при вытеснении нефти водой из пористых сред
- •Диаграмма температура - состав.
- •Двухкомпонентные системы
- •Системы жидкостей с неограниченной взаимной растворимостью.
§ 3. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля
Закон Рауля не выполняется для реальных растворов. Парциальные давления этих растворов больше или меньше давлений паров идеальных растворов. Отклонения от закона Рауля в первом случае называются положительными (общее давление пара больше аддитивной величины), а во втором случае – отрицательными (общее давление пара меньше аддитивной величины).
Примерами растворов с положительными отклонениями от законов Рауля могут служить растворы:
ацетон – этиловый спирт
бензол – ацетон
вода – метиловый спирт
На рис.6 изображена диаграмма P – х для одного из этих растворов (бензол – ацетон).
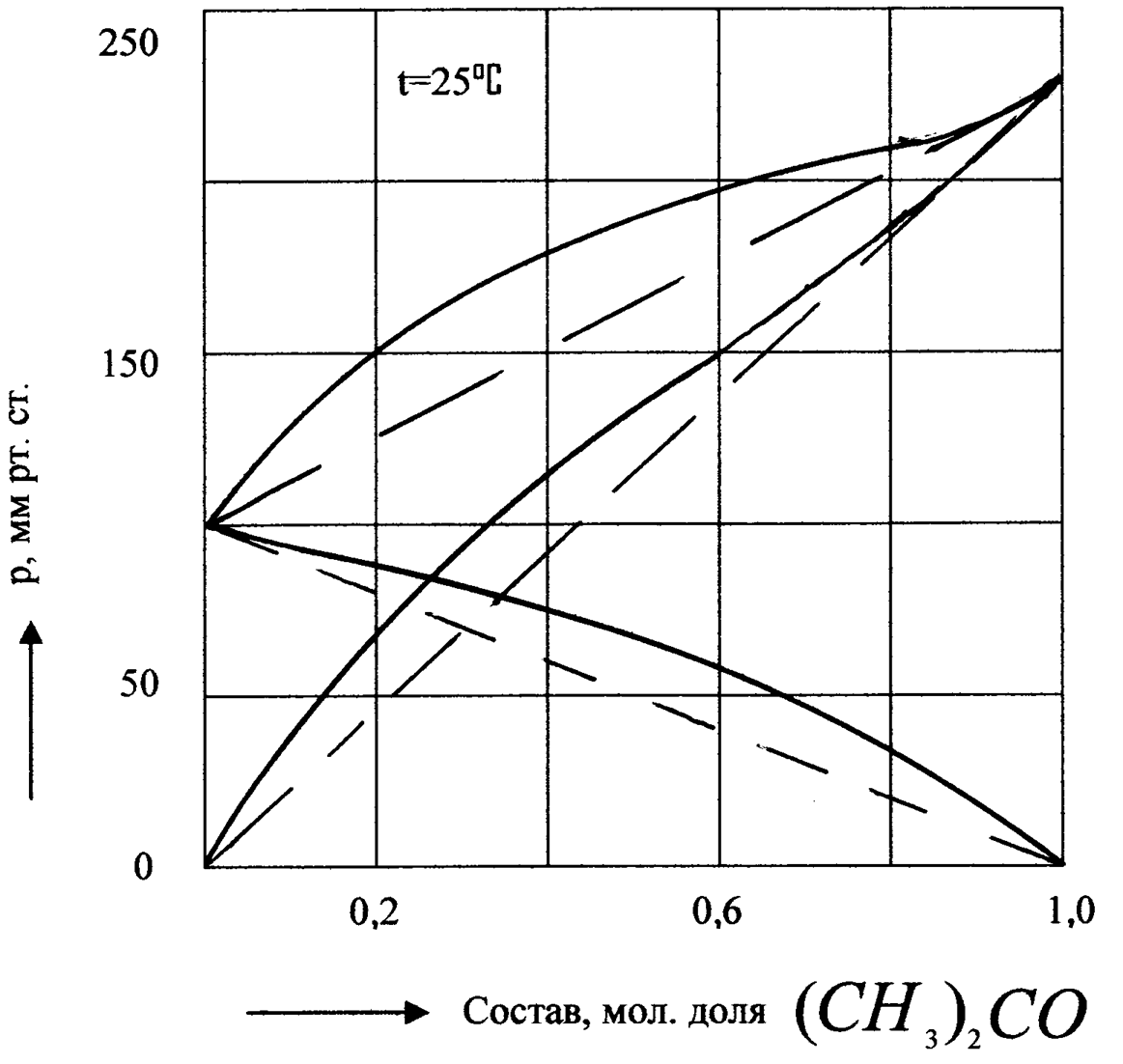
Рис.6. Диаграмма давления пара над раствором С6Н6 – (СН3)2СО.
К растворам с отрицательными отклонениями от законов Рауля относятся, например, растворы:
хлороформ – бензол
хлороформ – диэтиловый эфир
Диаграмма давления пара над раствором хлороформ – диэтиловый эфир показана на рис.7.
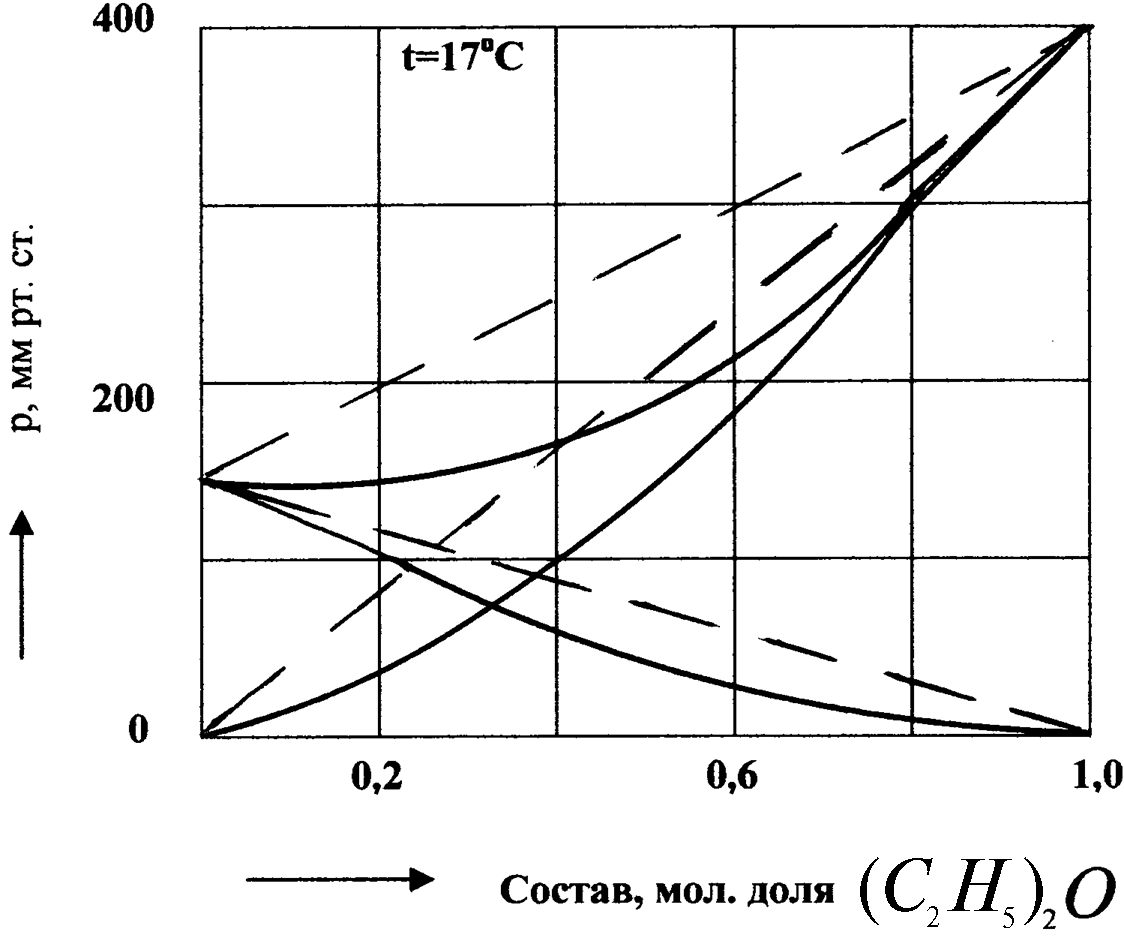
Рис.7. Диаграмма давления пара над раствором (С2Н5)2О – СНСl3.
Величины общего давления P в этих системах изменяются монотонно с изменением величины х. Если отклонения от закона идеальных растворов велики, то кривая общего давления пара проходит через максимум или минимум.
Положительные и отрицательные отклонения реальных растворов от закона Рауля обусловлены разными факторами. Если разнородные молекулы в растворе взаимно притягиваются с меньшей силой, чем однородные, то это облегчит переход молекул из жидкой фазы в газовую фазу (по сравнению с чистыми жидкостями) и будут наблюдаться положительные отклонения от закона Рауля. Усиление взаимного притяжения разнородных молекул в растворе (сольватация, образование водородной связи, образование химического соединения) затрудняет переход молекул в газовую фазу, поэтому будут наблюдаться отрицательные отклонения от закона Рауля.
Следует иметь в виду, что факторы, вызывающие положительные и отрицательные отклонения, могут действовать в растворе одновременно, поэтому наблюдаемые отклонения часто являются результатом наложения противоположных по знаку отклонений. Одновременное действие противоположных факторов особенно наглядно проявляется в растворах, в которых знак отклонений от закона Рауля – Генри изменяется с изменением концентрации.
§ 4. Диаграммы равновесия жидкость – пар в бинарных системах. Первый закон Коновалова. Фракционная перегонка
На рис.5,6,7 общее давление пара бинарного раствора было представлено как функция состава раствора. В качестве аргумента можно также использовать состав пара, определяемый кривыми парциальных давлений и отличающийся от состава жидкого раствора. Таким путем можно получить вторую кривую того же свойства системы – общего давления насыщенного пара раствора в зависимости от другого аргумента – состава пара.
На рис.8 изображена схематическая диаграмма – изотерма равновесия бинарный раствор – пар. Любая точка на плоскости диаграммы характеризует валовый состав системы (координата х) и давление (координата P) и называется фигуративной точкой. Верхняя кривая отображает зависимость давления насыщенного пара от состава жидкости, а нижняя кривая – зависимость давления насыщенного пара от состава пара. Этими кривыми плоскость диаграммы разделяется на три поля. Верхнее поле охватывает значения х и P, при которых существует только одна жидкая фаза – раствор переменного состава. Нижнее поле отвечает газовой смеси переменного состава. Любая фигуративная точка в верхнем и нижнем полях изображает состояние одной реально существующей фазы. Поле, заключенное между двумя кривыми, соответствует двухфазной системе. Система, давление и состав которой отображает фигуративная точка, находящаяся в этом поле, состоит из двух фаз – раствора и насыщенного пара. Состав этих фаз определяется координатами точек, лежащих на пересечении изобары, проходящей через фигуративную точку системы, с верхней и нижней кривыми. Например, система, характеризуемая фигуративной точкой k, состоит из двух равновесных фаз, состав которых определяется точками а и b. Точка а, лежащая на нижней кривой, характеризует состав насыщенного пара, а точка b, лежащая на верхней кривой,– состав раствора. Нижняя кривая называется ветвью пара, верхняя кривая – ветвью жидкости.
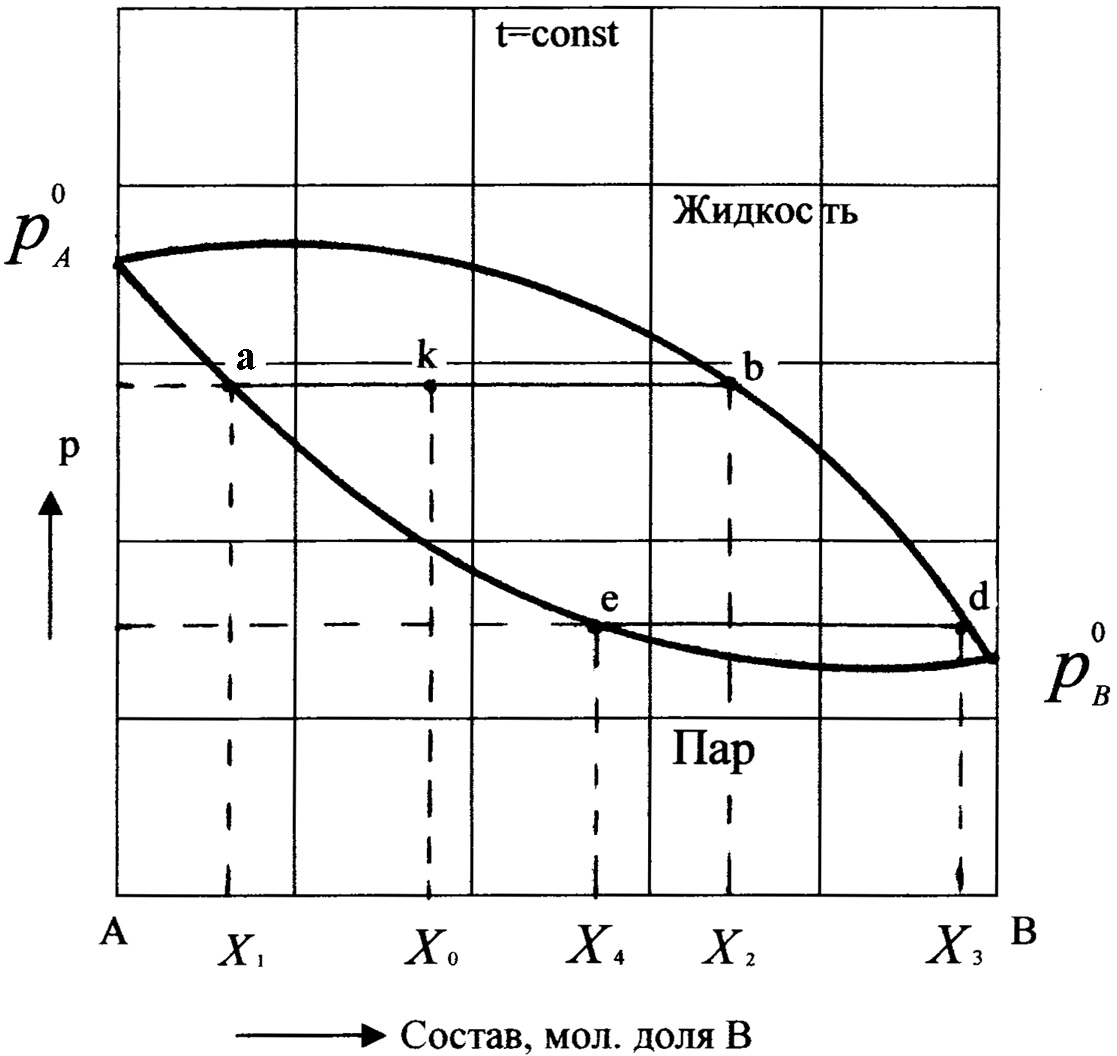
Рис.8. Диаграмма состав – давление бинарной системы.
При изотермическом сжатии ненасыщенного пара состава х1 фигуративная точка системы движется вверх по вертикали, конденсация пара начинается в точке а (рис.8) при известном значении давления P. Первые капли жидкости имеют состав х2; образовавшаяся жидкость содержит меньше компонента А, чем конденсирующийся пар.
При изотермическом уменьшении давления жидкость состава х3 начнет испаряться в точке d, давая пар состава x4 (точка е); образовавшийся пар содержит больше компонента А, чем испаряющаяся жидкость. Следовательно, в паре всегда преобладает по сравнению с равновесной с ним жидкостью компонент А, прибавление которого к системе, как это видно из диаграммы, увеличивает полное давление пара.
На основании сказанного легко можно сделать следующее заключение: насыщенный пар по сравнению с равновесным раствором относительно богаче тем компонентом, добавление которого к системе повышает полное давление пара. Это – первый закон Коновалова (1881), являющийся справедливым для всех устойчивых растворов.
Рассмотрим явления испарения и конденсации растворов также с помощью изобарной диаграммы температура кипения – состав раствора.
Диаграммы tкип. – х можно построить по экспериментальным данным, или имея ряд изотермических диаграмм P – х. На каждой диаграмме P – х, построенной при определенной температуре, находят составы сосуществующих раствора и пара при заданном давлении. По полученным из всех изотерм P – х данным для определенного давления строят одну изобарную диаграмму tкип. – х.
Диаграмма
tкип. –
х
показана
схематически на рис.9. Так как компонент
А с более высоким давлением насыщенного
пара
 (рис.8)
имеет при данном давлении более низкую
температуру кипения (
(рис.8)
имеет при данном давлении более низкую
температуру кипения ( ),
то диаграмма tкип. –
х имеет
зеркально-подобный вид по отношению к
диаграмме P –
х
(имеется
только качественное подобие).
),
то диаграмма tкип. –
х имеет
зеркально-подобный вид по отношению к
диаграмме P –
х
(имеется
только качественное подобие).
Верхнее поле на диаграмме tкип. – х отвечает пару, а нижнее – жидкости. Верхняя кривая – ветвь пара, а нижняя кривая – ветвь жидкости.
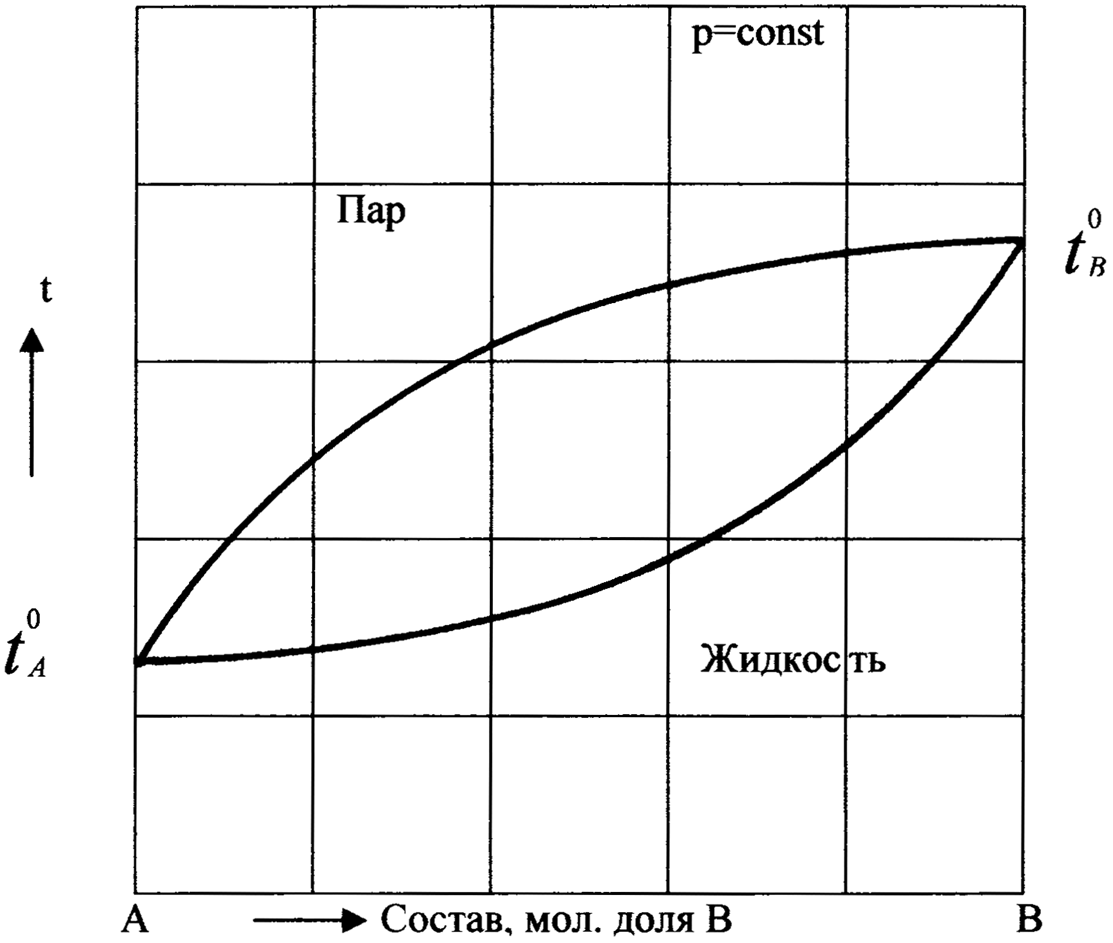
Рис.9. Диаграмма температура кипения – состав бинарной системы.
В ректификационных колоннах последовательные перегонки объединены в один автоматизированный процесс, приводящий к разделению компонентов жидкого раствора (ректификация). Промышленное разделение нефти на фракции (первичная переработка нефти) основано на указанном процессе.
В заключение приведем еще одну формулировку первого закона Коновалова:
В насыщенном паре, находящемся в равновесии с жидким бинарным раствором, выше относительное содержание того компонента, который при T = const имеет более высокое значение давления насыщенных паров по сравнению с другим компонентом или при P = const имеет по сравнению с ним более низкую температуру кипения, иначе говоря, пар по сравнению с жидкостью относительно богаче более летучим компонентом.
