
- •Физиология и патогенез
- •25 Рекомбинация
- •38 Неспецифические факторы защиты организма
- •Медиаторы иммунной системы.
- •Реакция непрямой или пассивной гемагглютинации (рпга)
- •Реакция преципитации (рп)
- •Реакция нейтрализации экзотоксина антитоксином (рн)
- •63.Реакция лизиса (рл)
- •2.Ферменты стрептококков:
- •85. Неспорообразующие анаэробыБактероиды (род Bacteroides)
- •2.Реакция торможения гемагглютинации (ртга)
- •3.Реакция непрямой гемагглютинации (рнга)
- •4.Реакция связывания комплемента (рск)
- •5.Реакция диффузионной преципитации в геле (рдп)
- •6.Реакция торможения гемадсорбции (ртгАд)
- •7.Реакция иммунофлуоресценции (риф)
85. Неспорообразующие анаэробыБактероиды (род Bacteroides)
Грамотрицательные палочки, неподвижны, спор не образуют, образуют капсулу. Типовой вид — Bacteroides fragilis. Бактерии группы Bacteroides fragilis.
Культивируются на анаэробном кровяном агаре; лучше растут на комплексных средах. Образуют белые, прозрачные S-формы колоний.
Протеолитическая активность умеренная, лецитиназу не образуют, не вызывают гемолиза эритроцитов, образует H2S, образование кислоты при ферментации глк., лактозы .сахарозы.
Содержат соматический О-АГ, могут иметь Н- и К-АГ.
Факторы патогенности: образуют капсулу и продуцируют супероксиддисмутазу, эндотоксин, нейраминидаза.
Колонизируют слизистые полости рта, верхних дыхательных путей, гениталий и кишечника.
Пoрфиромонады (poд Porphyromonas)
Короткие грамотрицательные палочки. Неподвижны, спор не образуют. Род представлен тремя видами: P. asaccharolytica (типовой вид), P. gingivalis и P. endodontalis.
На анаэробном кровяном агаре образуют слизистые черные колонии. Для роста нуждаются в гемине и менадионе.
Биохимическая активностьочень низкая. Инертны по отношению к углеводам. Все виды образуют индол. P.gingivalis связывает и разрушает фибриноген, продуцирует коллагеназу, повреждающую дентин, а также агглютинирует эритроциты. Колонизируют слизистые полости рта и верхних дыхательных путей.
Превотеллы (род Prevotella) Полиморфные неподвижные аспорогенные палочки. Типовой вид — Prevotella melaninogenica.
На кровяном агаре образуют светло-коричневые/ черные колонии.
Проявляют умеренную сахаролитическую активность. Основные продукты ферментации углеводов — сукцинаты и ацетаты.
Основной фактор патогенности — эндотоксин, фосфолипаза А, нарушающая целостность мембран эпителиальных клеток.
Колонизируют слизистые полости рта, верхних дыхательных путей, гениталий и кишечника.
ОБЩЕЕ:
Чувствительность к антимикробным препаратам.Резистентны к пенициллинам, цефалоспоринам I и II поколений. Препараты выбора — левомицетин, метронидазол.
Иммунитет: нестойкий, непродолжительный.
Лечение:Химиопрепараты нитроимидазольного ряда: метронидазол, тинидазол, орнидазол, и антибиотик клиндамицин. Препараты резерва — производные нитрониазолов. Дренирование гнойников, удаление мертвых тканей, антибактериальная химиотерапия.
Профилактика:Специфическая – нет. Неспецифическая профилактика - назначение при операциях на органах брюшной полости и малого таза, метронидазола в/в, обработка ран и выявлении гнойно-воспалительных очагов.
Микробиологическая диагностика
Бактериологический. Серологический и бактериоскопический методы – ограниченное применение. Для экспресс-диагностики применяется ГЖХ (газожидкостная хроматография). Бактериологическое исследование: Посев производят на кровяные среды, обогащенные факторами роста (гемин, менадион). Посевы инкубируют в анаэробных условиях. Для выявления в исследуемом материале темнопигментированных бактероидов, превотелл, порфиромонад пробу исследуют в УФ лучах (микроколонии светятся красным светом).
На первом этапе идентификации определяют родовую принадлежность изолированных культур. На втором этапе проводят окончательную идентификацию до вида по биохимическим тестам, антигенным свойствам.
Газовая хроматография. Для экспресс-диагностики анаэробной инфекции применяют метод ГЖХ, основанный на хроматографическом определении в материале от больных специфических продуктов метаболизма облигатных анаэробных бактерий — летучих жирных кислот. Наличие жирных кислот - анаэробная этиология воспалительного процесса. Маркеры: изомасляная и масляная, изовалериановая и валериановая, изокапроновая и капроновая. Аэробные бактерии летучие жирные кислоты не продуцируют.
86. Возбудитель сифилисаTreponemapalladium ; T. entericum Морфология: типичные трепонемы. имеющие 8-12 завитков, двигательный аппарат – 3 периплазматических жгутика у каждого полюса клетки. Окраску по Граму не воспринимают, по Романовскому-Гимзе – слабо розового цвета, выявляется импрегнацией серебром. Культуральные свойства: вирулентный штамм на пит. средах не растѐт, накопление культуры происходит путѐм заражения кролика в яичко. Вирулентные штаммы культивируют на средах с мозговой и почечной тканью. Биохимические свойства: микроаэрофил Антигенная структура: солжная, обладает специфическим белковым и липоидным антигенами, Факторы патогенности: в процессе прикрепления участвуют адгезины, липопротеины учавствуют в развитии иммунопатологических процессов. Резистентность: чувствителен к высыханию, солнечным лучам, на предметах сохраняется до высыхания. При неблагоприятных условиях переходит в L-формы и образует цисты. Патогенез: Вызывают сифилис. Из места входных ворот трепонемы попадают в регионарные лимфатические узлы, где размножаются. Далее Т. проникает в кровяное русло, где прикрепляется к эндотелиоцитам, вызывая эндартерииты, приводящие к васкулитам и тканевому нектрозу. С кровью Т. разносится по всему организму, Иммунитет: защитный иммунитет не вырабатывается. В ответ на антигены возбудителя развивается ГЗТ и аутоиммунные процессы. Микроскопическое исследование.Проводят при первичном сифилисе во время появления твердого шанкра. Материал для исследования: отделяемое шанкра, содержимое регионарных лимфатических узлов, из которых готовят препарат «раздавленная» капля и исследуют в темном поле. При положительном результате видны тонкие извитые нити длиной 6—14 мкм, имеющие 10—12 равномерных мелких завитков правильной, формы. Для бледной трепонемы характерны маятникообразные и поступательно-сгибательные движения. При развитии поражений на слизистой оболочке рта при вторичном сифилисе, а также при локализации твердого шанкра в полости рта приходится дифференцировать бледную трепонему от сапрофитных трепонем, являющихся представителями нормальной микрофлоры. В этом случае решающее диагностическое значение имеет обнаружение типичных трепонем в пунктате регионарных лимфатических узлов. Серодиагностика. Реакцию Вассермана ставят одновременно с 2 антигенами: 1) специфическим, содержащим антиген возбудителя— разрушенные ультразвуком трепонемы; 2) неспецифическим — кардиолипиновым.. При положительной реакции наблюдается задержка гемолиза, при отрицательной—происходит гемолиз эритроцитов; интенсивность реакции оценивается соответственно от ( + + + + ) До ( —). Первый период сифилиса является серонегативным и характеризуется отрицательной реакцией Вассермана.. Во втором и третьем периодах сифилиса частота положительных реакций достигает 75— 90 %. После проведенного курса лечения реакция Вассермана становится отрицательной. Параллельно реакции Вассермана ставится реакция микропреципитации с неспецифическим кардиолипиновым антигеном и исследуемой инактивированной сывороткой крови или плазмой. В лунку на пластине из плексигласа (или на обычное стекло) наносят 3 капли сыворотки и добавляют 1 каплю кардиолипинового антигена. Смесь тщательно перемешивают и учитывают результаты. Положительная реакция е сывороткой крови больного сифилисом характеризуется образованием и выпадением хлопьев разной величины; при отрицательном результате наблюдается равномерная легкая опалесценция.
РИФ — реакция непрямой иммунофлюоресценции — является специфической при диагностике сифилиса. В качестве антигена используют взвесь тканевых трепонем. Используется реакция РИФ_200. Сыворотку больного инактивируют так же, как для реакции Вассермана, и разводят в соотношении 1:200. На предметные стекла наносят капли антигена, высушивают и фиксируют 5 мин в ацетоне. Затем на препарат наносят сыворотку больного, через 30 мин промывают и высушивают. Следующим этапом является обработка препарата флюоресцирующей сывороткой против глобулинов человека. Изучают препарат с помощью люминесцентного микроскопа, отмечая степень свечения трепонем. РИТ—реакция иммобилизации трепонем — также является специфической. Живую культуру трепонем получают при культивировании в яичке кролика. Яичко измельчают в специальной среде, в которой трепонемы сохраняют подвижность. Ставят реакцию следующим образом: взвесь тканевых (подвижных) трепонем соединяют в пробирке с исследуемой сывороткой и добавляют свежий комплемент. В одну контрольную пробирку вместо исследуемой сыворотки добавляют сыворотку здорового человека, в другую — вместо свежего комплемента добавляют инактивированный — неактивный. После выдерживания при 35 °С в анаэробных условиях (анаэростат) из всех пробирок готовят препарат «раздавленная» капля и в темном поле определяют количество подвижных и неподвижных трепонем. Лечение: Пенициллины, тетрациклины, висмутсодержащие препараты.
87. № 130 Возбудитель лептоспирозов. Лептоспиры являются возбудителями зоонозной бактериальной инфекции, характеризующейся волнообразной лихорадкой, интоксикацией, поражением капилляров печени, почек, ЦНС. Возбудитель L. Interrhogans относится к семейству Leptospiraceae, poд Leptospira. Лептоспиры представляют собой тонкие спирохеты, с изогнутыми концами. Двигательный аппарат - фибриллы. Легко различимы при микроскопии в темном поле и фазово-контрасте. Цист не образуют. Аэробы. Источником углерода и энергии служат липиды. Каталаза-и оксидазаположительны. Культивируются на питательных средах, содержащих сыворотку или сывороточный альбумин.Особенность роста на жидкой питательной среде — отсутствие помутнения. Делятся поперечным делением. Растут медленно. Цист не образуют. Содержат общеродовой антиген белковой природы, выявляемый в PCК, а также вариантоспецифический поверхностный антиген липополисахаридной природы, выявляемый в реакции агглютинации. Резистентность.L. interrhogansчувствительна к высыханию, нагреванию, низким значениям рН, дезинфицирующим веществам.Лептоспироз относится к природно-очаговым зоонозам, с преимущественно фекально-оральным механизмом передачи возбудителя. Основным резервуаром и источником инфекции служат домовые и полевые грызуны, дополнительными — домашние животные. У диких животных инфекция имеет хроническое течение без клинических проявлений, при этом возбудитель выделяется с мочой, загрязняя водоемы и почву. больной человек, хотя и выделяет лептоспиры в окружающую среду не имеет практического значения в распространении заболевания. Основные пути передачи: водный, алиментарный, контактный.Некоторые серовары характеризуются гемолитической и липазной активностью, продуцируют плазмокоагулазу, фибринолизин, цитотоксины. Патогенез и клиника заболевания.острая инфекционная болезнь, которая вызывается различными сероварами. Инкубационный период составляет 7—10 дней. Входные ворота — слизистые оболочки пищеварительного тракта, поврежденная кожа. Проникнув в организм, микроб с кровью разносится к органам ретикулоэндотелиальной системы (печень, почки), где размножа-ется и вторично поступает в кровь, что совпадает с началом болезни. Возбудитель поражает капилляры печени, почек, ЦНС, что приводит к развитию геморрагии в этих органах. Болезнь протекает остро, с явлениями волнообразной лихорадки, интоксикации, с желтухой, развитием почечной недостаточности, асептического менингита. Иммунитет:Стойкий, гуморальный, серовароспецифический иммунитет. Микробиологическая диагностика.Материалом для исследования служат кровь, спинномозговая жидкость, моча, сыворотка крови в зависимости от стадии заболевания. Для диагностики используют бактериоскопический (обнаружение лептоспир в темнопольном микроскопе), бактериологический и серологические методы (РА, РСК), а также применяют ПЦР. Биопробу на кроликах. Специфическая профилактика проводится вакцинацией по эпидемическим показаниям убитой нагреванием, корпускулярной вакциной, содержащей 4 основных серогруппы возбудителя. Для лечения используют антибиотики (пенициллин, тетрациклин) в сочетании с лептоспирозным гетерологичным иммуноглобулином. Возбудитель боррелиозов. Спирохеты рода Borreliaвызывают антропонозные (возвратный тиф), зоонозные (болезни Лайма) инфекционные болезни с трансмиссивным механизмом передачи возбудителей (клещи, вши). Морфологические свойства: тонкие спирохеты с крупными завитками. Двигательный аппарат представлен фибриллами. Они хорошо воспринимают анилиновые красители, по Романовскому—Гимзе окрашиваются в сине-фиолетовый цвет. Боррелии обладают генетическим аппаратом, который состоит из небольших размеров линейной хромосомы и набора циркулярных и линейных плазмид. Культуральные свойства: культивируются на сложных питательных средах, содержащих сыворотку, тканевые экстракты, а также в куриных эмбрионах. Чувствительны к высыханию и нагреванию. Болезнь Лайма - возбудитель В. burgdorferi. Хроническая инфекция с поражением кожи, сердечной и нервной систем, суставов. Липид модифицированные белки наружной мембраны обеспечивают способность боррелий прикрепляться и проникать в клетки хозяина. В результате взаимодействия боррелий с макрофагами происходит выделение ИЛ-1, который индуцирует воспалительный процесс. Патогенез: На месте укуса клеща образуется красная папула. Возбудитель распространяется из места укуса через окружающую кожу с последующей диссеминацией с током крови к различным органам, особенно сердцу, ЦНС, суставам. Клиника подразделяется на 3 стадии: 1.Мигрирующая эритема, которая сопровождается развитием гриппоподобного симптомокомплекса. 2.Развитие доброкачественных поражений сердца и ЦНС 3.Развитие артритов крупных суставов Иммунитет.Гуморальный, видоспецифический к антигенам клеточной стенки. Микробиологическая диагностика.Используются бактериоскопический, серологический методы и ПЦР в зависимости от стадии заболевания. Материалом для исследования служат биоптаты кожи, синовиальная жидкость суставов, ликвор, сыворотка крови. На 1-й стадии заболевания проводится бактериологическое исследование биоптатов кожи из эритемы. Начиная со 2-й стадии заболевания осуществляется серологическое исследование определением IgM или нарастания титра IgG ИФА или РИФ. ПЦР используется для определения наличия боррелий в ликворе, суставной жидкости. Лечение: антибиотики тетрациклинового ряда. Профилактика.Неспецифическая. Возвратные тифы — группа острых инфекционных заболеваний, вызываемых боррелиями, характеризующихся острым нача-лом, приступообразной лихорадкой, общей интоксикацией. Различают эпидемический и эндемический возвратные тифы. Возбудителем эпидемического возвратного тифа является В. recurrentis. Эпидемический возвратный тиф - антропоноз. Специфические переносчики - платяная, головная вши. Человек заражается возвратным тифом при втирании гемолимфы раздавленных вшей в кожу при расчесывания места укуса. Эндемический возвратный тиф— зооноз. Возбудители - В. duttoniи В. persica. Резервуар - грызуны, клещи. Человек заражается через укусы клещей. Патогенез:Попав во внутреннюю среду организма, боррелии внедряются в клетки лимфоидно-макрофагальной системы, где размножаются и поступают в кровь, вызывая лихорадку, головную боль, озноб. Взаимодействуя с АТ, боррелии образуют агрегаты, которые нагружаются тромбоцитами, вызывая закупорку капилляров, следствием чего является нарушение кровообращения в органах. Иммунитет: к эпидемическому возвратному тифу гуморальный, непродолжительный. Микробиологическая диагностика.Бактериоскопический метод — обнаружение возбудителя в крови, окрашенной по Романовскому—Гимзе. Биопробу ставят для дифференциации В. recurrentisот возбудителей эндемического возвратного тифа.В качестве вспомогательного используют серологический метод с постановкой РСК. Лечение: антибиотики тетрациклинового ряда, левомицетин, ампициллин. Профилактика. Неспецифическая.. 88.Дифтерия — острая инфекционная болезнь, характеризующаяся фибринозным воспалением в зеве, гортани, реже в других органах и явлениями интоксикации. Возбудителем ее является Corynebacterium diphtheriae. Таксономия.Corynebacterium относится к отделу Firmicutes, роду Corynebacterium. характеризуется полиморфизмом: тонкие, слегка изогнутые палочки встречаются кокковидные и ветвящиеся формы. Бактерии нередко располагаются под углом друг к другу. Они не образуют спор, не имеют жгутиков, у многих штаммов выявляют микрокапсулу. Характерная особенность - наличие на концах палочки зерен волютина (обусловливает булавовидную форму). по Граму окрашивается положительно. Культуральные свойства. Факультативный анаэроб, Микроб растет на специальных питательных средах, например на (кровяно-теллуритовый агар), на которой дифтерийная палочка даѐт колонии 3 типов: а) крупные, серые, с неровными краями, радиальной исчерченностью, напоминающие маргаритки; б) мелкие, черные, выпуклые, с ровными краями; в) похожие на первые и вторые. В зависимости от культуральных и ферментативных свойств различают 3 биологических варианта C.diphtheriae: gravis, mitis и промежуточный intermedius. Ферментативная активность. Высокая. Ферментируют глк и мальтозу в образованием кислоты, не разлагают сахарозу, лактозу и маннит. Не продуцируют уреазу и не образуют индол. Продуцирует фермент цистиназу, рпсщепляющую цистеин до H2S. Образует каталазу, сукцинатдегидрогеназу. Антигенные свойства. О-антигены – термостабильные полисахаридные, расположены в глубине клеточной стенки. К-антигены – поверхностные, термолабильные, сероватоспецифические. С помошью сывороток к К-антигену С.diph. разделяют на серовары. Экзотоксин, нарушающий синтез белка и поражающий в связи с этим клетки миокарда, надпочечников, почек, нервных ганглиев. Способность вырабатывать экзотоксин обусловлена наличием в клетке профага, несущего tох-ген,
Ферменты агрессии — гиалуронидазу, нейраминидазу. К факторам патогенности относится также микрокапсула.. Устойчив к высушиванию, действию низких температур, поэтому в течение нескольких дней может сохраняться на предметах, в воде. Эпидемиология. Источник дифтерии — больные люди Заражение происходит чаще через дыхательные пути. Основной путь передачи воздушно-капельный, возможен и контактный путь — через белье, посуду. Патогенез. Входные ворота инфекции — слизистые оболочки зева, носа, дыхательных путей, глаз, половых органов, раневая поверхность. На месте входных ворот наблюдается фибринозное воспаление, образуется характерная пленка, которая с трудом отделяется от подлежащих тканей. Бактерии выделяют экзотоксин, попадающий в кровь, — развивается токсинемия. Токсин поражает миокард, почки, надпочечники, нервную систему. Клиника. Существуют различные по локализации формы дифтерии: дифтерия зева, которая наблюдается в 85—90 % случаев, дифтерия носа, гортани, глаз, наружных половых органов, кожи, ран. Инкубационный период составляет от 2 до 10 дней. Заболевание начинается с повышения температуры тела, боли при глотании, появления пленки на миндалинах, увеличения лимфатических узлов. Отека гортани, развивается дифтерийный круп, который может привести к асфиксии и смерти. Другими тяжелыми осложнениями, которые также могут явиться причиной смерти, являются токсический миокардит, паралич дыхательных мышц. Иммунитет. После заболевания - стойкий, напряженный антитоксичный иммунитет. Особое значение – образование АТ к фрагменту В. Они нейтрализуют дифтерийный гистотоксин, предупреждая прикрепление последнего к клетке. Антибактериальный иммунитет – ненажняженный, сероватоспецифичен Микробиологическая диагностика. С помощью тампона у больного берут пленку и слизь из зева и носа. Для постановки предварительного диагноза возможно применение бактериоскопического метода. Основной метод диагностики — бактериологический: посев на (кровяно-теллуритовый агар), на плотную сывороточную среду для выявления продукции цистиназы, на среды Гисса, на среду для определения токсигенности возбудителя. Внутривидовая идентификация заключается в определении био- и серовара. Для ускоренного обнаружения дифтерийного токсина применяют: РНГА(реакция непрямой геммаглютинации) с антительным эритроцитарным диагностикумом , реакцию нейтрализации антител (о наличии токсина судят по эффекту предотвращения гемаггютинации); РИА (радиоиммунный) и ИФА(имунноферментный анализ). Лечение. Основной метод терапии — немедленное введение специфической антитоксической противодифтерийной лошадиной жидкой сыворотки. Иммуноглобулин человека противодифтерийный для в/в введения. Ассоциированные вакцины: АКДС (абсорбированная коклюшно – столбнячная вакцина), АДС(абсорбированный дифтерийно - столбнячный анатоксин). 89. Холера Возбудитель – Vibriocholerae, серогрупп О1 и О139, характеризуется токсическим поражением тонкого кишечника, нарушением водно-солевого баланса. Морфологические и культуральные свойства.Вибрион имеет один полярно расположенный жгутик. Под действием пени-циллина образуются L-формы. Грамотрицательны, спор не образуют. Факультативный анаэроб. Не требователен к питательным средам. Температурный оптимум 37C. На плотных средах вибрионы образуют мелкие круглые прозрачные S-колонии с ровными краями. На скошенном агаре образуется желтоватый налет. В непрозрачных R-колониях бактерии становятся устойчивыми к действию бактериофагов, антибиотиков и не агглютинируются О-сыворотками. Биохимические свойства.Активны: сбраживают до кислоты глюкозу, мальтозу, сахарозу, маннит, лактозу, крахмал. Все вибрионы делятся на шесть групп по отношению к трем сахарам (манноза, сахароза, арабиноза). Первую группу, к которой относятся истинные возбудители холеры, составляют вибрионы, разлагающие маннозу и сахарозу и не разлагающие арабинозу: разлагают белки до аммиака и индола. H2S не образуют. Антигенная структура. Термостабильный О-антиген и термолабильный Н-антиген. Н-АГ являются общими для большой груп-пы вибрионов. Возбудители классической холеры и холеры Эль-Тор объединяются в серогруппу 01. Антигены серогруппы 01 включают в раз-личных сочетаниях А-, В- и С-субъединицы. Сочетание субъединиц АВ называется сероваром Огава, сочетание АС — сероваром Инаба, сочетание ABC — Гикошима. R-формы колоний утрачивают О-АГ. Резистентность.Вибрионы плохо переносят высушивание. Долго сохраняются в водоемах, пищевых продуктах.. Биовар Эль-Тор более устойчив в окружающей среде, чем классический вибрион. 62
Эпидемиология.Острая кишечная инфекция с фекально-оральным механизмом передачи. Путь передачи - водный, пищевой. Источник инфекции — больной человек или вибрионоситель. Факторы патогенности.Пили адгезии; фермент муциназа, разжижающий слизь и обеспечивающий доступ к эпителию. Эпителиальные клетки выделяют щелочной секрет, который в сочетании с желчью является прекрасной питательной средой для размножения вибрионов. Токсинообразование вибрионов, которые вырабатывают эндо- и экзотоксины. Экзотоксин (энтеротоксин) холероген— термолабильный белок, чувствителен к протеолитическим ферментам. Холероген содержит 2 субъединицы: А и В. А активизирует внутриклеточную аденилатциклазу, происходит повышение выхода жидкости в просвет кишечника. Диарея, рвота. Фермент нейраминидазаусиливает связывание холерного экзотоксина с эпителием слизистой кишечника. Эндотоксин запускает каскад арахидоновой кислоты, которая запускает синтез простагландинов (Е, F). Они вызывают сокращение гладкой мускулатуры тонкого кишечника и подавляют иммунный ответ, чем обусловлены диарея. Клинические проявления.Инкубационный период 2—3 дня. Боль в животе, рвота, диарея. Иммунитет.Гуморально-клеточный. При выздоровлении возникает напряженный непродолжительный иммунитет. Микробиологическая диагностика.Выделение и идентификация возбудителя. Материал для исследования - выделения от больных (кал, рвота), вода. Для экспресс-диагностики используют РИФ, ПЦР. Бактериоскопический метод в настоящее время не используется. Лечение: а)регидратация (восполнение потерь жидкости и электролитов введением изотонических, растворов, а также плазмозаменяющих жидкостей внутривенно;б) антибактериальная терапия (тетрациклины, фторхинолоны). Профилактика.Санит.-гиг. мероприятия. Экстренная профилактика антибиотиками широкого спектра действия, а также вакцинопрофилактика. Прививка обеспечивает выработку вибриоцидных антител и антитоксинов в высоких титрах.
90. Кампилобактерии, хеликобактерииРод Campylobacter (Campyla - изогнутые) относится к группе аэробных или микроаэрофильных подвижных спирально изогнутых грамотрицательных бактерий. Наибольшее значение в патологии человека имеет С. jejunii. Реже встречаются С. fetus и С. coli. Ранее отнесенный к данному роду С. pylori выделен в род Helicobacter.Морфология и физиология.Тонкие вибриоидные клетки, имеющие один или более витков спирали. Споры не образуют. Подвижные, совершают характерное винтовое движение с помощью одиночных жгутиков, расположенных на одном или обоих частях клетки. Хемоорганотрофы не требовательны к питательному субстрату, не сбраживают углеводы. Для получения энергии используют аминокислоты, Оксидазоположительные и уреазоотрицательные. Пигментов не образуют.
Антигены.Кампилобактеры содержат О-, К- и Н-антигены. В настоящее время выделено свыше 50 О-серогрупп Патогеность и патогенез.К факторам вирулентности относят жгутики и муциназу, способствующие проникновению в слизистую оболочку тонкой кишки. Обладают умеренной пенетрационной активностью. Их токсичность связана с секрецией энтеротоксинов (функциональные блокаторы), нарушающими водно-солевой обмен через образование цАМФ, аналогично энтеротоксинам Е. coli и V. cholerae. При разрушении кампилобактеров освобождается эндотоксин. Описаны цитотоксины, вызывающие гибель чувствительных клеток. После колонизации участка тонкой кишки они могут проникнуть в кровяное русло, вызывая генерализованную инфекцию, чаще у иммунодефицитных лиц. В патогенезе кампилобактериозных энтеритов преобладают явления диареи или дизентериеподобных состояний. При этом С. jejunii и С. fetus вызывают энтериты у людей. С. jejunii встречается также при абортах овец. С.fetus чаще встречается у пожилых людей с иммунодефицитами, а также при некишечных формах кампилобактериоза, вызывая поражение паренхиматозных органов и даже сепсис.Иммунитет. гуморальный иммунный ответ.Источником инфекции являются больные животные и люди, от которых кампилобактеры попадают в пищевые продукты (мясо, молоко) и воду. Передача инфекции происходит алиментарным путем. Возможен и контактно-бытовой путь. В окружающей среде при 4°-10°С сохраняются около недели. Зарегистрированы пищевые, молочные и водные вспышки кампи-лобактериоза, чаще у детей.Род Helicobacter.Морфология и физиология.H.pylori представляют собой мелкие грамотрицательные палочки, лофотрихи, микроаэрофилы. Растут на сложных питательных средах. Продуцируют каталазу и оксидазу, которые используют для идентификации этих бактерий.Патогенность и патогенез.К факторам вирулентности хеликобактеров относят их способность к движению и участие в проникновении в слизистую оболочку. Фермент уреаза при разрушении мочевины до аммиака и СO2 приводит к образованию газовой оболочки, защищающей от кишечного сока. Хеликобактеры продуцируют фосфолипазы, разрушающие фосфолипиды. Их токсичность связана с цитотоксином, действующим на эпителиальные клетки, токсином, нарушающим межклеточные контакты, и с ЛПС. Кроме того, на поверхности клеток образуются белки теплового шока, которые рассматривают как реакцию на стресс. Это приводит к аутоиммунному воспалению и образованию язв в желудке и двенадцатиперстной кишке. Н. pylori выделяются в 80% случаев язвенных гастритов.Экология и эпидемиология.Является представителем нормальной микрофлоры животных. Пути передачи человеку окончательно не выяснены. люди заражаются алиментарным путем.Инфекционные заболевания, которые вызывают бактерии рода Campylobacter, получили общее название кампилобактериозы. Они имеют острое течение, сопровождающиеся лихорадкой, поражением желудка и кишечника и с каждым годом встречаются все чаще. Среди 13 видов кампилобактерий главнейшими являются: Campylobacter jejuni, C.coli. заболеванием дали общее название геликобактериоза.Кроме энтеритов и энтероколитов, этих частых кампилобактериоз, значительно реже встречаются септицемии, эндокардиты, перикардиты, менингиты, поражения мочеполовой системы. У беременных женщин возможны аборты, преждевременные роды, инфицирование новорожденных во время родов..Материалом для исследования служит кровь, ликвор, стул или содержимое прямой кишки. Бактериоскопический метод используется для быстрой идентификации кампило-и геликобактерий. Тонкие мазки из фекалий и других клинических материалов фиксируют на огне, окрашивают фуксином Пфейфера течение 10-20 с и промывают водой. Поскольку для окраски других бактерий требуется 3-5 мин, то в течение 10-20 сек успевают зафарбуватись только кампилобактерии. Особенно четко их типовые формы обнаруживают при окраске кристаллическим фиолетовым. Под обычным световым микроскопом они выглядят как тонкие, спирально изогнутые бактерии, имеющие один полный завиток, С-и S-образную форму или напоминают крылья чайки. Helicobacter pylori имеет несколько большие размеры. Можно также использовать фазово-контрастную микроскопию суспензии стула в бульоне для культивирования бруцелл характерную их подвижность..Для выявления антител можно использовать практически все серологические тесты. Но предпочтение отдают реакции непрямой имунофлуоресценциита метода иммуноферментного анализа. Можно применяемые в реакции обычной агглютинации, латекс-агглютинации и непрямой гемагглютинации.
91. туляремия. Таксономия: отдел Gracilicutes, род Francisella. Возбудитель – Francisellatularensis. Морфология: мелкие кокковидные полиморфные палочки, неподвижные, грамотрицательные, не образующие спор, могут образовывать капсулу. Культуральные свойства: Факультативный аэроб,. На простые питательных средах не растет. Культивируется на желточных средах, на средах с добавлением крови и цистеина. Рост медленный. Образуют мелкие колонии, круглые с ровным краем, выпуклые, блестящие. Биохимические свойства: слабо ферментируют до кислоты без газа глюкозу, мальтозу, левулезу, маннозу, образуют сероводород. Туляремийный микроб по вирулентности разделен на подвиды: голарктическую (не ферментирует глицерин, цитруллин), неарктическую (ферментирует глицерин, не ферментирует цитруллин; среднеазиатскую (ферментирует глицерин и цитруллин, мало вирулентен). Антигенные свойства: Содержит соматический О-и поверхностный Vi- антигены. Имеют антигенную близость с бруцеллами. В R- форме теряют Vi- антиген, а вместе с ним вирулентность и иммуногенность. Факторы патогенности: неарктический подвид – высокая патогенность для человека при кожном заражении, голарктический и среднеазиатский подвиды – умеренно патогенны. Вирулентными являются S-формы колоний. Патогенные свойства связаны с оболоченным антигенным комплексом и токсическими веществами типа эндотоксина. Вирулентность обусловлена:капсулой, угнетающей фагоцитоз; нейраминидазой, способствующей адгезии; эндотоксином (интоксикация); аллергенными свойствами клеточной стенки; Эпидемиология: природно-очаговое заболевание. Источник инфекции – грызуны. Множественность механизмов передачи. Передача возбудителя через клещей, комаров. Человек заражается контактным, алиментарным, трансмиссивными путями. Резистентность: в окружающей среде сохраняется долго, нестоек к высокой температуре, чувствителен к антибиотикам (тетрациклин, левомицетин). Патогенез:На месте внедрения возбудителя (кожа, слизистые оболочки глаз, дыхательных путей, желудочно-кишечного тракта) развивается первичный воспалительный очаг, откуда возбудитель распространяется по лимфатическим сосудам и узлам, поражая их с образованием первичных бубонов; в различных органах формируются гранулемы. Микроб и его токсины проникают в кровь, что приводит к бактериемии и генерализации процесса, метастазированию и развитию вторичных туляремийных бубонов. Клиника. Инкубационный период 3—7 дней. Болезнь начинается остро, внезапно с повышения температуры тела. Различают бубонную, язвенно-бубонную, глазо-бубонную, абдоминальную, легочную и генерализованную(септическую) клинические формы туляремии. Иммунитет. После перенесенной инфекции иммунитет сохраняется длительно, иногда пожизненно; развивается аллергизация организма к антигенам возбудителя. Микробиологическая диагностика: Бактериоскопическое исследование:Из исследуемого материала готовят мазки, окрашивают по Грамму. В чистой культуре - мелкие кокки. В мазках из органов преобладают палочковидные формы. Спор не образуют, грамотрицательные, иногда выражена биполярная окраска. Бактериологическое исследование и биопроба. Выделение бактерий туляремии проводят на свернутой яично-желточной среде, глюкозоцистиновом кровяном агаре. Вирулентные штаммы образуют S-формы колоний—мелкие, гладкие, беловатого цвета с голубоватым оттенком. Идентификацию чистой культуры проводят по морфологии бактериальных клеток, характеру роста, биохимическим и анти-генным свойствам. Биохимические свойства этих бактерий выявляются на специальной плотной среде с ограниченным содер-жанием белка. Бактерии туляремии содержат оболочечный антиген, с которым связаны их вирулентные и иммуногенные свойства, и О-соматический антиген. По антигенным свойствам близки к бруцеллам. Серодиагностика.Ставится реакция агглютинации с туляремийным диагностикумом. Относительно позднее появление агглю-тининов в крови (на 2-й неделе болезни) затрудняет применение этой реакции для ранней диагностики, однако их длительное сохранение делает возможной ретроспективную диагностику. Обязательно прослеживается нарастание титра агглютинации. Наиболее чувствительным методом серодиагностики туляремии является РПГА. Для экспресс-диагностики применяется кровяно-капельная реакция: кровь из пальца наносят на стекло, добавляют каплю дистиллированной воды (для лизиса эритроцитов), вносят каплю диагностикума и смешивают стеклянной палочкой.. Кожно-аллергическая проба. Выпускаются два вида тулярина: для внутрикожной пробы и для надкожной. Проба высоко-чувствительна и дает положительные результаты у больных, начиная с 3—5-го дня болезни, но также и у переболевших и вак-цинированных, поэтому оценка реакции должна проводиться с осторожностью. Лечение: антибиотики стрептомицинового и тетрациклинового ряда. В случае затяжного течения – комбинированная антибиотикотерапия с использованием убитой лечебной сыворотки. Профилактика: специфическая профилактика - применяют живую туляремийную вакцину. Иммунитет длительный, проверяется с помощью пробы с тулярином. Туляремийный диагностикум – взвесь убитых бактерий туляремии, применяется в случае постановки реакции агглютинации при серодиагностике. Тулярин – взвесь туляремийных бактерий (вакцинного штамма), убитых нагреванием, для постановки кожно-аллергической пробы. Туляремийная живая сухая накожная вакцина – высушенная живая культура вакцинного штамма, для профилактики.
92.Бруцеллы. Таксономия: Возбудители бруцеллеза B.melitensis, B.abortus, B.suis, B.canis, B.ovis относятся к отделу Gracilicutes, роду Brucella. Морфологические и тинкториальные свойства: Мелкие, грамотрицательные палочки овоидной формы. Не имеют спор, жгутиков, иногда образуют микрокапсулу. Культуральные свойства: облигатные аэробы. B.abortus для своего роста нуждается в присутствии 5—10 % углекислого газа. Требовательны к питательным средам и растут на специальных средах (печеночных, кровяной агар). Их особенностью является медленный (в течение 2 нед) рост. В жидких средах – равномерное помутнение с небольшим осадком. На плотных – мелкие, круглые гладкие голубые колонии. Диссоциация от S- к R-формам колоний. Биохимическая активность: очень низкая; содержат каталазу и оксидазу, нитраты редуцируют в нитриты, цитраты не утилизируют, продуцируют Н2S.
Антигенная структура. O-антиген – соматический, и капсульный антигены. Две разновидности О-антигена — А(абортус) и М(мелитензис).Иногда обнаруживают К-антиген. Факторы патогенности: Образуют эндотоксин, обладающий высокой инвазивной активностью. Продуцируют один из ферментов агрессии — гиалу-ронидазу. Их адгезивные свойства связаны с белками наружной мембраны. Резистентность. Быстро погибают при кипячении, при действии дезинфицирующих веществ, устойчивы к низкой температуре: в замороженном мясе они сохраняются до 5 мес, в молочных продуктах — до 1,5 мес. Эпидемиология. Зоонозная инфекция. Источник - крупный и мелкий рогатый скот, свиньи, овцы, выделяющие B.melitensis.. Больные люди не являются источником заболевания. Патогенез. Проникают в организм через слизистые оболочки или поврежденную кожу, попадают сначала в регионарные лимфатические узлы, затем в кровь, разносятся по всему организму и внедряются в органы ретикулоэндотелиальной системы (печень, селезенку, костный мозг). Там они могут длительное время сохраняться и вновь попадать в кровь. При гибели освобождается эндотоксин, вызывающий интоксикацию. Клиника: Инкубационный период составляет обычно 1—3 нед. Длительная лихорадка, озноб, потливость, боли в суставах, радикулиты. Иммунитет: После перенесенного заболевания формируется непрочный иммунитет. Клеточно-гуморальный, нестерильный, относительный. Микробиологическая диагностика: Микробиологическая диагностика обычно проводится путем серологических исследований (реакция Райта и Хеддлсона). Бактериологическое исследование. Для получения гемокультуры кровь засевают в два флакона печеночного бульона. Один из них (для выделения культуры В. melitensis) инкубируют в обычных аэробных условиях, другой (для выделения первичной культуры В. abortus) —с СО2. В первых генерациях бруцеллы растут очень медленно. На агаре бруцеллы образуют бесцветные колонии, в бульоне — помутнение и слизистый осадок. В мазках, окрашенных по Граму, обнаруживаются мелкие грамотрицательные формы. Они неподвижны, спор не образуют, в определенных условиях появляется видимая капсула. не ферментируют углеводы. Их дифференци-руют по образованию H2S, чувствительности к СО2, действию анилиновых красителей (основной фуксин). Серодиагностика. Реакция агглютинации Райта с бруцеллезным диагностикумом. Положительные результаты отмечаются спустя 1 нед. после начала заболевания и сохраняются у переболевших многие годы. Для ускоренной серодиагностики применяется реакция агглютинации Хеддлсона, которая ставится с неразведенной сывороткой больного и концентрированным антигеном — диагностикумом, окрашенным метиленовым синим. При положительной реакции появляются хлопья синего цвета. Реакция положительна при наличии агглютинации на «++». Для серодиагностики используют РПГА, РИФ, РСК, метод определения неполных антител. В поздние периоды заболевания процент положительных серологических реакций (агглютинации, РПГА и РСК) начинает снижаться и большее диагностическое значение приобретают кожно-аллергическая проба и реакция Кумбса. Биопроба. Применяется для выделения чистой культуры из материала, загрязненного посторонней микрофлорой. На предплечье внутрикожно вводят 0,1 мл бруцеллина. При наличии аллергии уже через 6 ч. могут появиться гиперемия кожи и болезненная отечность. Учет реакции производят через 24 ч. Реакция обладает высокой чувствительностью. Лечение: Антибиотики широкого спектра действия. Специфическая иммунотерапия убитой лечебной бруцеллезной вакциной или бруцеллина (фильтрат бульонных культур В. melitensis, B.abortus, В.suis, убитых нагреванием . При острых формах – бруцеллезный иммуноглобулин. Профилактика:Живая бруцеллезная вакцина получена штамма ВА-19А, полученную из В. abortus, создает перекрестный иммунитет против других видов бруцелл. Бруцеллезный единый диагностикум. Взвесь убитых бруцелл, окрашенных метиленовым синим, применяется при серо-логической диагностике бруцеллеза постановкой реакции агглютинации Райта и Хеддлсона. Накожная сухая живая. 93.Сибирская язваСибирская язва - острая антропонозная инфекционная болезнь, вызываемая Bacillusanthracis, характеризуется тяжелой интоксикацией, поражением кожи, лимфатических узлов. Таксономия. Возбудитель относится к отделу Firmicutes, роду Bacillus. Морфологические свойства. Очень крупные грамположительные палочки с обрубленными концами, в мазке из чистой культуры располагаются короткими цепочками (стрептобациллы). Неподвижны; образуют расположенные центрально споры, а также капсулу. Культуральные свойства. Аэробы. Хорошо растут на простых питательных средах в диапазоне температур 10—40С.На жидких средах дают придонный рост; на плотных средах образуют крупные, с неровными краями, шероховатые матовые колонии (R-форма). На средах, содержащих пенициллин, через 3ч роста си-биреязвенные бациллы образуют сферопласты, расположенные цепочкой и напоминающие в мазке жемчужное ожерелье. ферментируют до кислоты глюкозу, сахарозу, мальтозу, крахмал, инулин; обладают протеолитической и липолитической активностью. Выделяют желатиназу, обладают слабой гемолитической, лецитиназной и фосфатазной активностью. Выделяют желатиназу, проявляют низкую гемолитическую, лецитиназную и фосфатазную активность. Образуют белковый экзотоксин, обладающий антигенными свойствами и состоящий из нескольких компонентов (летальный, протективный и вызывающий отеки). Вирулентные штаммы в восприимчивом организме синтезируют сложный экзотоксин и большое количество капсульного вещества с выраженной антифагоцитарной активностью. Резистентность. Вегетативная форма неустойчива к факторам окружающей среды, споры чрезвычайно устойчивы и сохраняются в окружающей среде, выдерживают кипячение. Чувствительны к пенициллину и другим антибиотикам; споры устойчивы к антисептикам. Эпидемиология и патогенез. Источник инфекции — больные животные, чаще крупный рогатый скот, овцы, свиньи. Человек заражается в основном контактным путем, реже алиментарно, при уходе за больными животными, переработке животного сырья, употреблении мяса. Входными воротами инфекции в большинстве случаев являются поврежденная кожа, значительно реже слизистые оболочки дыхательных путей и желудочно-кишечного тракта. В основе патогенеза лежит действие экзотоксина, который вызывает коагуляцию белков, отек тканей, приводят к развитию токсико-инфекционного шока. Клиника. Различают кожную, легочную и кишечную формы сибирской язвы. При кожной (локализованной) форме на месте внедрения возбудителя появляется характерный сибиреязвенный карбункул, сопровождается отеком. Легочная и кишечная формы относятся к генерализованным формам и выражаются геморрагическим и некротическим поражением соответствующих органов. Иммунитет. После перенесенной болезни развивается стойкий клеточно-гуморальный иммунитет. Микробиологическая диагностика: Наиболее достоверным методом культуры возбудителя. Диагностическую ценность представляют также реакция термопреципитации по Асколи и кожно-аллергическая проба. Бактериоскопическое исследование. Изучение окрашенных по Граму мазков из патологического материала позволяет обнаружить возбудителя, представляющего собой грамположительную крупную неподвижную стрептобациллу. В организме больных и на белковой питательной среде микроорганизмы образуют капсулу, в почве— споры. Бактериологическое исследование. Исследуемый материал засевают на чашки с питательным и кровяным агаром, а также в пробирку с питательным бульоном. Посевы инкубируют при 37С в течение 18ч. В бульоне В. anthracis растет в виде хлопьевидного осадка; на агаре вирулентные штаммы образуют колонии R-формы. Авирулентные или слабовирулентные бактерии образуют S-формы колоний. В. anthracis обладает сахаролитическими свойствами, не гемолизирует эритроциты, медленно разжижает желатин. Под действием пенициллина образует сферопласты, имеющие вид «жемчужин». Это явление используется для дифференциации В. anthracis от непатогенных бацилл. Биопроба. Исследуемый материал вводят подкожно морским свинкам кроликам. Готовят мазки из крови и внутренних органов, делают посевы для выделения чистой культуры возбудителя. Экспресс-диагностикапроводится с помощью реакции термопреципитации по Асколи и иммунофлюоресцентного метода. Реакцию Асколи ставят при необходимости диагностировать сибирскую язву у павших животных или у умерших людей. Образцы исследуемого материала измельчают и кипятят в пробирке с изотоническим раствором хлорида натрия в течение 10 мин, после чего фильтруют до полной прозрачности. Метод иммунофлюоресценции позволяет выявить капсульные формы В. anthracis в экссудате. Мазки из экссудата через 5—18 ч после заражения животного обрабатывают капсульной сибиреязвенной антисывороткой, а затем флюоресцирующей антикроличьей сывороткой. В препаратах, содержащих капсульные бациллы, наблюдается желто-зеленое свечение возбудителя. Кожно-аллергическая проба. Ставится на внутренней поверхности предплечья — внутрикожно вводят 0,1 мл антраксина. При положительной реакции через 24 ч появляются гиперемия и инфильтрат. Лечение: антибиотики и сибиреязвенный иммуноглобулин. Для антибактериальной терапии препарат выбора – пенициллин. Профилактика. Для специфической профилактики используют живую сибиреязвенную вакцину. Для экстренной профилактики назначают сибиреязвенный иммуноглобулин. Преципитирующая сибиреязвенная сыворотка. Получена из крови кролика, гипериммунизированного культурой В. anthracis. Применяется для постановки реакции термопреципитации по Асколи. Сибиреязвенная живая вакцина СТИ. Высушенную взвесь живых спор В. anthracis авирулентного бескапсульного штамма. Применяется для профилактики сибирской язвы. Противосибиреязвенный иммуноглобулин. Гамма-глобулиновая фракция сыворотки крови лошади, гипериммунизированной живой сибиреязвенной вакциной и вирулентным штаммом В.anthracis, используется с профилактической и лечебной целью. 94.Иерсинии
Кишечный иерсиниоз — острая инфекционная болезнь, характеризующаяся поражением ЖКТ, тенденцией к генерализации с различных органов и систем. Возбудитель кишечного иерсиниоза Yersiniaenterocolitica. Таксономия.Y.enterocolitica относится к отделу Gracilicutes, семейству Enterobacteriaceae, роду Yersinia. Морфологические и тинкториальные свойства. Возбудитель полиморфен: он может иметь форму либо палочки с закругленными концами, либо овоидную с биполярным окрашиванием. Спор не имеет, иногда образует капсулу. Перитрих есть. Некоторые штаммы имеют пили. Грамотрицателен. Культуральные свойства.Y.enterocolitica — факультативный анаэроб. Наиб. благоприятная темп. 25С. Возбудитель неприхотлив и растет на простых питательных средах. 60
Биохимическая активность. Биохимическая активность возбудителя высокая. Внутри вида по спектру б/х активности: индолообразованию, утилизации эскулина, реакции Фогеса – Проскауэра подразделяются на 5 хемоваров. Основные б/х признаки: расщепление мочевины, ферментация сахарозы, отсутствие ферментации рамнозы, продукция орнитиндекарбоксилазы. Антигенная структура. О- и Н-антигены, у некоторых штаммов обнаружен К-антиген. По 0-антигену различают более 30 серогрупп, из которых от больных чаще всего выделяют представителей серогрупп 03, 09, 05. Факторы патогенности. Образует термостабильный эндотоксин. Некоторые штаммы выделяют вещество, соответствующее экзотоксину и обладающее энтеро- и цитотоксическим действием. У иерсиний обнаружены также инвазивный белок и белки, препятствующие фагоцитозу. Адгезивная активность иерсиний связана с пилями и белками наружной мембраны. Резистентность. Чувствителен к высокой температуре, солнечным лучам, дезинфицирующим веществам, но очень устойчив к действию низких температур: хорошо переносит температуру -20 °С. Эпидемиология. Источники болезни для человека - крысы, мыши, животные и птицы,. Механизм заражения иерсиниозом фекально-оральный, основным путем передачи является алиментарный: болезнь может возникнуть при употреблении фруктов, овощей, молока, мяса. Но возможны также контактный (при контакте людей с больными животными) и водный пути передачи. Патогенез. Возбудитель попадает в организм через рот, в нижних отделах тонкой кишки прикрепляется к эпителию слизистой оболочки, внедряется в клетки эпителия, вызывая воспаление. Под действием токсинов усиливается перистальтика кишечника и возникает диарея. Иногда в патологический процесс вовлекается аппендикс, развивается аппендицит. Незавершенный фагоцитоз способствует генерализации процесса. У людей со сниженным иммунитетом могут развиться сепсис с образованием вторичных гнойных очагов в мозге, печени и селезенке. Клиника. Различают гастроэнтероколитическую, аппендикулярную и септическую формы. Инкубационный период составляет от 1 до 4 дней. Болезнь начинается остро с повышения температуры тела до 39С, общей интоксикации, рвоты, болей в животе, поноса. Течение продолжительное. Микробиологическая диагностика. Используют бактериологический и серологический методы исследования. Цель бактериологического метода являются идентификация возбудителя, определение антибиотикограммы, внутривидовая идентификация (установление серовара, биохимического варианта, фаговара).Материалом для бактериологического метода исследования служат испражнения, ликвор, кровь, моча, иногда червеобразный отросток. Материал для исследования помешают в фосфатный буфер и подвергают холодовому обогащению. Серологическая диагностика проводится постановкой РНГА, с диагностическим титром 1:160. Важное диагностическое значение имеет наблюдение за нарастанием титра антител в динамике. Лечение. Этиотропная антибиотикотерапия. Таксономия:Y.pestisвызывает чуму; отдел Gracilicutes, семейство Enterobacteriaceae, род Yersinia. Возбудитель – Yersiniapestis. Морфологические свойства: грамотрицательные палочки, овоидной формы, окрашиваются биполярно. Подвижны, имеют капсулу, спор не образуют. Культуральные свойства. Факультативные анаэробы. Температурный оптимум +25С. Хорошо культивируются на простых питательных средах. Ферментируют большинство углеводов без образования газа. Психофилы - способны менять свой метаболизм в зависимости от температуры и размножаться при низких температурах. Вирулентные штаммы образуют шероховатые (R) колонии, переходные (RS) и сероватые слизистые гладкие авирулентные(S) формы. 69
Два типа колоний - молодые и зрелые. Молодые с неровными краями. Зрелые колонии крупные, с бурым зернистым центром и неровными краями. На скошенном агаре черед двое суток при +28 С образуют серовато - белый налет, врастающий в среду, на бульоне - нежную поверхностную пленку и хлопковидный осадок. Биохимические свойства: фенментативная активнсть высокая: ферментация до кислоты ксилозу, синтез плазмокоагулазы, фибринолизина, гемолизина, лецитиназу, сероводород. Рамнозу, мочевину не ферментирует. Антигенная структура. Группа белково - полисахаридных и липополисахаридных антигенов: термостабильный соматический О-антиген и термолабильный капсульный V,W антигены. С W-антигеном связывают вирулентность бактерий. Продуцирует факторы патогенности: фибринолизин, плазмокоагулазу, эндотоксин, экзотоксин, капсулу, V,W антигены. Резистентность: чувствителен к антибиотикам (особенно стрептомицин), нестоек к окружающей среде при высокой температуре. Патогенные свойства. Обладает патогенным потенциалом, подавляет функции фагоцитарной системы, подавляет окислительный взрыв в фагоцитах и беспрепятственно в них размножается. Факторы патогенности контролируются плазмидами трех классов. В патогенезе выделяют три основных стадии - лимфогенного заноса, бактеремии, генерализованной септицемии. Имеют адгезины и инвазины, низкомолекулярные протеины (ингибируют бактерицидные факторы), энтеротоксин. Часть факторов контролируется плазмидами вирулентности. Клинические особенности: Инкубационный период – несколько часов до 8 сут. Различают локальные – кожно-бубонная, бубонная; внешне-диссеминированные – первично-легочная, вторично-легочная и кишечная; генерализованная – первично-септическая, вторично-септическая формы чумы. Региональная лимфоаденопатия, энтероколиты, реактивные артриты, спондилит, лихорадка. Эпидемиология: Чума - классический природноочаговый зооноз диких животных. Основные носители в природе - сурки, суслики, в городских условиях - крысы. В передаче возбудителя - блохи животных, способные заражать человека. Иммунитет: клеточно-гуморальный, ограничен по длительности и напряженности. Микробиологическая диагностика:. Из исследуемого материала готовят мазки, окрашивают по Граму и водным раствором метиленового синего. Бактерии чумы представляют собой грамотрицательные палочки овоидной формы.Исследуемый материал засевают на чашки с питательным агаром. Посевы инкубируют при 25С. Первичное изучение посевов производят через 10ч. К этому сроку появляются колонии, которые образованы вирулентными R-формами. Мало- и авирулентные бактерии формируют S-формы колоний. Идентификацию чистой культуры проводят по морфологии бак-териальных клеток, характеру роста, антигенным и биохимическим свойствам, чувствительности к специфическому фагу и биопробе. На бульоне бактерии образуют пленку; ферментируют многие сахара до кислоты, индола не образуют, желатин не разжижают. Содержат групповой термостабильный соматический антиген и специфический термолабильный капсульный антиген. Биопроба.Проводится для выделения чистой культуры из материала, загрязненного посторонней микрофлорой. Экспресс-методы лабораторной диагностики: 1.Иммунофлюоресцентный метод позволяет обнаружить присутствие возбудителя как в патологическом материале, так и в объ-ектах окружающей среды (вода, воздух), а также в пищевых продуктах и эктопаразитах. С этой целью используют люмине-сцентную видоспецифическую противочумную сыворотку, люминесцентные противокапсульную и противосоматическую сыворотку. 2.РПГА - для обнаружения антигенов бактерий в материале с помощью стандартной противочумной сыворотки, антитела которой нагружены на эритроциты. Лечение: антибиотики –стрептомицин, препараты тетрациклинового ряда. Профилактика: специфическая профилактика - живая ослабленная чумная вакцина EV. Имеется сухая таблетированная вакцина для перорального применения. Для оценки иммунитета к чуме (естественного постинфекционного и вакцинального) может применяться внутрикожная аллергическая проба с пестином. Чумной бактериофаг – при идентификации Y.pestis. Чумная сухая вакцина – высушенная живая культура Y.pestis вакцинного штамма EV, используется для профилактики чумы.
96. Туберкулез—хроническое заболевание человека, сопровождающееся поражением органов дыхания, лимфатических узлов, кишечника, костей и суставов, глаз, кожи, почек и мочевыводящих путей, половых органов, центральной нервной системы. Болезнь вызывается 3 видами микобактерий: Mycobacteriumtuberculosis — человеческий вид, Mycobacteriumbovis — бычий вид, Mycobacteriumafricanum — промежуточный вид. Таксономия. отдел Firmicutes, род Mycobacterium. Родовой признак — кислото, спирто- и щелочеустойчивость. Выраженный полиморфизм. Они имеют форму длинных, тонких (М.tuberculosis) или коротких, толстых (M.bovis), прямых или слегка изогнутых палочек с гомогенной или зернистой цитоплазмой; грамположительны, неподвижны, спор не образуют, имеют микрокапсулу. Для их выявления применяют окраску по Цилю—Нильсену. Микобактерии могут образовывать различные морфовары (L-формы бактерий), которые длительно персистируют в организме и индуцируют противотуберкулезный иммунитет. Возбудители туберкулеза характеризуются медленным ростом, требовательны к питательным средам. М.tuberculosis относятся к аэробам, глицеринзависимы. На жидких питательных средах дают рост в виде сухой пленки кремового цвета. При внутриклеточном развитии, а также при росте на жидких средах выявляется характерный корд-фактор, благодаря которому микобактерии растут в виде «жгутов». По мере роста колонии приобретают бородавчатый вид. Под влиянием антибактериальных средств возбудители изменяют культуральные свойства, образуя гладкие колонии (S-формы). M.bovis —растут на средах медленнее пируватзависимы; на плотных питательных средах образуют мелкие шаровидные, серовато-белые колонии (S-формы).Высокая каталазная и пероксидазная активность. Каталаза термолабильна. М.tuberculosis в большом количестве синтезирует ниацин (никотиновая кислота), (фосфатиды, корд-фактор, туберкулостеариновая кислота) - обусловливают устойчивость к кислотам, спиртам и щелочам, препятствуют фагоцитозу, нарушают проницаемость лизосом, вызывают развитие специфических гранулем, разрушают митохондрии клеток. Микобактерии индуцируют развитие реакции гиперчувствительности IV типа (туберкулин). Факторы патогенности:обусловлены прямым или иммунологически опосредованным действием липидов и липидсодержащих структур. Антигенная структура: В ходе заболевания к антигенам образуются антипротеиновые, антифосфатидные и антиполисахаридные антитела, свидетельствующие об активности процесса. Высушивание мало влияет. Погибают при кипячении. Основной источник инфекции — человек, больной туберкулезом органов дыхания, выделяющий микробы в окружающую среду с мокротой. Основные пути передачи инфекции — воздушно-капельный и воздушно-пылевой.. Инкубационный период составляет от 3—8 нед. до 1 года и более. В развитии болезни выделяют первичный, диссеминированный и вторичный туберкулез, который является результатом эндогенной реактивации старых очагов. В зоне проникновения микобактерий возникает первичный туберкулезный комплекс, состоящий из воспалительного очага, пораженных регионарных лимфатических узлов и измененных лимфатических сосудов между ними. Диссеминация микробов может происходить бронхо-, лимфо- и гематогенно.В основе специфического воспаления при туберкулезе лежит реакция гиперчувствительности IV типа, что препятствует распространению микробов по организму. Различают 3 клинические формы: первичная туберкулезная интоксикация у детей и подростков, туберкулез органов дыхания, туберкулез других органов и систем. Основными симптомами легочного туберкулеза являются субфебрильная температура тела, кашель с мокротой, кровохарканье, одышка.Иммунитет. Противотуберкулезный иммунитет нестерильный инфекционный, обусловлен наличием в организме L-форм микобактерий. Микробиологическая диагностика. Диагностику проводят с помощью бактериоскопии, бактериологического исследования и постановки биологической пробы. Все методы направлены на обнаружение микобактерий в патологическом материале: мокроте, промывных водах бронхов, плевральной и церебральной жидкостях, кусочках тканей из органов. К обязательным методам обследования относится бактериоскопическое, бактериологическое исследование, биологическая проба, туберкулинодиагностика, основанная на определении повышенной чувствительности организма к туберкулину. Чаще для выявления инфицирования и аллергических реакций ставят внутрикожную пробу Манту с очищенным туберкулином в стандартном разведении. Для экспресс-диагностики туберкулеза применяют РИФ(реакция иммунофлюоресенции) и ПЦР(полимеразная цепная реакция). Для массового обследования населения, раннего выявления активных форм туберкулеза можно использовать ИФА(иммуноферментный анализ), направленный на обнаружение специфических антител. Лечение. По степени эффективности противотуберкулезные препараты делят на группы: группа А — изониазид, рифампицин; группа В — пиразинамид, стрептомицин, флоримицин; группа С – ПАСК, тиоацетозон. При наличии сопутствующей микрофлоры и множественной лекарственной устойчивости микобактерий применяют фторхинолоны и альдозон.. Специфическую профилактику проводят путем введения живой вакцины — BCG(БЦЖ), внутрикожно на 2—5-й день после рождения ребенка. Проводят последующие ревакцинации. Предварительно ставят пробу Манту для выявления туберкулиннегативных лиц, подлежащих ревакцинации. Условно-патогенные микобактерии: семейство Mycobacteriaceae, род Mycobacterium. Сходны по биологич. свойствам, но устойчивы к противотуберкулезным препаратам. 1 группа: медленнорастущие фотохромогенные M.kansassi, M.marinum – поражения кожи, лимфадениты, инфекции мочеполового тракта. 2 группа: медленнорастущие скотохромогенные: M.scrofulaceum, M.gordonae. 3 группа: медленнорастущие нехромогенные: M.avium, M.gastri. 4 группа: быстрорастущие ското-,фотохромогенные: M.fortuitum, M.chelonei.
97. Лепра. хроническое гранулематозное заболевание, поражаются слизистые оболочки, верхние дыхат. пути, периферическая нервная система, глаза. Mycobacteriaceae, род Mycobocterium, вид M. leprae. Морфологические и культуральные свойства: прямая/изогнутая палочка с закругленными концами. Грамположительные, спор и капсул не образуют, имеют микрокапсулу, жгутиков не имеют. Кислото- и спиртоустойчивость, что обуславливает окраску по Цилю—Нельсену. Не культивируется на искусственных питательных средах. Размножается только в цитоплазме клетки путем деления и образуют шаровидные скопления Характерной особенностью лепрозных клеток, относящихся к макрофагам, является наличие бледного ядра и «пенистой» цитоплазмы. Токсинов не образует.Утилизируют глицерин и глюкозу и имеют специфический фермент О-дифенолоксидазу. Обладают способностью продуцировать внеклеточные липиды. Аэробы по выявлению на мембранных структурах микроорганизма ОВ ферментов: пероксидазы, цитохромоксидазы.. Ряд антигенов М. leprae являются общими для всех микобактерий, в том числе с вакцинным штаммом BCG, что используется для профилактики лепры.Из М. leprae выделен видоспецифический гликолипид с наличием трисахарида. АТ к гликолипиду обнаруживаются только у больных лепрой, что используется для активного выявления больных лепрой при обследовании лиц с помощью ИФА. :Антропоноз. Резервуар, источник возбудителя - больной человек (при кашле, чихании – выделяет бактерии). Входные ворота - слизистая оболочка верхних дыхательных путей и поврежденные кожные покровы. Возбудитель распространяется лимфогематогенным путем, поражая клетки кожи и периферической нервной системы. Инкубационный период от 3-5 лет. При высокой резистентности развивается полярная туберкулоидная форма заболевания (ТТ-тип лепры), а при низкой резистентности развивается полярная лепроматозная форма заболевания (LL-тип лепры). Иммунитет: относительный. В зонах с массивным инфицированием лепра может быть вызвана на фоне существующего естественного или приобретенного иммунитета. Микробиологическая диагностика: Материал для бактериоскопического исследования: соскобы с кожи и слизистых оболочек носа, мокрота, пунктаты лимфатических узлов. Мазки окрашивают по Цилю—Нельсену. Наибольшее значение бактериоскопия соскобов имеет при LL-форме, при которых М. leprae выявляются во всех высыпаниях в больших количествах. При ТТ-формезаболевания М. leprae в соскобах выявляются очень редко, поэтому окончательную роль в диагностике заболевания имеет гистологическое исследование биоптатов кожи и слизистых оболочек, которое позволяет определить структуру гранулем. Серологическая диагностика основана на обнаружении антител к фенольному гликолипиду в ИФА , в настоящее время получены моноклональные антитела, которые позволяют определять лепрозные антигены в тканях, разрабатывается ПЦР. Вспомогательное значение имеет изучение иммунного статуса больного, в том числе постановка лепроминовой пробы (лепромин А). У больных LL-формойпроба отрицательная, а у больных ТТ-формойона положительная. Лечение: Препараты сульфонового ряда: дапсон, солюсульфон. Рифампицин, клофазимин и фторхинолоны. Методы генной терапии.
Профилактика: Специфической профилактики нет. Для относительного усиления иммунитета используется вакцина BCG, составной частью которой является лепромин А. Атипичные микобактерии. Легочные инфекции чаще всего вызывают Mycobacterium avium-intracellulare и Mycobacterium kansasii (чувствительна к противотуберкулезным средствам , включая изониазид ). Атипичные микобактерии встречаются повсеместно, но вирулентность их невысока. Главный фактор, предрасполагающий к поражению легких атипичными микобактериями, - хронические заболевания легких ( ХОЗЛ , рак легкого ,туберкулез , бронхоэктазы , муковисцидоз , силикоз ).
Появились сообщения об учащении легочных инфекций, вызванных атипичными микобактериями, среди лиц, не страдающих патологией легких. Как правило, это люди преклонного возраста. Многие из них - женщины с воронкообразной грудной клеткой или сколиозом , у которых поражаются язычок левого легкого и средняя доля правого легкого.
Выделение атипичных микобактерии из дыхательных путей у ВИЧ-инфицированных заслуживает отдельного обсуждения. Mycobacterium avium-intracellulare лишь изредка становится у них причиной тяжелого поражения легких, поэтому ее обнаружение в мокроте в отсутствие рентгенологических изменений обычно не представляет опасности. Исключение составляют ВИЧ-инфицированные с числом лимфоцитов CD4 меньше 50 в мкл: в этом случае возрастает риск бактериемии. Обнаружение Mycobacterium kansasii , напротив, имеет большое клиническое значение. Этот микроорганизм вызывает легочную инфекцию с преимущественным поражением верхних долей, напоминающую туберкулез - с лихорадкой , кашлем , формированием инфильтратов и каверн .
Клиническая картина. Легочная инфекция, вызванная атипичными микобактериями, в большинстве случаев проявляется постоянным кашлем , субфебрильной температурой и общим недомоганием . Иногда наблюдается кровохарканье . Эти симптомы иногда ошибочно приписывают прогрессированию основного заболевания. У больных СПИДом инфекция, вызванная Mycobacterium kansasii , может протекать тяжело, напоминая туберкулез легких .
Диагностика. Выделение из мокроты атипичных микобактерии, не означает наличия инфекции. Эти микроорганизмы нередко просто обсеменяют дыхательные пути - как у больных, так и у здоровых людей. Поскольку бороться с атипичными микобактериями непросто, важна точная диагностика.
Актиномицеты..Морфология.Род Actynomyces Ветвящиеся бактерии. Не содержат в клеточной стенке хитина, стенка имеет строение грамположительных бактерий. Мицелий имеет вид тонких прямых палочек, образуют нити, способность образовывать хорошо развитый мицелий. Палочковидные формы, часто с утолщенными концами, в мазке располагаются по одиночке, парами, V- и Y-образно. Все морфологические формы способны к истинному ветвлению. По Граму окрашиваются плохо, часто образуют зернистые либо четкообразные формы; некислотоустойчивы. Типовой вид — Actinomycesbovis. Культуральные свойства. Облигатные и факультативные анаэробы. Растут медленно. Некоторые штаммы дают α-β-гемолиз на средах с кровью. Некоторые виды формируют нитчатые микроколонии, напоминающие мицелий, на 7е сутки образуют S-формы колоний, иногда окрашенные в желтый/красный цвет. A. odontolyticusна кровяном агаре образует красные колонии с зоной β-гемолиза. Биохимическая активность.Хемоорганотрофы. Ферментируют углеводы с образованием кислоты без газа, продукты фермента-ции — уксусная, муравьиная, молочная и янтарная кислоты. Наличие каталазы и способность восстанавливать нитраты в нитриты, индол не образуют.В ИФА выделяют 6 cepoгpyпп: A, B, C, D, E и F. Чувствительность к антимикробным препаратам. Чувствительны к пенициллинам, тетрациклину, эритромицину, но резистентны к антимикотикам. Источник инфекции — почва. Механизм передачи — контактный, а путь передачи — раневой. Колонизируют слизистую оболочку полости рта человека и млекопитающих .Вызывают оппортунистическую инфекцию. Актиномикоз — хроническая оппортунистическая инфекция человека и животных, вызываемая анаэробными и факультативно-анаэробными актиномицетами, которая характеризуется гранулематозным воспалением. Микробиологическая диагностика: Материал для исследования - мокрота, ликвор, гной из свищей, биопсия тканей. Для диагностики используют бактериоскопический, бактериологический, серологический и аллергологический методы. По Граму споры окрашиваются в темно-фиолетовый, мицелий — в фиолетовый, а друзы — в розовый цвет. Для подавления роста сопутствующей микрофлоры гной и мокроту перед посевом центрифугируют в растворе пенициллина и стрептомицина. Засевают на питательные среды (сахарный агар) и культивируют в аэробных и анаэробных условиях. У выделенных культур определяют способность сворачивать и пептонизировать молоко — признак, характерный для актино-мицетов. Выделение анаэробных видов подтверждает диагноз актиномикоза. Для серодиагностики ставят РСК с актинолизатом. Реакция недостаточно специфична, поскольку положительные результаты могут отмечаться при раке легкого и тяжелых нагноительных процессах. Применение в качестве АГ вместо актинолизата внеклеточных белков актиномицетов повышает чувствительность РСК. Этот же АГ можно использовать и для постановки РИГА. Аллергическую пробу проводят с актинолизатом. Лечение пенициллина, тетрациклина, эритромицина, клиндамицина. Профилактика.Специфическая профилактика - нет. Неспецифическая - повышение иммунного статуса.
98. Коклюш — острая инфекционная болезнь, характеризующаяся поражением верхних дыхательных путей, приступами спазматического кашля; наблюдается преимущественно у детей. Возбудитель коклюша Bordetellapertussis Таксономия.B.pertussis относится к отделу Gracilicutes, роду Bordetella. В.pertussis — мелкая овоидная грамотрицательная палочка с закругленными концами. Спор и жгутиков не имеет, образует микрокапсулу, пили. Строгий аэроб. Оптимальная температура культивирования 37С. B.pertussis очень медленно растет только на специальных питательных средах, например на среде Борде — Жангу (картофельно-глицериновый агар с добавлением крови), образуя колонии, похожие на капельки ртути. Расщепляют глк. и лактозу до кислоты без газа. Антигенная структура. О-антиген термостабильный продоспецифический. 14 поверхностных термолабильных капсульных К-антигенов. В.pertussis имеет 6 сероваров. Фактор 7 является общим для всех бордетелл. Термостабильный эндотоксин, вызывающий лихорадку; белковый токсин, обладающий антифагоцитарной активностью и стимулирующий лимфоцитоз; ферменты агрессии, повышающие сосудистую проницаемость, обладающие гистаминсенсибилизирующим действием, адгезивными свойствами и вызывающие гибель эпителиальных клеток. В адгезии бактерий также участвуют гемагглютинин, пили и белки наружной мембраны. Очень неустойчив во внешней среде. Коклюш — антропонозная инфекция: источником заболевания являются больные люди и в очень незначительной степени бактерионосители. Заражение происходит через дыхательный тракт, путь передачи воздушно-капельный. Коклюш встречается повсеместно, очень контагиозен. Паракоклюш реже, эпиходический характер. Протекает легче. Патогенез. Неинвазивные микробы (не проникают внутрь клетки-мишени). Входными воротами инфекции являются верхние дыхательные пути. Здесь благодаря адгезивным факторам бордетеллы адсорбируются на ресничках эпителия, размножаются, выделяют токсины и ферменты агрессии. Развиваются воспаление, отек слизистой оболочки, при этом часть эпителиальных клеток погибает. В результате постоянного раздражения токсинами рецепторов дыхательных путей появляется кашель. В возникновении приступов кашля имеет значение и сенсибилизация организма к токсинам B.pertussis. Клиника. Инкубационный период составляет 2—14 дней. В начале болезни появляются недомогание, невысокая температура тела, небольшой кашель, насморк. Позже начинаются приступы спазматического кашля, заканчивающиеся выделением мокроты. Болезнь продолжается до 2 мес. Иммунитет. После перенесенной болезни иммунитет стойкий, сохраняется на протяжении всей жизни. Видоспецифический (антитела против В.pertussis не защищают от заболеваний, вызванных В.parapertussis.
Микробиологическая диагностика. Материалом для исследования служит слизь из верхних дыхательных путей, используют метод «кашлевых пластинок» (во время приступа кашля ко рту ребенка подставляют чашку Петри с питательной средой). Основной метод диагностики — бактериологический. Позволяет отдифференцировать возбудителя коклюша от паракоклюша. Для идентификации возбудителя – реакция агглютинации на стекле с К-сыворотками. Для ускоренной диагностики применяют прямую РИФ со специфической флуоресцентной сывороткой и материалом из зева. Серологический метод – обнаружение IgG и IgA против феламентозного гемаггютинина и против токсина В.pertussis. Лечение. Антимикробные препараты – эритромицин, ампициллин (кроме пенициллина). При тяжелых формах коклюша применяют нормальный человеческий иммуноглобулин.. Профилактика. Адсорбированная коклюшно-дифтерийно-столбнячная вакцина (АКДС). В ее состав входит убитая культура В. pertussisI фазы, коклюшный токсин, агглютиногены, капсульный антиген. Нормальный человеческий иммуноглобулин вводят неиммунизированным детям при контакте с больными для экстренной профилактики. Разрабатывается неклеточная вакцина с меньшими побочными эффектами, содержащая анатоксин, гемагглютинин, пертактин и антиген микроворсинок. Паракоклюш вызывает Bordetellaparapertussis. Паракоклюш сходен с коклюшем, но протекает легче. Паракоклюш распространен повсеместно и составляет примерно 15 % от числа заболеваний с диагнозом коклюш. Перекрестный иммунитет при этих болезнях не возникает.
99.Энтеробактерии. Семейство Enterobakteriaceae включает в себя многочисленных представителей, имеющих общее местообитание – кишечник.Энтеробактерии делят на:1) патогенные (шигеллы, сальмонеллы, эшерихии, иерсинии и др.); 2) условно-патогенные (37 родов). Все патогенные энтеробактерии могут вызывать у человека острые кишечные инфекции, условно-патогенные – гнойно-воспалительные заболевания и пищевые токсикоинфекции.Энтеробактерии – грамотрицательные палочки средней величины с закругленными концами, располагающиеся беспорядочно. Являются факультативными анаэробами.На мясопептонном агаре образуют однотипные колонии. (Средней величины, круглые, гладкие, выпуклые, блестящие, бесцветные). В мясопептонном бульоне равномерное помутнение. Все энтеробактерии: 1) ферментируют глюкозу до кислоты или до кислоты и газа; 2) редуцируют нитраты в нитриты; 3) каталаза +, оксидаза —, Антигены энтеробактерий состоят из: 1) О-антигена, который локализуется в клеточной стенке 2) К-антигена (это поверхностный, капсульный антиген); 3) Н-антигена (термолабильного, жгутикового); 4) пилифимбриального антигена; он есть у бактерий, имеющих ворсинки, пили, фимбрии.
Классификация
энтеробактерий основана на их биохимических
свойствах. Согласно классификации
Берджи семейство энтеробактерий делится
на 40 родов, роды – на виды. В ряде случаев
возможна внутривидовая дифференциация
на:
1) ферментовары;
2) серогруппы
и серовары;
3) фаговары;
4) колециновары.
Кишечная
инфекция – результат взаимодействия
возбудителя с соответствующими
структурами макроорганизма при
необходимых условиях внешней среды.
Этот процесс состоит из нескольких
фаз:1) адгезии;2) инвазии;3) колонизации;4) продукции
экзо– и энтеротоксинов.
Адгезия идет
в два этапа:
1) неспецифическая
адгезия (приближение);2) специфическая
адгезия (в результате лиганд-специфического
взаимодействия соответствующих структур
энтеробактерий (ворсинок, фимбрий) и
рецепторов плазмолеммы эпителиальных
клеток).
Инвазия – проникновение
бактерий в эпителиальные клетки с
размножением или без него.

100. Эшерихиозы - инфекционные болезни, возбудителем которых является Escherichiacoli. Различают энтеральные (кишечные) и парентеральные эшерихиозы. Энтеральные эшерихиозы — острые инфекционные болезни, характеризующиеся преимущественным поражением ЖКТ. Они протекают в виде вспышек, возбудителями являются диареегенные штаммы E.coli. Парентеральные эшерихиозы — болезни, вызываемые условно-патогенными штаммами E.coli — представителями нормальной микрофлоры толстой кишки, отделу Gracilicutes. E.coli — это мелкие грамотрицательные палочки с закругленными концами. В мазках они располагаются беспорядочно, не образуют спор, перитрихи. Некоторые штаммы имеют микрокапсулу, пили. Кишечная палочка — факультативный анаэроб, оптим. темп. для роста - 37С. E.coli не требовательна к питательным средам и хорошо растет на простых средах, давая диффузное помутнение на жидких и образуя колонии на плотных средах. Для диагностики эшерихиозов используют дифференциально-диагностические среды с лактозой — Эндо, Левина. Ферментативная активность .E.coliобладает большим набором различных ферментов. Наиболее отличительным признаком E.coliявляется ее способность ферментировать лактозу. Кишечная палочка обладает соматическим О-, жгутиковым Н и поверхностным К -антигенами. О-антиген имеет более 170 вариантов, К-антиген — более 100, Н-антиген — более 50. Строение О-антигена определяет принадлежность к серогруппе. Штаммы E.coli, имеющие присущий им набор антигенов (антигенную формулу), называются серологическими вариантами (серовары). По антигенным, токсигенным, свойствам различают два биологических варианта E.coli: 1) условно-патогенные кишечные палочки; 2) «безусловно» патогенные, диареегенные. Факторы патогенности. Образует эндотоксин, обладающий энтеротропным, нейротропным и пирогенным действием. Патогенные E. coli делят на четыре основных класса.
1. ЕТЕС – энтеротоксигенные эшерихии коли. Обладают тропизмом к эпителию тонкого кишечника. Попав в организм, они прикрепляются к рецепторам мембран энтероцитов. У них есть СФ-фактор колонизации, за счет которого они заселяют эпителиальные клетки тонкого кишечника. Внутрь клеток они не проникают, и воспаление не развивается.
Они продуцируют экзоэнтеротоксин, синтез которого кодируется плазмидой. Этот токсин состоит из:
1) ЛТ-термолабильной фракции;
2) СТ-термостабильной фракции.
Токсин обладает цитотоническим действием. В результате его воздействия нарушается процесс энтеросорбции, что ведет к развитию диарейного синдрома. Клинически заболевание протекает как легкая форма холеры.
2. EIEC – энтероинвазивные эшерихии коли. Обладают тропизмом к эпителиальным клеткам толстого кишечника. Факторами их вирулентности являются наличие на поверхности клеточной стенки белков наружной мембраны, способность к инвазии и внутриклеточному размножению. Размножение бактерий приводит к гибели клетки. На месте погибших клеток образуются язвы и эрозия, окруженные воспалением.
3. EPEC – энтеропатогенные эшерихии коли. Вызывают энтероколиты у детей до года. Поражается эпителий тонкого кишечника. Фактор вирулентности – способность к ограниченной инвазии.
4. EHEC – энтерогеморрагические эшерихии коли. Обладают тропизмом к эпителиальным клеткам толстого кишечника. Фактор вирулентности – продукция двух типов шигоподобных токсинов (SLT). Вызывают гемоколит.
.
К факторам патогенности всех штаммов
E.coliотносятся
пили и белки наружной мембраны,
способствующие адгезии, а также
микрокапсула, препятствующая фагоцитозу.
Резистентность.E.coliотличается
более высокой устойчивостью к действию
различных факторов внешней среды; она
чувствительна к дезинфектантам, быстро
погибает при кипячении. палочка —
представитель нормальной микрофлоры
толстой кишки. Она является антагонистом
патогенных кишечных бактерий, гнилостных
бактерий и грибов рода Candida.
Кроме того,
она участвует в синтезе витаминов группы
В, Е и
К, частично
расщепляет клетчатку. Штаммы, обитающие
в толстой кишке и являющиеся
условно-патогенными, могут попасть за
пределы ЖКТ и при снижении иммунитета
и их накоплении стать причиной различных
неспецифических гнойно-воспалительных
болезней (циститов, холециститов) -
парентеральных
эшерихиозов. Эпидемиология.
Источник энтеральных эшерихиозов -
больные люди. Механизм заражения —
фекально-оральный, пути передачи—алиментарный,
контактно-бытовой..Попадает в тонкую
кишку, адсорбируется в клетках эпителия
с помощью пилей и белков наружной
мембраны. Бактерии размножаются,
погибают, освобождая эндотоксин, который
усиливает перистальтику кишечника,
вызывает диарею, повышение температуры
тела и другие симптомы общей интоксикации.
Выделяет экзотоксин - тяжелая диарея,
рвоту и значительное нарушение
водно-солевого обмена. Болезнь начинается
остро, с повышения температуры тела,
болей в животе, поноса, рвоты. Отмечаются
нарушение сна и аппетита, головная боль.
После перенесенной болезни иммунитет
непрочный и непродолжительный.
Микробиологическая
диагностика.
Основной метод — бактериологический.
Определяют
вид чистой культуры (грамотрицательные
палочки, оксидазоотрицательные,
ферментирующие глюкозу и лактозу до
кислоты и газа, образующие индол, не
образующие сероводород) и принадлежность
к серогруппе, что позволяет, отличить
условно-патогенные кишечные палочки
от диареегенных. Внутривидовая
идентификация, имеющая эпидемиологическое
значение, заключается в определении
серовара с помощью диагностических
адсорбированных иммунных сывороток.
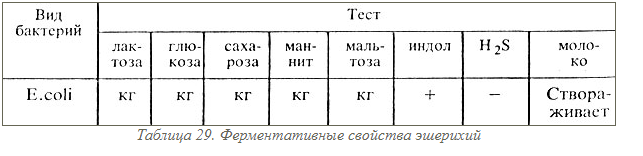
101Род Shigella включает 4 вида: S. dysenteriae — 12 сероваров, S.flexneri— 9 сероваров, S. boydii— 18 сероваров, S. sonnei — 1 серовар.Шигеллы представлены неподвижными палочками. Спор и капсул не образую.Хорошо культивируются на простых питательных средах. На плотных средах образуют мелкие глад-кие, блестящие, полупрозрачные колонии; на жидких — диффузное помутнение. Жидкой средой обогащения является селенитовый бульон. У S. Sonne iотмечена при росте на плотных средах SR-диссоциация. Биохимическая активность:слабая; отсутствие газообразования при ферментации глюкозы, отсутствие продукции сероводорода, отсутствие ферментации лактозы. Шигеллы переносят высушивание, низкие темпе-ратуры, быстро погибают при нагревании. S. sonneiв молоке способны не только длительно переживать, но и размножаться. У S. Dysenteriae отмечен переход в некультивируемую форму. Соматический О-антиген, в зависимости от строения которого происходит их подразделение на серовары, aS. flexneriвнутри сероваров подразделяется на подсеровары. S. sonneiобладает антигеном 1-й фазы, который является К-антигеном..Способность вызывать инвазию с последующим межклеточным распространением и размножением в эпителии слизистой толстого кишечника. Функционирование крупной плазмиды инвазии, которая имеется у всех 4 видов шигелл. Плазмида инвазии детерминирует синтез белков, входящих в состав наружной мембраны, которые обеспечивают процесс инвазии слизистой. Продуцируют шига и шигаподобные белковые токсины. Эндотоксин защищает шигеллы от дейс-твия низких значений рН и желчи. Эпидемиология: Заболевания - шигеллезы, антропонозы с фекально-оральным механизмом передачи. Заболевание, вызываемое S. dysenteriae, имеет контактно-бытовой путь передачи. S. flexneri— водный, aS. sonnei— алиментарный. :Инфекционные заболевания, характеризующиеся поражением толстого кишечника, с развитием колита и интоксикацией. Шигеллы взаимодействуют с эпителием слизистой толстой кишки. Прикрепляясь инвазинами к М-клеткам, шигеллы поглощаются макрофагами. Взаимодействие шигелл с макрофагами приводит к их гибели, следствием чего является выделение ИЛ-1, который инициирует воспаление в подслизистой. При гибели шигелл происходит выделение шига токсинов, действие которых приводит к появлению крови в испражнениях. Иммунитет. Секреторные IgA, предотвращающие адгезию, и цитотоксическая антителозависимая активность лимфоцитов. Микробиологическая диагностика.
Бактериологический:материалом для исследования - испражнения. Для посева отбираются гнойно-кровяные образования из кала, которые при диагностике заболевания высеваются на лактозосодержащие дифференциальные питательные плотные среды. В случае выявления бактерионосителей посев испражнений проводится в селенитовый бульон с выделением возбудителя на плотных лактозосодержащих дифференциальных питательных средах. В качестве вспомогательного используют серологический метод с постановкой РНГА. Лечение и профилактика:Для лечения - бактериофаг орального применения, антибиотики после определения антибиотикограммы; в случае возникновения дисбактериоза — препараты пробиотиков для коррекции микрофлоры.
102.Сальмонелы.. Острая кишечная зоонозная инфекция, вызываемая сероварами сальмонелл, характеризующаяся поражением ЖКТ. Морфологические свойства: подвижные, грам «-» палочки, капсулы нет. Хорошо растут на простых питательных и желчесодержащих средах. На плотных – образуют колонии в R-и S-формах, на жидких – помутнение. На лактозособержащих средах образуют бесцветные колонии. Биохимическая активность: ферментация глк. до кислоты и газа, отсутствие ферментации лактозы, продукция сероводорода, отсутствие индолообразования. Антигенная структура: соматический О-антиген, жгутиковый Н-антиген, Некоторые – К-антиген. Род Salmonellaсостоит из двух видов — вида S. enterica, в который включены все сальмонеллы, являющиеся возбудителями человека и теплокровных животных, и вида S. bongori, который подразделяется на 10 сероваров. Некоторые серовары сальмонелл, в частности S. Typhi, имеют полисахаридный Vi-антиген, являющийся разновидностью К-антигена. Возбудителями сальмонеллеза является большая группа сальмонелл, входящая в подвид enterica. Наиболее часто возбудителями сальмонеллезов у человека являются серовары S. Typhimurium, S. Dublin, S. Choleraesuis. Основные факторы передачи — мясо, молоко, яйца, вода.Заболевание протекает в локальной форме гастроэнтерита, ведущий синдром - диарейный. Инвазировав слизистую тонкого кишечника через М-клетки и проникнув в подслизистую, сальмонеллы захватываются макрофагами, переносясь ими в пейеровы бляшки, где формируют первичный очаг инфекции. При этом выделяются эндотоксин и белковый энтеротоксин. Энтеротоксин активирует поступление в просвет кишечника большого количества жидкости, К,Na. Понос, рвота. Иммунитет: Ненапряженный, серовароспецифический, опосредован секреторным IgA, который предотвращает процесс пенетрации сальмонеллами слизистой тонкого кишечника. В крови могут определяться антитела. Патогенез
Адгезия на энтероцитах тонкой кишки → колонизация слизистой → в пейеровы бляшки, фагоцитоз макрофагами и активное размножение в них → общий ток лимфы → бактериемия → костный мозг, селезенка, желчный пузырь → размножение в желчном пузыре (элективная среда) → 12-перстная кишка → вторичное попадание в тонкую кишку и пейеровы бляшки → иммунное воспаление, интоксикация организма эндотоксином.
Микробиологическая диагностика.Бактериологическому исследованию подвергают рвотные массы, промывные воды же-лудка, испражнения, желчь, мочу, кровь. При идентификации выделенных культур необходим широкий набор диагностических О- и Н- сывороток. Для серологического исследования применяют РНГА, ИФА. Важное диагностическое значение имеет нарастание титра антител в динамике заболевания.Применяется патогенетическая терапия, направленная на нормализацию водно-солевого обмена. При генерализованных формах — этиотропная антибиотикотерапия. Сальмонеллезные групповые, адсорбированные О- и Н-агглютинирующие сыворотки. Применяются для установления серогрупп и сероваров сальмонелл в реакции агглютинации. Сальмонеллезные О- и Н-монодиагностикумыпредставляют собой взвеси сальмонелл, убитых нагреванием (О-диагностикумы) или обработкой формалином (Н-диагностикумы). Применяются для серодиагностики брюшного тифа. Профилактика. Специфическая профилактика сальмонеллеза у с/х животных и птиц. Неспецифическая профилактика - проведение ветеринарно-санитарных мероприятий.
105.Микоплазмы. Антропонозные бактериальные инфекции человека, поражающие органы дыхания или мочеполовой тракт. Микоплазмы относятся к классу Mollicutes, который включает 3 порядка: Acholeplasmatales, Mycoplasmatales, Anaeroplasmatales. Морфология: Отсутствие ригидной клеточной стенки, полиморфизм клеток, пластичность, осмотическую чувствительность, резистентность к различным агентам, подавляющим синтез клеточной стенки, в том числе к пенициллину и его производным. Грам «-», лучше окрашиваются по Романовскому—Гимзе; различают подвижные и неподвижные виды. Клеточная мембрана находится в жидкокристаллическом состоянии; включает белки, погруженные в два липидных слоя, основной компонент которых — холестерин.. Хемоорганотрофы, основной источник энергии — глюкоза или аргинин.. Большинство видов — факультативные анаэробы; чрезвычайно требовательны к питательным средам и условиям культивирования. Питательные среды (экстракт говяжьего сердца, дрожжевой экстракт, пептон, ДНК, глюкоза, аргинин). Культивируют на жидких, полужидких и плотных питательных средах. Биохимическая активность: Низкая. Выделяют 2 группы микоплазм: 1. разлагающие с образованием кислоты глюкозу, мальтозу, маннозу, фруктозу, крахмал и гликоген; 2.окисляющие глутамат и лактат, но не ферментирующие углеводы. Все виды не гидролизуют мочевину. Антигенная структура: Сложная, имеет видовые различия; основные АГ представлены фосфо- и гликолипидами, полисахаридами и белками; наиболее иммунногенны поверхностные АГ, включающие углеводы в составе сложных гликолипидных, липогликановых и гликопротеиновых комплексов.
Факторы патогенности: адгезины, токсины, ферменты агрессии и продукты метаболизма. Адгезины входят в состав поверхностных АГ и обуславливают адгезию на клетках хозяина. Предполагают наличие нейротоксина у некоторых штаммов М. pneumoniae, так как часто инфекции дыхательных путей сопровождают поражения нервной системы. Эндотоксины выделены у многих патогенных микоплазм. У некоторых видов встречаются гемолизины. Среди ферментов агрессии основными факторами патогенности являются фосфолипаза А и аминопептидазы, гидролизующие фосфолипиды мембраны 82
клетки. Протеазы, вызывающие дегрануляцию клеток, в том числе и тучных, расщепление молекул AT и незаменимых аминокислот. Эпидемиология: М. pneumoniaeколонизирует слизистую оболочку респираторного тракта; M. hominis, M. genitaliumuU. urealyticum— «урогенитальные микоплазмы» — обитают в урогенитальном тракте. Источник инфекции — больной человек. Механизм передачи — аэрогенный, основной путь передачи — воздушно-капельный. Патогенез: Проникают в организм, мигрируют через слизистые оболочки, прикрепляются к эпителию через гликопротеиновые рецепторы. Микробы не проявляют выраженного цитопатогенного действия, но вызывают нарушения свойств клеток с развитием местных воспалительных реакций. Клиника: Респираторный микоплазмоз - в форме инфекции верхних дыхательных путей, бронхита, пневмонии. Внереспираторные проявления: гемолитическая анемия, неврологические расстройства, осложнения со стороны ССС. Иммунитет: для респираторного и урогенитального микоплазмоза характерны случаи повторного заражения. Микробиологическая диагностика: мазки из носоглотки, мокрота, бронхиальные смывы. При урогенитальных инфекциях исследуют мочу, соскобы с уретры, влагалища. Для лабораторной диагностики микоплазменных инфекций используют культуральный, серологический и молекулярно-генетический методы. При серодиагностике материалом для исследования служат мазки-отпечатки тканей, соскобы из уретры, влагалиша, в которых можно обнаружить АГ микоплазм в прямой и непрямой РИФ. Микоплазмы и уреаплазмы выявляются в виде зеленых гранул. АГ микоплазм могут быть обнаружены также в сыворотке крови больных. Для этого используют ИФА. Для серодиагностики респираторного микоплазмоза определяют специфические AT в парных сыворотках больного. При урогенитальных микоплазмозах в ряде случаев проводят серодиагностику, AT определяют чаше всего в РПГА и ИФА. Лечение. Антибиотики. Этиотропная химиотерапия. Профилактика. Неспецифическая.
106.Хламидии. Таксономия: порядок Chlamydiales, семейство Chlamydaceae, род Chlamydia. Род представлен видами С.trachomatis, C.psittaci,C.pneumoniae. Болезни, вызываемые хламидиями, называют хламидиозами. Заболевания, вызываемые C. trachomatisuC. pneumoniae, — антропонозы. Орнитоз, возбудителем которого является С. psittaci, — зооантропонозная инфекция. Морфология хламидий: мелкие, грам «-» бактерии, шаровидной формы. Не образуют спор, нет жгутиков и капсулы. Клеточная стенка: 2-х слойная мембрана. Имеют гликолипиды. По Граму – красный цвет. Основной метод окраски – по Романовскому – Гимзе. 2 формы существования: элементарные тельца (неактивные инфекционные частицы, вне клетки); ретикулярные тельца (внутри клеток, вегетативная форма). Культивирование:Можно размножать только в живых клетках. В желточном мешке развивающихся куриных эмбрионов, организме чувствительных животных и в культуре клеток Ферментативная активность: небольшая. Ферментируют пировиноградную кислоту, синтезируют липиды. Не способны синтезировать высокоэнергетические соединения. Антигенная структура: Антигены трех типов: родоспецифический термостабильный липополисахарид (в клеточной стенке). Выявляют с помощью РСК; видоспецифический антиген белковой природы (в наружной мембране). Обнаруживают с помощью РИФ; вариантоспецифический антиген белковой природы. Факторы патогенности.С белками наружной мембраны хламидий связаны их адгезивные свойства. Эти адгезины обнаруживают только у элементарных телец. Хламидии образуют эндотоксин. У некоторых хламидий обнаружен белок теплового шока, способный вызывать аутоиммунные реакции. Резистентность. Высокаяк различным факторам внешней среды. Устойчивы к низким температурам, высушиванию. Чувствительны к нагреванию. С. trachomatis - возбудитель заболеваний мочеполовой системы, глаз и респираторного тракта человека. Трахома — хроническое инфекционное заболевание, характеризующееся поражением конъюнктивы и роговицы глаз. Антропоноз. Передается контактно- бытовым путем. Патогенез: поражает слизистую оболочку глаз. Он проникает в эпителий конъюнктивы и роговицы, где размножается, разрушая клетки. Развивается фолликулярный кератоконъюнктивит. Диагностика: исследование соскоба с конъюнктивы. В пораженных клетках при окраске по Романовскому—Гимзе обнаруживают цитоплазматические включения фиолетового цвета, расположенные около ядра — тельца Провачека. Для выявления специфического хламидийного антигена в пораженных клетках применяют также РИФ и ИФА. Иногда прибегают к культивированию хламидий трахомы на куриных эмбрионах или культуре клеток. Лечение: антибиотики (тетрациклин) и иммуностимуляторы (интерферон). Профилактика:Неспецифическая. Урогенитальный хламидиоз — заболевание, передающееся половым путем. Это — острое/хроническое инфекционное заболевание, которое характеризуется преимущественным поражением мочеполового тракта. Заражение человека происходит через слизистые оболочки половых путей. Основной механизм заражения — контактный, путь передачи — половой. Иммунитет: клеточный, с сыворотке инфицированных – специфические антитела. После перенесенного заболевания - не формируется. Диагностика: При заболеваниях глаз применяют бактериоскопический метод — в соскобах с эпителия конъюнктивы выявляют внутриклеточные включения. Для выявления антигена хламидии в пораженных клетках применяют РИФ. При поражении мочеполового тракта может быть применен биологический метод, основанный на заражении исследуемым материалом (соскобы эпителия из уретры, влагалища) культуры клеток. Постановка РИФ, ИФА позволяют обнаружить антигены хламидии в исследуемом материале. Серологический метод - для обнаружения IgM против С. trachomatisпри диагностике пневмонии новорожденных. Лечение.антибиотики (азитромицин из группы макролидов), иммуномодуляторы, эубиотики. Профилактика. Только неспецифическая (лечение больных), соблюдение личной гигиены. Венерическая лимфогранулема — заболевание, передающееся половым путем, характеризуется поражением половых органов и регионарных лимфоузлов. Механизм заражения — контактный, путь передачи — половой. Иммунитет: стойкий, клеточный и гуморальный иммунитет. 79
Диагностика:Материал для исследования - гной, биоптат из пораженных лимфоузлов, сыворотка крови. Бактериоскопический метод, биологический (культивирование в желточном мешке куриного эмбриона), серологический (РСК с парными сыворотками положительна) и аллергологический (внутрикожная проба с аллергеном хламидии) методы. Лечение.Антибиотики — макролиды и тетрациклины. Профилактика: Неспецифическая. С. pneumoniae - возбудитель респираторного хламидиоза, вызывает острые и хронические бронхиты и пневмонии. Антропоноз. Заражение – воздушно-капельным путем. Попадают в легкие через верхние дыхательные пути. Вызывают воспаление. Диагностика: постановка РСК для обнаружения специфических антител (серологический метод). При первичном заражении учитывают обнаружение IgM. Применяют также РИФ для обнаружения хламидийного антигена и ПЦР. Лечение: Проводят с помощью антибиотиков (тетрациклины и макролиды). Профилактика:Неспецифическая. С. psittaci - возбудитель орнитоза — острого инфекционного заболевания, которое характеризуется поражением легких, нервной системы и паренхиматозных органов (печени, селезенки) и интоксикацией. Зооантропоноз. Источники инфекции – птицы. Механизм заражения – аэрогенный, путь передачи – воздушно- капельный. Возбудитель – через слиз. оболочки дыхат. путей, в эпителий бронхов, альвеол, размножается, воспаление. Диагностика:Материал для исследования - кровь, мокрота больного, сыворотка крови для серологического исследования. Применяют биологический метод — культивирование хламидий в желточном мешке куриного эмбриона, в культуре клеток. Серологический метод. Применяют РСК, РПГА, ИФА, используя парные сыворотки крови больного. Внутрикожная аллергическая проба с орнитином. Лечение: антибиотики (тетрациклины, макролиды). 107. Патогенные грибы
Патогенные и потенциально-патогенные грибы вызывают у человека заболевания, называемые микозами. Микозы в настоящее время широко распространены и составляют существенную часть инфекционной патологии человека. В зависимости от локализации поражений и вида возбудителя различают несколько групп микозов.
1. Кератомикозы (протекают с поражением волос и рогового слоя кожи):
-
разноцветный лишай (малассезиаз);
-
черный лишай (кладоспориоз) и др.
2.Эпидермомикозы (дерматофитии, дерматомикозы) - группа наиболее распространенных микозов, при которых поражается эпидермис, волосы, ногти:
-
эпидермофития (паховая или стоп);
-
рубромикоз;
-
трихофития (поверхностная, гладкой кожи головы, хроническая трихофития ногтей, на-гкоительно-инфильтративная, фавус и другие формы).
-
микроспория.
3. Субкутанные (подножные) микозы (поражаются кожа, подкожная клетчатка, фасции, кости):
-
споротрихоз;
-
хромомикоз;
-
мадуромикоз.
4. Микозы, вызванные потенциально-патогенными грибами (оппортунистические микозы):
-
кандидоз (поверхностный - с поражением слизистых оболочек, кожи, ногтей; висцеральный - внутренних органов; генерализоианиыйхронический - кандидасепсис);
-
аспергилзёз;
-
мукороз и др.
5. Глубокие микозы (поражаются любые органы и ткани):
-
гистоплазмоз;
-
криптококкиз;
-
кокцидиоидный микоз;
-
бластомикозы и др.
Возбудители кандидоза Кандидоз вызывают грибы рода Candida, чаще С. albicans - относительно крупные микроорганизмы округлой иди овальной формы (1,5-10,0 мкм). Образуют мицелий (вытянутые в цепочку удлинённые клетки, каждая из которых имеет собственную оболочку), бластоспоры (клетки, отпочковывающиеся от материнской при размножении), хламидоспоры (характерные для С. albicans споры с плотной двойной оболочкой). На простых средах растут плохо; их культивируют на среде Сабуро, Кандида-агаре и других специальных средах, где они через 2-5 дней образуют характерные колонии (чаще гладкие, напоминающие капли сметаны, реже - морщинистые). Биохимические свойства учитываются при идентификации и дифференциации возбудителя. Антигенная структура сложная. Патогенные свойства проявляются в способности к адгезии к клеткам организма, инвазивному росту в его тканях, аллергизации и токсическом действии на организм. Их связывают с наличием У гриба ферментов (плазмокоагулаза, протеиназа и др,. У токсинов, а также некоторых структур клетки (липидных, полисахаридных).
Грибы Candida являются обычными представителями микрофлоры человека и часто встречаются в небольшом количестве. У здоровых людей на слизистых оболочках.
Заболевание возникает как эндогенная или экзогенная, острая или хроническая инфекция. Кандидоз развивается, как правило, на фоне значительного снижения защитных сил организма (в результате радиоактивного облучения, воздействия некоторых химических факторов, длительного применения антибиотиков, кортикостероидных гормонов, на фоне длительно протекающих инфекций (как вторичная инфекция), при опухолях, сахарном диабете, ВИЧ-инфекции и др.). Часто встречается кандидоз слизистых оболочек (кандидоз полости рта, кандидозный вульвовагинит), кандидоз кожи (рук, крупных складок кожи), реже - бронхолегочный кандидоз. При резком снижении резистентности возможно развитие кандидасепсиса. В составе микробных ассоциаций грибы могут отягощать течение других заболеваний, способствовать их хронизации и затруднять лечение.
Микробиологическая диагностика основана на обнаружении грибов Candida при микроскопическом или микологическом иследовании (с обязательным учетом их количества и динамики обсемененности; иногда определяют также признаки патогенности выделенных культур): подтверждает диагноз обнаружение возбудителя в таких субстратах, как кровь, ликвор, моча, пунктат плевральной полости и т. п., а также обнаружение инвазивного роста (псевдомицелиальной формы) в биоптатах. Используют методы выявления в сыворотке крови антигенов гриба и антител к нему (в РСК, РА, ИФА, иммуноэлектрофорезе) и методы аллергодиагностики (кожно-аллергическая проба). Специфическое лечение включает:
-
устранение причины иммунодефицитного состояния;
-
назначение противогрибковых препаратов - полиенов (леворин, нистатин, амфотерицин В, амфоглюкамин, микогептин, флуконазол, итраконазол, натамицин, кетоконазол), а также клотримазола, низорала (кетоконазола), декамина;
-
применение иммуностимуляторов;
-
десенсибилизирующую терапию;
-
витаминотерапию. Специфическая профилактика не разработана
108.Малярия. тип Apicomplexa, класс Sporozoa, отряд Eucoccidiida, подотряд Haemosporinaи виды: Plasmodiumvivax, Plasmodiumovale, Plasmodiummalariae, Plasmodiumfalciparum.. Характеристика возбудителя. Жизненный цикл плазмодиев происходит со сменой хозяев: в комаре рода Anopheles(окончательном хозяине) осуществляется половое размножение (образование спорозоидов), а в организме человека (промежуточном хозяине) происходит бесполое размножение — шизогония, при которой образуются мелкие клетки — мерозоиты. После укуса спорозоиты из слюнных желез комара попадают в кровь и далее в гепатоциты, где совершается первый этап размножения — тканевая шизогония. При этом в гепатоцитах спорозоит переходит в стадию тканевого шизонта (делящаяся клетка). Тканевой шизонт делится с образованием тканевых мерозоитов, поступающих в кровь. Мерозоиты проникают в эритроциты, в которых совершается несколько циклов шизогонии. Из мерозоита в эритроците развиваются трофозоиты — растущие формы паразита: кольцевидный трофозоит юный, полувзрослый, взрослый трофозоит. Взрослый трофозоит превращается в многоядерный шизонт. В эритроцитах мерозоиты дают также начало образованию половых незрелых форм — мужских и женских гамет (гамонтов), которые способны инфицировать комаров при кровососании больного малярией. P. vivax— возбудитель трехдневной малярии. В эритроците, при окраске мазка из крови по Романовскому—Гимзе, трофозоит имеет форму кольца — крупная вакуоль в центре с голубой цитоплазмой с рубиново-красным ядром. P. malariae— возбудитель четырехдневной малярии. В эритроците выявляется один трофозоит в стадии кольца. P.falciparum — возбудитель тропической малярии, наличие юных форм паразита в виде мелких колец в эритроците. P. ovate— возбудитель трехдневной малярии, паразит в стадии кольца в эритроците имеет более крупное ядро, чем P. vivax. Эпидемиология: источник - человек. Механизм заражения – трансмиссивный, через укус комара. Патогенез и клиника:Инкубационный период от недели до года. Клинические проявления обусловлены эритроцитарной шизогонией. Малярии свойственно приступообразное течение: озноб с сильной головной болью сменяется подъемом температуры до 40С, после чего происходит быстрое снижение температуры с обильным потоотделением и выраженной слабостью. Малярийный приступ вызван выбросом пирогенных веществ из разрушенных эритроцитов. Приступы приводят к поражению печени, селезенки и почек. Иммунитет:нестойкий видоспецифический, стадиоспецифический, нестерильный иммунитет. Микробиологическая диагностика основана на микроскопическом исследовании препаратов крови, окрашенных по Романовскому—Гимзе и обнаружении различных форм возбудителя (красное ядро, голубая цитоплазма). Для обнаружения ДНК паразита в крови используют ДНК-гибридизацию и ПЦР В серологическом методе применяют РИФ, РПГА, ИФА. Лечение: Противомалярийные препараты (хинин, мефлохин, хлорохин). Различают препараты шизонтоцидного, гамонтотропного и спорозоитотропного действия. Профилактика:лечение больных малярией и паразитоносителей, уничтожение переносчиков возбудителя — комаров. Разрабатываются вакцины на основе антигенов, полученных генно-инженерным методом (антиспорозоитная антимерозоитная, антигамонтная).
109.Токсоклазма. Возбудитель — Toxoplasmagondii, относится к типу Apicomplexa, классу Sporozoa, отряду Eucoccidiida. Характеристика возбудителя. Toxoplasmagondii — облигатный внутриклеточный паразит. В жизненном цикле токсоплазм различают несколько морфологических форм: ооцисты, псевдоцисты, цисты, тахизоиты. Ооцисты формируются в результате полового размножения паразита в клетках слизистой оболочки кишечника кошки— окончательных хозяев токсоплазм: разнополые гаметоциты сливаются с образованием ооцисты. Ооцисты выделяются с фекалиями кошки. Попав в кишечник человека, они освобождают спорозоиты, которые распространяются по лимфатическим сосудам, размножаются внутриклеточно бесполым путем. Размножившиеся паразиты (тахизоиты) внедряются затем в другие клетки. Они обнаруживаются при острой стадии инфекции. Тахизоиты имеют характерную форму апельсиновой дольк, при окраске по Романовскому—Гимзе цитоплазма голубого цвета, а ядро — рубиново-красного. Псевдоцисты не имеют оболочки; они образуются в пораженных клетках, макрофагах. Цисты образуются внутри клеток хозяина. Они имеют плотную оболочку. Культивирование: в куриных эмбрионах и на культурах тканей, а также путем заражения мышей и других животных. Резистентность:Ооцисты могут в течение года сохранять жизнеспособность в окружающей среде. Токсоплазмы быстро погибают при выс. температуре. Эпидемиология. Источники инвазии виды домашних и диких млекопитающих, птицы. Заражение человека происходит алиментарным путем в результате употребления в пищу термически слабо обработанных продуктов, содержащих в псевдоцистах и цистах трофозоиты паразита. Патогенез и клиника.Токсоплазмы, проникшие в организм, достигают с током лимфы регионарных лимфоузлов, размножаются в них (тахизоиты), проникают в кровь, разносятся по организму, попадая в клетки ретикулоэндотелиальной системы всех внутренних органов, где образуют псевдоцисты и цисты. Токсоплазмы поражают нервные клетки, печень, почки, легкие, сердце, мышцы, глаза. Клиническая картина разнообразна: от умеренной лимфоаденопатии до лихорадки, сыпи, гепатоспленомегалии, фарингита, менингоэнцефалита, пневмонии и др. Иммунитет: клеточный и гуморальный иммунитет. Развивается ГЗТ. Микробиологическая диагностика: Проводится микроскопия мазка (из биоптатов крови, ликвора, пунктатов лимфоузлов), окрашенного по Романовскому—Гимзе. Реже применяется биологический метод: мыши погибают через 7—10 дней после парентерального введения им инфицированного материала (крови, ликвора) больных людей. Возможно культивирование токсоплазм на куриных эмбрионах. 86
Основным в диагностике токсоплазмоза является серологический метод: выявление IgM-антител свидетельствует о ранних сроках заболевания. IgG-антитела достигают максимума на 4—8й неделе болезни. Применяются РИФ, РИГА, РСК. Используют также аллергический метод — внутрикожную пробу с токсоплазмином, которая положительна с 4-й недели заболевания и далее в течение многих лет. Лечение:комбинация пириметамина с сульфаниламидами. Профилактика: неспецифическая - гигиенические требования (мытье рук перед едой; термическая обработка мяса.
110.Вирусы. Вирусология. К ним можно отнести следующие:
1. Эмпирических знаний ( до изобретения микроскопов и их применения для изучения микромира).
Дж.Фракасторо (1546г.) предположил живую природу агентов инфекционных заболеваний- contagium vivum.
2. Морфологический период занял около двухсот лет.
Антони ван Левенгук в 1675г. впервые описал простейших, в 1683г.- основные формы бактерий. Несовершенство приборов ( максимальное увеличение микроскопов X300) и методов изучения микромира не способствовало быстрому накоплению научных знаний о микроорганизмах. 3. Физиологический период (с 1875г.)- эпоха Л.Пастера и Р.Коха. Л.Пастер- изучение микробиологических основ процессов брожения и гниения, развитие промышленной микробиологии, выяснение роли микроорганизмов в кругообороте веществ в природе, открытие анаэробныхмикроорганизмов, разработка принципов асептики,методов стерилизации,ослабления (аттенуации) вирулентности и получения вакцин (вакцинных штаммов).Р.Кох- метод выделения чистых культур на твердых питательных средах, способы окраски бактерий анилиновыми красителями, открытие возбудителей сибирской язвы, холеры (запятой Коха), туберкулеза(палочки Коха),совершенствованиетехники микроскопии. Экспериментальное обоснование критериев Хенле, известные как постулаты (триада) Хенле- Коха.
4. Иммунологический период.
И.И.Мечников- “поэт микробиологии” по образному определению Эмиля Ру. Он создал новую эпоху в микробиологии - учение о невосприимчивости (иммунитете), разработав теорию фагоцитоза и обосновав клеточную теорию иммунитета.
Одновременно накапливались данные о выработке в организме антител против бактерий и их токсинов,позволившие П.Эрлиху разработать гуморальную теорию иммунитета. В последующей многолетней и плодотворной дискуссии между сторонниками фагоцитарной и гуморальной теорий были раскрыты многие механизмы иммунитета и родилась наука иммунология.
В дальнейшем было установлено, что наследственный и приобретенный иммунитет зависит от согласованной деятельности пяти основных систем: макрофагов, комплемента, Т- и В- лимфоцитов, интерферонов, главной системы гистосовместимости, обеспечивающих различные формы иммунного ответа. И.И.Мечникову и П.Эрлиху в 1908г. была присуждена Нобелевская премия.
12 февраля 1892г. на заседании Российской академии наук Д.И.Ивановский сообщил, что возбудителем мозаичной болезни табака является фильтрующийся вирус. Эту дату можно считать днем рождения вирусологии, а Д.И.Ивановского- ее основоположником. Впоследствии оказалось, что вирусы вызывают заболевания не только растений, но и человека, животных и даже бактерий. Однако только после установления природы гена и генетического кода вирусы были отнесены к живой природе.
5. Следующим важным этапом в развитии микробиологии стало открытие антибиотиков. В 1929г. А.Флеминг открыл пенициллин и началась эра антибиотикотерапии, приведшая к революционному прогрессу медицины. В дальнейшем выяснилось, что микробы приспосабливаются к антибиотикам, а изучение механизмов лекарственной устойчивости привело к открытию второго- внехромосомного (плазмидного) генома бактерий.
Изучение плазмид показало, что они представляют собой еще более просто устроенные организмы, чем вирусы, и в отличии от бактериофагов не вредят бактериям, а наделяют их дополнительными биологическими свойствами. Открытие плазмид существенно дополнило представления о формах существования жизни и возможных путях ее эволюции.
-
Современный молекулярно- генетический этап развития микробиологии, вирусологии и иммунологии начался во второй половине 20 века в связи с достижениями генетики и молекулярной биологии, созданием электронного микроскопа. Впервые существование вируса доказал в 1892 году Ивановский. В результате наблюдений он высказал предположение, что болезнь табака, под названием мозаичной, представляет собой не одно, а два совершенно различных заболевания одного и того же растения: одно из них - рябуха, возбудителем которого является грибок, а другое неизвестного происхождения. Возбудитель мозаичной болезни табака не мог быть обнаружен в тканях больных растений с помощью микроскопа и не культивировался на искусственных питательных средах. Ивановский открыл вирусы - новую форму существования жизни. Своими исследованиями он заложил основы ряда научных направлений вирусологии: изучение природы вируса, цитопаталогических вирусных инфекций, фильтрующихся форм микроорганизмов, хронического и латентного вирусоносительства.
111. Вирусы имеют уникальный геном, так как содержат либо ДНК, либо РНК. Поэтому различают ДНК-содержащие и РНК-содержащие вирусы. Они обычно гаплоидны, т.е. имеют один набор генов. Геном вирусов представлен различными видами нуклеиновых кислот: двунитчатыми, однонитчатыми, линейными, кольцевыми, фрагментированными. Среди РНК- содержащих вирусов различают вирусы с положительным (плюс-нить РНК) геномом. Плюс-нить РНК этих вирусов выполняет наследственную функцию и функцию информационной РНК (иРНК). Имеются также РНК-содержащие вирусы с отрицатель-ным (минус-нить РНК) геномом. Минус-нить РНК этих вирусов выполняет только наследственную функцию. Вирусы — мельчайшие микробы, не имеющие клеточного строения, белоксинтезирующей системы, содержащие только ДНК или РНК. Относятся к царству Vira. Являясь облигатными внутриклеточными паразитами, вирусы размножаются в цитоплазме или ядре клетки. Они — автономные генетические структуры. Отличаются особым — разобщенным (дисъюнктивным) способом размножения (репродукции): в клетке отдельно синтезируются нуклеиновые кислоты вирусов и их белки, затем происходит их сборка в вирусные частицы. Сформированная вирусная частица называется вирионом. Морфологию вирусов изучают с помощью электронной микроскопии, так как их размеры малы (18-400 нм) и сравнимы с толщиной оболочки бактерий. Форма вирионов может быть различной: палочковидной (вирус табачной мозаики), пулевидной (вирус бешенства), сферической (вирусы полиомиелита, ВИЧ), нитевидной (филовирусы), в виде сперматозоида (многие бактериофаги). Различают просто устроенные и сложно устроенные вирусы. Простые, или безоболочечные, вирусы состоят из нуклеиновой кислоты и белковой оболочки, называемой капсидом. Капсид состоит из повторяющихся морфологических субъединиц — капсомеров. Нуклеиновая кислота и капсид взаимодействуют друг с другом, образуя нуклеокапсид. Сложные, или оболочечные, вирусы снаружи капсида окружены ли-попротеиновой оболочкой (суперкапсидом, или пеплосом). Эта оболочка является производной структурой от мембран вирус-инфицированной клетки. На оболочке вируса расположены гликопротеиновые шипы, или шипики (пепломеры). Под оболочкой некоторых вирусов находится матриксный М-белок. Тип симметрии. Капсид или нуклеокапсид могут иметь спиральный, икосаэдрический (кубический) или сложный тип симметрии. Икосаэдрическийтип симметрии обусловлен образованием изометрически полого тела из капсида, содержащего вирусную нуклеиновую кислоту (например, у вирусов гепатита А, герпеса, полиомиелита). Спиральныйтип симметрии обусловлен винтообразной структурой нуклеокапсида (например, у вируса гриппа). 112.Бактериофаги— вирусы бактерий, обладающие способностью специфически проникать в бактериальные клетки, репродуцироваться в них и вызывать их растворение (лизис). Взаимодействие фага с бактериальной клеткой. По механизму взаимодействия различают вирулентные и умеренные фаги. Вирулентные фаги, проникнув в бактериальную клетку, автономно репродуцируются в ней и вызывают лизис бактерий. Про-цесс взаимодействия вирулентного фага с бактерией протекает в виде нескольких стадий и весьма схож с процессом взаимодей-ствия вирусов человека и животных с клеткой хозяина. Однако для фагов, имеющих хвостовой отросток с сокращающимся чехлом, он имеет особенности. Эти фаги адсорбируются на поверхности бактериальной клетки с помощью фибрилл хвостового отростка. В результате активации фагового фермента АТФазы происходит сокращение чехла хвостового отростка и внедрение стержня в клетку. В процессе «прокалывания» клеточной стенки бактерии принимает участие фермент лизоцим, находящийся на конце хвостового отростка. Вслед за этим ДНК фага, содержащаяся в головке, проходит через полость хвостового стержня и активно впрыскивается в цитоплазму клетки. Остальные структурные элементы фага (капсид и отросток) остаются вне клетки. Под действием фагового лизоцима и внутриклеточного осмотического давления происходит разрушение клеточной стенки, выход фагового потомства в окружающую среду и лизис бактерии. Один литический цикл (от момента адсорбции фагов до их выхода из клетки) продолжается 30—40 мин. Процесс бактериофагии проходит несколько циклов, пока не будут лизированы все чувствительные к данному фагу бактерии.
Взаимодействие фагов с бактериальной клеткой характеризуется определенной степенью специфичности. По специфичности действия различают поливалентные фаги, способные взаимодействовать с родственными видами бактерий, моновалентные 15
фаги, взаимодействующие с бактериями определенного вида, и типовые фаги, взаимодействующие с отдельными вариантами (типами) данного вида бактерий. Умеренные фаги лизируют не все клетки в популяции, с частью из них они вступают в симбиоз, в результате чего ДНК фага встраивается в хромосому бактерии. В таком случае геномом фага называют профаг. Профаг, ставший частью хромосомы клетки, при ее размножении реплицируется синхронно с геном бактерии, не вызывая ее лизиса, и передается по наследству от клетки к клетке неограниченному числу потомков. Биологическое явление симбиоза микробной клетки с умеренным фагом (профагом) называется лизогенией, а культура бакте-рий, содержащая профаг, получила название лизогенной. Это название отражает способность профага самопроизвольно или под действием ряда физических и химических факторов исключаться из хромосомы клетки и переходить в цитоплазму, т. е. вести себя как вирулентный фаг, лизирующий бактерии. Лизогенные культуры по своим основным свойствам не отличаются от исходных, но они невосприимчивы к повторному заражению гомологичным или близкородственным фагом и, кроме того, приобретают дополнительные свойства, которые находятся под контролем генов профага. Изменение свойств мик-роорганизмов под влиянием профага получило название фаговой конверсии. Последняя имеет место у многих видов микроорганизмов и касается различных их свойств: культуральных, биохимических, токсигенных, антигенных, чувствительности к антибиотикам и др. Кроме того, переходя из интегрированного состояния в вирулентную форму, умеренный фаг может захватить часть хромосомы клетки и при лизисе последней перено-сит эту часть хромосомы в другую клетку. Если микробная клетка станет лизогенной, она приобретает новые свойства.
113. Признаки, используемые для классификации вирусов: 1) тип нуклеиновой кислоты – ДНК или РНК; 2) их структура (однонитевая, двунитевая, линейная, кольцевая, фрагментированная, нефрагментированная с повторяющимися и инвертированными последовательностями); 3) структура, размеры, тип симметрии, число капсомеров; 4) наличие или отсутствие внешней оболочки (суперкапсида); 5) антигенная структура; 6) феномены генетических взаимодействий; 7) круг восприимчивых хозяев; 8) географическое распространение; 9) внутриядерная или цитоплазматическая локализация; 10) чувствительность к эфиру и детергентам; 11) путь передачи инфекции. В альбоме!
114. Методы культивирования вирусов. Для культивирования вирусов используют культуры клеток, куриные эмбрионы и чувствительных лабораторных животных. Эти же методы используют и для культивирования риккетсий и хламидий — облигатных внутриклеточных бактерий, которые не растут на искусственных питательных средах. Культуры клеток. Культуры клеток готовят из тканей животных или человека. Культуры подразделяют на первичные (неперевиваемые), полуперевиваемые и перевиваемые. Приготовление первичной культуры клеток складывается из нескольких последовательных этапов: измельчения ткани, разъединения клеток путем трипсинизации, отмывания полученной однородной суспензии изолированных клеток от трипсина с последующим суспендированием клеток в питательной среде, обеспечивающей их рост, например в среде 199 с добавлением телячьей сыворотки крови. Перевиваемые культуры в отличие от первичных адаптированы к условиям, обеспечивающим им постоянное существование invitro, и сохраняются на протяжении нескольких десятков пассажей. Перевиваемые однослойные культуры клеток приготовляют из злокачественных и нормальных линий клеток, обладающих способностью длительно размножаться invitro в определенных условиях. К ним относятся злокачественные клетки HeLa, первоначально выделенные из карциномы шейки матки, Нер-3 (из лимфоидной карциномы), а также нормальные клетки ам-ниона человека, почек обезьяны и др. К полуперевиваемым культурам относятся диплоидные клетки человека. Они представляют собой клеточную систему, сохраняющую в процессе 50 пассажей (до года) диплоидный набор хромосом, типичный для соматических клеток используемой ткани. Диплоидные клетки человека не претерпевают злокачественного перерождения и этим выгодно отличаются от опу-холевых. О размножении (репродукции) вирусов в культуре клеток судят по цитопатическому действию (ЦПД), которое может быть обнаружено микроскопически и характеризуется морфологическими изменениями клеток. Характер ЦПД вирусов используют как для их обнаружения (индикации), так и для ориентировочной идентификации, т. е. определения их видовой принадлежности.
Один из методов индикации вирусов основан на способности поверхности клеток, в которых они репродуцируются, адсорби-ровать эритроциты — реакция гемадсорбции. Для ее постановки в культуру клеток, зараженных вирусами, добавляют взвесь 16
эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На по-верхности пораженных вирусами клеток остаются прилипшие эритроциты. Другой метод — реакция гемагглютинации (РГ). Применяется для обнаружения вирусов в культуральной жидкости культуры клеток либо хорионаллантоисной или амниотической жидкости куриного эмбриона. Количество вирусных частиц определяют методом титрования по ЦПД в культуре клеток. Для этого клетки культуры заражают десятикратным разведением вируса. После 6—7-дневной инкубации их просматривают на наличие ЦПД. За титр вируса при-нимают наибольшее разведение, которое вызывает ЦПД в 50 % зараженных культур. Титр вируса выражают количеством цитопатических доз. Более точным количественным методом учета отдельных вирусных частиц является метод бляшек. Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток. Куриные эмбрионы. Куриные эмбрионы по сравнениюс культурами клеток значительно реже бывают контаминированы вирусами и микоплазмами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздей-ствиям. Для получения чистых культур риккетсий, хламидий. и ряда вирусов в диагностических целях, а также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. О размножении упомянутых микроорганизмов судят по морфологическим изменениям, выявляемым после вскрытия эмбриона на его обо-лочках. О репродукции некоторых вирусов, например гриппа, оспы, можно судить по реакции гемагглютинации (РГА) с куриными или другими эритроцитами. К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие в нем большого количества белков и других соединений, затрудняющих последующую очистку риккетсий или вирусов при изготовлении различных препаратов. Лабораторные животные. Видовая чувствительность животных к определенному вирусу и их возраст определяют репродук-тивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки — к вирусам Коксаки). Преимущество данного метода перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре или эмбрионе. К его недостаткам относятся контаминация организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой линии данного вируса, что удлиняет сроки исследования.
115. . Реакция нейтрализации (PH)Это универсальная реакция служит эталоном при оценке других серологических реакций.Принцип ее состоит в том, что при взаимодействии антигена (вируса) с гомологичными антителами образуется комплекс антиген + антитело, в результате нейтрализуется инфекционность вируса. Индикатором свободного (не связавшегося с антителами) вируса является чувствительная к вирусу живая система: животные, куриные эмбрионы или культура клеток.
При постановке реакции в пробирке смешивают равные объемы вируса и сыворотки, смесь выдерживают при соответствующей температуре (4, 22 или 37 °С) в течение одного часа или 16—18 ч (зависит от вируса и условий опыта). Затем этой смесью заражают чувствительную к вирусу живую систему, наблюдают за состоянием живых объектов и через соответствующий срок учитывают результат нейтрализации вируса по отсутствию: 1) гибели, развития клинической картины болезни и патологических изменений в органах и тканях лабораторных животных; 2) гибели, патологических изменений в оболочках, тканях зародыша и отсутствию гемагглютининов в жидкостях полостей куриных эмбрионах; 3) цитопатического действия (ЦПД) или бляшкообразования в культуре клеток. [2] Так как для нейтрализации определенного количества вируса требуется определенное количество антител, а один из этих компонентов все еще неизвестен, то PH можно ставить в двух вариантах: 1) к разным дозам (разведениям) сыворотки (обычно в виде последовательных 2-кратных разведений) добавляют одинаковые дозы вируса (обычно 100—1000 ЕД50). В этом варианте определяют титр вируснейтрализующих антител в сыворотке, показателем которого служит разведение сыворотки, защищающее от действия вируса 50 % зараженных биологических систем;
2) к разным дозам (разведениям) вируса (обычно в виде последовательных 10-кратных разведений) добавляют одинаковые дозы сыворотки (обычно в разведениях 1 : 10 или 1 : 20). При постановке данного варианта PH кроме исследуемой (или специфической) сыворотки используют и нормальную (отрицательную) сыворотку. В этом случае определяют индекс нейтрализации (IN), который показывает, во сколько раз иммунная (специфическая) или исследуемая сыворотка снижает титр вируса по сравнению е нормальной сывороткой.
Достоинствами PH являются ее универсальность и высокая специфичность; недостатки — большая трудоемкость; необходимость строго соблюдать стерильность материалов, посуды и инструментов; высокая стоимость живых биологических систем; относительная длительность биопробы и необходимость проведения математических расчетов. [3]
