- •Физиология и патогенез
- •25 Рекомбинация
- •38 Неспецифические факторы защиты организма
- •Медиаторы иммунной системы.
- •Реакция непрямой или пассивной гемагглютинации (рпга)
- •Реакция преципитации (рп)
- •Реакция нейтрализации экзотоксина антитоксином (рн)
- •63.Реакция лизиса (рл)
- •2.Ферменты стрептококков:
- •85. Неспорообразующие анаэробыБактероиды (род Bacteroides)
- •2.Реакция торможения гемагглютинации (ртга)
- •3.Реакция непрямой гемагглютинации (рнга)
- •4.Реакция связывания комплемента (рск)
- •5.Реакция диффузионной преципитации в геле (рдп)
- •6.Реакция торможения гемадсорбции (ртгАд)
- •7.Реакция иммунофлуоресценции (риф)
25 Рекомбинация
Конъюгация бактерий состоит в переходе генетического материала (ДНК) из клетки-донора («мужской») в клетку-реципиент («женскую») при контакте клеток между собой. F-фактор располагается в цитоплазме в виде кольцевой двунитчатой молекулы ДНК, т. е. является плазмидой. Молекула F-фактора значительно меньше хромосомы и содержит гены, контролирующие процесс конъюгации, в том числе синтез F-пилей. При конъюгации F-пили соединяют «мужскую» и «женскую» клетки, обеспечивая переход ДНК через конъюгационный мостик или F-пили. Переносимая ДНК взаимодействует с ДНК реципиента — происходит гомологичная рекомбинация. Прерывая процесс конъ-югации бактерий, можно определять последовательность расположения генов в хромосоме. Иногда F-фактор может при выходе из хромосомы захватывать небольшую ее часть, образуя так называемый замещенный фактор — F'. Трансдукция — передача ДНК от бактерии-донора к бактерии-реципиенту при участии бактериофага. Различают неспецифическую (общую) трансдукцию, при которой возможен перенос любого фрагмента ДНК донора, и специфическую — перенос определенного фрагмента ДНК донора только в определенные участки ДНК реципиента. Неспецифическая трансдукция обусловлена включением ДНК донора в головку фага дополнительно к геному фага или вместо генома фага (дефектные фаги). Специфическая трансдукция обусловлена замещением некоторых генов фага генами хромосомы клетки-донора. Фаговая ДНК, несущая фрагменты хромосомы клетки-донора, включается в строго определенные участки хромосомы клетки-реципиента. Таким образом, привносятся новые гены и ДНК фага в виде профага репродуцируется вместе с хромосомой, т.е. этот процесс сопровождается лизоге-нией. Трансформация заключается в том, что ДНК, выделенная из бактерий в свободной растворимой форме, передается бактерии-реципиенту. При трансформации рекомбинация происходит, если ДНК бактерий родственны друг другу. В этом случае возможен обмен гомологичных участков собственной и проникшей извне ДНК.
26+22 вопрос(2 фото) Плазмиды бактерий, Плазмиды — внехромосомные мобильные генетические структуры бактерий, представляющие собой замкнутые кольца двунитчатой ДНК, способны автономно копироваться (реплицироваться) и существовать в цитоплазме клетки, поэтому в клетке может быть несколько копий плазмид. Плазмиды могут включаться (интегрировать) в хромосому и реплицироваться вместе с ней. Различают трансмиссивные и нетрансмиссивные плазмиды. Трансмиссивные (конъюгативные) плазмиды могут передаваться из одной бактерии в другую. Среди фенотипических признаков, сообщаемых бактериальной клетке плазмидами, можно выделить следующие: 1) устойчивость к антибиотикам; 2) образование колицинов; 3) продукция факторов патогенности; 4) способность к синтезу антибиотических веществ; 5) расщепление сложных органических веществ; 6) образование ферментов рестрикции и модификации. Они несут гены, не обязательные для клетки-хозяина, придают бактериям дополнительные свойства, которые в определенных условиях окружающей среды обеспечивают их временные преимущества по сравнению с бесплазмидными бакте-риями. Некоторые плазмиды находятся под строгим контролем. Или слабым контролем, Для характеристики плазмидных реплико-нов их принято разбивать на группы совместимости. Несовместимость плазмид связана с неспособностью двух плазмид стабильно сохраняться в одной и той же бактериальной клетке. Несовместимость свойственна тем плазмидам, которые обладают высоким сходством репликонов, поддержание которых в клетке регулируется одним и тем же механизмом. Некоторые плазмиды могут обратимо встраиваться в бактериальную хромосому и функционировать в виде единого репликона. Такие плазмиды называются интегративными или эписомами. У бактерий различных видов обнаружены R-плазмиды, несущие гены, ответственные за множественную устойчивость к лекарственным препаратам — антибиотикам, сульфаниламидам и др., F-плазмиды, или половой фактор бактерий, определяющий их способность к конъюгации и образованию половых пилей, Ent-плазмиды, детерминирующие продукцию энтеротоксина. Плазмиды могут определять вирулентность бактерий, например возбудителей чумы, столбняка, Плазмиды подвержены рекомбинациям, мутациям, могут быть элиминированы (удалены) из бактерий, широко используются в генетической инженерии для получения рекомбинантных штаммов.
28. Молекулярно-биологические методы, используемые в диагностике инфекционных болезней (ПЦР, рестрикционный анализ и др.). Полимеразная цепная реакция позволяет обнаружить микроб в исследуемом материале по наличию в нем ДНК микроба без выделения последнего в чистую культуру. Для проведения этой реакции из исследуемого материала выделяют ДНК. Обнаружение гена осуществляют его накоплением. Для этого необходимо иметь праймеры комплементарного З'-концам ДНК. исходного гена. Накопление (амплификация) -Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на 2 нити. Добавляют праймеры. Смесь ДНК и праймеров охлаждают. При этом праймеры, при наличии в смеси ДНК искомого гена, связываются с его комплементарными участками. Затем к смеси ДНК и праймера добавляют ДНК-полимеразу и нуклеотиды. Устанавливают температуру, оптимальную для функционирования ДНК-полимеразы. В этих условиях, в случае комплементарное™ ДНК гена и праймера, происходит присоединение нуклеотидов к З'-концам праймеров, в результате чего синтезируются две копии гена. После этого цикл повторяется снова, при этом количество ДНК гена будет увеличиваться каждый раз вдвое. Проводят реакцию в специальных приборах — амплификаторах. Рестрикционный анализ. Данный метод основан на применении ферментов, носящих название рестриктаз. Рестриктазы представляют собой эндонуклеазы, которые расщепляют молекулы ДНК, разрывая фосфатные связи не в произвольных местах, а в определенных последовательностях нуклеотидов. Особое значение для методов молекулярной генетики имеют рестриктазы, которые узнают последовательности, обладающие центральной симметрией и считывающиеся одинаково в обе стороны от оси симметрии. Точка разрыва ДНК может или совпадать с осью симметрии, или быть сдвинута относительно нее. Если выделенную из конкретного микроба ДНК обработать определенной рестриктазой, то это приведет к образованию строго определенного количества фрагментов ДНК фиксированного размера. Размер каждого типа фрагментов можно узнать с помощью электрофореза в агарозном геле: мелкие фрагменты перемещаются в геле быстрее, чем более крупные фрагменты, и длина их пробега больше. Гель окрашивают бромистым этидием и фотографируют в УФ-излучении. Таким образом можно получить рестрикционную карту определенного вида микробов. Сопоставляя карты рестрикции ДНК, выделенных из различных штаммов, можно определить их генетическое родство, выявить принадлежность к определенному виду или роду, а также обнаружить участки, подвергнутые мутациям. Этот метод используется также как начальный этап метода определения последовательности нуклеотидных пар (секвенирования) и метода молекулярной гибридизации. Метод молекулярной гибридизации.позволяет выявить степень сходства различных ДНК. Применяется при идентификации микробов для определения их точного таксономического положения.
Метод основан на способности двух цепочечной ДНК при повышенной температуре (90 °С) в щелочной среде денатурировать, т. е. расплетаться на две нити, а при понижении температуры на 10 °С вновь восстанавливать исходную двухцепочечную структуру. Метод требует наличия молекулярного зонда. Зондом называется одноцепочечная молекула нуклеиновой кислоты, меченная радиоактивными нуклидами, с которой сравнивают исследуемую ДНК. Для проведения молекулярной гибридизации исследуемую ДНК расплетают указанным выше способом, одну нить фиксируют на специальном фильтре, который затем помещают в раствор, содержащий радиоактивный зонд. Создаются условия, благоприятные для образования двойных спиралей. В случае наличия комплементарности между зондом и исследуемой ДНК, они образуют между собой двойную спираль. Риботипирование и опосредованная транскрипцией амплификация рибосомальной РНК. Последовательность нуклеотидных оснований в оперонах, кодирующих рРНК, отличается консервативностью, присущей каждомувиду бактерий. Эти опероны представлены на бактериальной хромосоме в нескольких копиях. Фрагменты ДНК, полученные после обработки ее рестриктазами, содержат последовательности генов рРНК, которые могут быть обнаружены методом молекулярной гибри-дизации с меченой рРНК соответствующего виды бактерий. Количество и локализация копий оперонов рРНК и рестрикционный состав сайтов как внутри рРНК-оперона, так и по его флангам варьируют у различных вида бактерий. На основе этого свойства построен метод риботипирования, который позволяет производить мониторинг выделенных штаммов и определение их вида. В настоящее время риботипирование проводится в автоматическом режиме в специальных приборах. Опосредованная транскрипцией амплификация рРНК используется для диагностики смешанных инфекций. Этот метод основан на обнаружении с помощью молекулярной гибридизации амплифицированных рРНК, специфичных для определенного вида бактерий. Исследование проводится в три этапа: 1. Амплификация пула рРНК на матрице выделенной из исследуемого материала ДНК при помощи ДНК-зависимой РНК-полимеразы. 2. Гибридизация накопленного пула рРНК с комплементарными видоспецифическим рРНК олигонуклеотидами, меченными флюорохромом или ферментами. 3. Определение продуктов гибридизации методами денситометрии, иммунофермент-ного анализа (ИФА). Реакция проводится в автоматическом режиме в установках, в которых одномоментное определение рРНК, принадлежащих различным видам бактерий, 29. Антибиотики — химиотерапевтические вещества, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной способностью угнетать и задерживать рост микроорганизмов, а также подавлять развитие злокачественных новообразований.. В основу главной классификации антибиотиков положено их химическое строение. Наиболее важными классами синтетических антибиотиков являются хинолоны и фторхинолоны (например, ципрофлоксацин), сульфаниламиды (сульфадиметоксин), имидазолы (метронидазол), нитрофураны (фурадонин, фурагин). По спектру действия антибиотики делят на пять групп в зависимости от того, на какие микроорганизмы они оказывают воз-действие. Кроме того, существуют противоопухолевые антибиотики, продуцентами которых также являются актиномицеты. Каждая из этих групп включает две подгруппы: антибиотики широкого и узкого спектра действия. К антибиотикам широкого спектра действия относятся аминогликозиды, тетрациклины и др.. В отдельные группы выделяют противотуберкулезные, противолепрозные, противосифилитические препараты. Противогрибковые антибиотики включают значительно меньшее число препаратов. Широким спектром действия обладает, например, амфотерицин В, эффективный при кандидозах, бластомикозах, аспергиллезах; в то же время нистатин, действующий на грибы рода Candida, является антибиотиком узкого спектра действия. Антипротозойные и антивирусные антибиотики насчитывают небольшое число препаратов. Противоопухолевые антибиотики представлены препаратами, обладающими цитотоксическим действием. Большинство из них применяют при многих видах опухолей, например митоми-цин С. В зависимости от механизма действия различают пять групп антибиотиков: 1. антибиотики, нарушающие синтез клеточной стенки( β-лактамы. они самой высокой избирательностью действия: они убивают бактерии и не оказывают влияния на клетки микроорганизма, так как последние не имеют главного компонента клеточной стенки бактерий — пептидогликана.); 2. антибиотики, нарушающие молекулярную организацию и синтез клеточных мембран. ( полимиксины, полиены)3. антибиотики, нарушающие синтез белка; это наиболее многочисленная группа препаратов. ( аминогликозиды, тетрациклины, макролиды, левомицетин, вызывающие нарушение синтеза белка на разных уровнях) 4. антибиотики — ингибиторы синтеза нуклеиновых кислот. ( хинолоны нарушают синтез ДНК, рифампицин — синтез РНК); 5. антибиотики, подавляющие синтез пуринов и аминокислот. (сульфаниламиды). Источники антибиотиков. Основными продуцентами природных антибиотиков являются микроорганизмы, которые, находясь в своей естественной среде (в основном, в почве), синтезируют антибиотики в качестве средства выживания в борьбе за существование. • Актиномицеты(особенно стрептомицеты) — ветвящиеся бактерии. (80 %). • Плесневые грибы— синтезируют природные бета-лактамы (грибы рода Cephalosporiumи Penicillium)Hфузидиевую кислоту. • Типичные бактерии— например, эубактерии, бациллы, псевдомонады — продуцируют бацитрацин, полимиксины и другие вещества, обладающие антибактериальным действием. Способы получения. Существует три основных способа получения антибиотиков: • биологическийсинтез (так получают природные антибиотики — натуральные продукты ферментации, когда в оптимальных условиях культивируют микробы-продуценты, которые выделяют антибиотики в процессе своей жизнедеятельности); • биосинтезс последующими химическими модификациями(так создают полусинтетические антибиотики). Сначала путем биосинтеза получают природный антибиотик, а затем его первоначальную молекулу видоизменяют путем химических модификаций, например присоединяют определенные радикалы, в результате чего улучшаются противомикробные и фарма-кологические характеристики препарата; • химическийсинтез (так получают синтетические аналоги природных антибиотиков, например хлорамфеникол/левомицетин). Наиболее частыми осложнениями антимикробной химиотерапии являются: Токсическое действие препаратов.. Побочное токсическое влияние может проявляться как нейротоксическое (например, гликопептиды и аминогликозиды оказывают ототоксическое действие, вплоть до полной потери слуха за счет воздействия на слуховой нерв); нефротоксическое (полиены, полипептиды, аминогликозиды, макролиды, гликопептиды, сульфаниламиды); общетоксическое (противогрибковые препараты — полиены, имидазолы); угнетение кроветворения (тетрациклины, сульфаниламиды, левомицетин/хлорамфеникол, который содержит нитробензен — супрессор функции.костного мозга); тератогенное [аминогликозиды, тетрациклины нарушают развитие костей, хрящей у плода и детей, формирование зубной эмали (коричневая окраска зубов) Эндотоксический шок (терапевтический). Это явление, которое возникает при лечении инфекций, вызванных грамотрицательными бактериями. Введение антибиотиков вызывает гибель и разрушение клеток и высвобождение больших количеств эндотоксина. Применение антимикробных химиопрепа-ратов оказывает на микробы не только прямое угнетающее или губительное воздействие, но также может привести к формированию атипичных форм микробов (например, к образованию L-форм бактерий или изменению других свойств микробов, что значительно затрудняет диагностику инфекционных заболеваний) и персистирующих форм микробов. 30.Антибиотикорезистентность — это устойчивость микробов к антимикробным химиопрепаратам. Бактерии следует считать резистентными, если они не обезвреживаются такими концентрациями препарата, которые реально создаются в макроорганизме. Резистентность может быть природной и приобретенной. Природная устойчивость. Некоторые виды микробов природно устойчивы к определенным семействам антибиотиков или в результате отсутствия соответствующей мишени. Приобретенная устойчивость. Приобретение резистентности — это биологическая закономерность, связанная с адаптацией микроорганизмов к условиям внешней среды. Она, хотя и в разной степени, справедлива для всех бактерий и всех анти-биотиков. К химиопрепаратам адаптируются не только бактерии, но и остальные микробы — от эукариотических форм (простейшие, грибы) до вирусов. Проблема формирования и распространения лекарственной резистентности микробов особенно значима для внутрибольничных инфекций, вызываемых так называемыми «госпитальными штаммами», принципов рациональной антибиотикотерапии (антимикробной химиотерапии): • Микробиологический принцип. • Фармакологический принцип. Учитывают особенности препарата — его фармакокинетику и фармакодинамику • Клинический принцип Эпидемиологический принцип.
31.Инфекция Термин инфекцияили синоним инфекционный процесс обозначает совокупность физиологических и патологических восста-новительно-приспособительных реакций, возникающих в восприимчивом макроорганизме при определенных условиях окру-жающей внешней среды в результате его взаимодействия с проникшими и размножающимися в нем патогенными или условно-патогенными бактериями, грибами и вирусами и направленных на поддержание постоянства внутренней среды макроорганизма. Возникновение, течение и исход инфекционного процесса определяются тремя группами факторов: 1) количественные и качественные характеристики микроба — возбудителя инфекционного процесса; 2) состояние макроорганизма, степень его восприимчивости к микробу; 3) действие физических, химических и биологических факторов окружающей микроб и макроорганизм внешней среды, которая и обуславливает 29
возможность установления контактов между представителями разных видов, общность территории обитания разных видов, Для инфекционного заболевания характерны определенные стадии развития: 1. Инкубационный период — время, которое проходит с момента заражения до начала клинических проявлений болезни. В зависимости от свойств возбудителя, иммунного статуса макроорганизма, характера взаимоотношений между макро- и микроорганизмом инкубационный период может колебаться от нескольких часов до нескольких месяцев и даже лет; 2. Продромальный период — время появления первых клинических симптомов общего характера, неспецифических для данного заболевания, например слабость, быстрая утомляемость, отсутствие аппетита и т. д.; 3. Период острых проявлений заболевания — разгар болезни. В это время проявляются типичные для данного заболевания симптомы: температурная кривая, высыпания, местные поражения и т. п.; 4. Период реконвалесценции — период угасания и исчезновения типичных симптомов и клинического выздоровления.
Не всегда клиническое выздоровление сопровождается освобождением макроорганизма от микроорганизмов. 32-33. Патогенность — видовой признак, передающийся по наследству, закрепленный в геноме микроорганизма, в процессе эволюции паразита, т. е. это генотипи-ческий признак, отражающий потенциальную возможность микроорганизма проникать в макроорганизм (инфективность) и размножаться в нем (инвазионность), вызывать комплекс патологических процессов, возникающих при заболевании. Фенотипическим признаком патогенного микроорганизма является его вирулентность, т.е. свойство штамма, которое проявляется в определенных условиях (при изменчивости микроорганизмов, изменении восприимчивости макроорганизма и т.д.). Вирулентность можно повышать, понижать, измерять, т.е. она является мерой патогенности. Количественные показатели вирулентности могут быть выражены в DLM (минимальная летальная доза), DL« (доза, вызывающая гибель 50 % экспериментальных животных) К факторам патогенности относят способность микроорганизмов прикрепляться к клеткам (адгезия), размещаться на их поверхности (колонизация), проникать в клетки( Пенетрация ),попадание в подлижащие ткани (инвазия)и противостоять факторам защиты организма (агрессия). За единицу измерения вирулентности условно приняты летальная и инфицирующая дозы. Минимальная смертельная доза (DLM) – это наименьшее количество живых микробов или их токсинов, вызывающее за определенный срок гибель большинства животных одного вида, взятых в опыт. Поскольку индивидуальная чувствительность животных к патогенному микробу (токсину) различна, то была введено понятие безусловно смертельная доза (DCL) - это наименьшее количество микроорганизмов, вызывающая гибель 100% зараженных животных. Наиболее точная единица вирулентности средняя летальная доза (LD50) – это наименьшее количество микроорганизмов (токсинов), вызывающая гибель половины животных в опыте. утрачивают свою токсичность, но сохраняют иммуногенное свойство. Такие токсины получили название анатоксины и применяются для профилактики заболевания столбняка, гангрены, ботулизма, дифтерии, а также используются в виде антигенов для иммунизации животных с целью получения анатоксических сывороток. Эндотоксины стимулируют синтез интерферонов, активируют систему комплемента по классическому пути, обладают аллергическими свойствами. 33. Токсины бактерий, их природа, свойства, получение.
Токины бактерий – продукты метаболизма, оказывающие непосредственное токсическое воздействие на специфические клетки макроорганизма, либо опосредованно вызывающие развитие симптомов интоксикации в результате индукции ими образования биологически активных веществ.
По физико-химической структуре и биологическим свойствам токсины бактерий делятся на 2 группы: белковые токсины и эндотоксины(белковолипополисахприды.
По степени связи с бактериальной клеткой белковые бактериальные токсины подразделяют на три класса:
Класс А– секретируемые во внешнюю (дифтерийный гистотоксин, дермонекротксин, холероген холерного вибриона);
Класс В– токсины, частично связанные с микробной клеткой и частично секретируемые в окружающую среду (столбнячный тетаноспазмин, ботулинистический нейротоксин);
Класс С– токсины, связанные с микробной клеткой и попадающие в окружающую клетку среду лишь в результате ее гибели (дизинтерийный шигатоксин).
По строению белковые токсины делятся на простые и сложные. Простые токсины представляют собой активную бифункциональную В-А структуру. Часть В необладает токсичностью. Это природный анатоксн, который выполняет транспортную функцию, образуя канал в цитоплазматической мембране клетки и обусловливает проникновение токсической группы А или активатора в цитоплазму клетки. Сложные токсины представляют собой сложную бифункциональную структуру, состоящую из одной или нескольких В-субъединиц, соединенных с А-субъединицей, как, например холерный энтеротоксин, у которого субъединица А окружена пятью абордажными В-субъединицами.
По механизму действия токсины делят на 5 групп:
-
токсины, повреждающие клеточные мембраны. Такие повреждения вызывают не только лизис клеток, но и способствуют распространению бактерий в макроорганизме (альфа-токсинCl.Perfringens, гемолизинE.coli, пневмолизинS.pneumoniae, О-стрептолизинS.pyogenes, альфа-токсин S.aureus;
-
токсины, ингибирующие синтез белка(дифтерийный гистотоксин, дизентерийный шигатоксин). Данные токсины нарушают синтез белка не только в эпителиоцитах, но и в других клетках, что приводит к развитию гемолитического уремического синдрома;
-
токсины, активирующие пути метаболизма, контролируемые вторичными посредниками мессенджерами(термолабильный и термостабильный токсиныE.coli, отечный факторB.Anthracis, коклюшный и дерматонекротический токсиныB.Pertussis, холерный энтеротоксин –нарушает всасывание ионов натрия, калия и воды);
-
протеазы(ботулинический и столбнячный нейротокины, сибиреязвенный летальный фактор). Ботулотоксин связывается с рецепторами на поверхности пресинаптической мембраны двигательных нейронов переферической нервной системы и вызывает протеолиз белков в нейронах. Это приводит к ингибированию секреции ацетилхолина, что препятствует мышечным сокращениям и проявляется развитием вялых параличей переферических нервов
-
активаторы иммунного ответа(токсин синдрома токсического шока, энтеротоксины и эксфолиативные токсиныS.aureus, пирогенные экзотоксиныS.pyogenes). Например, токсин синдрома токсического шока ведет к массивной пролиферации Т-клеток, сопровождающейся образованием большого количества лимфоцитарных и моноцитарных цитокинов.
Способ определения токсичности среды включает определение показателей роста тест-культур в контроле и опыте. В качестве тест-культур используют микромицеты и предварительно определяют показатель степени угнетения роста тест-культур в опыте по отношению к контролю, % Применение тест-культур все более вытесняет химический анализ, предусматривающий выявление в среде химических токсикантов с применением реагентов, специфичных для обнаружения конкретных химических веществ и соединений. Для выявления в исследуемой среде всех токсикантов химический анализ требует применения большого числа реагентов, что экономически не выгодно, поэтому реально химический анализ не позволяет оценить интегральную токсичность среды, определяемую наличием в среде всех токсикантов с учетом синергетического или антагонистического эффектов, выражающихся в усилении или ослаблении суммарного воздействия токсикантов на человека. 36. Эпидемиологический процесс - совокупность следующих друг за другом случаев инфекционной болезни, непрерывность и закономерность которых поддерживается наличием источника инфекции, факторов передачи и восприимчивостью населения.
А. Источник инфекции. Для изъятия этого звена проводят выявление больных и их изоляцию (в инфекционном стационаре или на дому), а также выявление и санацию носителей возбудителя инфекции.
Б. Механизм передачи. Для изъятия этого звена подвергают микробной деконтаминации факторы передачи (или пресекают контакт с ними), что приводит к перекрытию путей передачи инфекционного начала (т.е. возбудителя инфекции). В ряде случаев возбудитель инфекции может очень долго сохраняться в объектах окружающей среды, теряя непосредственную связь с источником их заражения. В этом случае эти объекты окружающей среды вполне справедливо рассматриваются и как источник инфекции.
В. Восприимчивый организм. Для изъятия этого звена проводят массовую или индивидуальную вакцинацию, в результате которой или отдельный человеческий организм или большие группы людей становятся невосприимчивыми к конкретному микробу. Эпидемия — это значительное превышение нормальной частоты случаев какого-либо заболевания или патологического состояния среди населения, а также резкий подъем частоты определенного заболевания с последующим снижением в относительно короткий период времени. Пандемия (глобальная эпидемия) — перешедшая границы государства и охватившая большое число стран эпидемия. 1.Спорадия (спорадическая заболеваемость). Возникают единичные, не связанные между собой случаи инфекционных заболеваний
2.Эндемия — групповая вспышка. Возникает, как правило, в организованном коллективе, в условиях постоянного и тесного общения людей. Заболевание развивается из одного, общего источника инфицирования и за короткое время охватывает до 10 и более человек
Летальность оценивается отношением числа умерших от какого-либо заболевания к числу больных данным заболеванием, выражается в процентах. . Смертность, в отличие от летальности, определяется отношением числа умерших от данной патологии к средней численности населения. Показатель смертности рассчитывается на 1000, 10000 или 100000 населения. 37. По природе возбудителя:
– бактериозы;
– пищевые интоксикации — отравления микробными экзотоксинами, накопившимися в пищевых продуктах) — бактериальными (ботулизм, стафилококковая интоксикация) или грибковыми (микотоксикозы);
– вирусные болезни;
– прионные болезни;
– микозы (грибковые болезни);
– инвазии: паразитозы (протозоозы и гельминтозы);
– заболевания, вызванные членистоногими эктопаразитами: клещами (чесотка), вшами (головной и лобковый педикулез).

37.
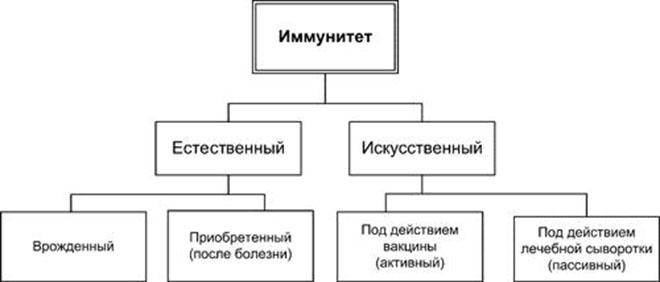
Под иммунитетом понимают совокупность
биологических явлений, направленных
на сохранение постоянства внутренней
среды и защиту организма от инфекционных
и других генетически чужеродных для
него агентов.
(сфоткать в методичке!)