
- •1. Основные понятия аналитической химии
- •2. Методы качественного анализа
- •3. Классификация катионов в качественном кислотно-основном
- •4. Методы количественного анализа
- •4.3. Титриметрический метод анализа
- •4.4 Кислотно-основное титрование.
- •5. Окислительно-восстановительное титрование .
- •6. Физико - химические методы анализа.
- •1. Основные понятия аналитической химии
- •2. Методы качественного анализа
- •2.1 .Классификация методов по количеству вещества
- •2.2. Способы выполнения аналитических реакций
- •2.3 . Техника выполнения реакций
- •2.4. Условия выполнения реакций
- •2.5. Дробный и систематический анализ
- •3. Классификация катионов в качественном
- •3.1. Методика выполнения основных операций
- •3.2. Деление катионов на аналитические группы по кислотно-щелочной классификации
- •Лабораторная работа № 1 способы проведения аналитических реакций в растворе
- •Лабораторная работа №2. Реакции и анализ первой аналитической группы катионов
- •Реакции и анализ второй аналитической группы катионов
- •1. Предварительные испытания
- •2. Отделение катионов I аналитической группы от II:
- •6. Обнаружение ионов
- •7. Обнаружение иона стронция
- •Реакции и анализ третьей аналитической группы катионов
- •1. Общая характеристика катионов третьей группы
- •3. Опыт 2 . Обнаружение иона
- •4. Методы количественного анализа
- •4.3. Титриметрический метод анализа
- •4.3.1. Классификация методов титриметрического анализа
- •4.3.2. Стандартизация раствора титранта
- •4.3.3. Кривые титрования
- •4.3.4. Принцип эквивалентности
- •4.3.5. Расчет результата прямого титрования при разных способах выражения концентрации раствора
- •4.3.6. Расчет результата в методе обратного титрования
- •4.4 Кислотно-основное титрование.
- •4.4.1.Общая характеристика метода
- •4.4.2 Индикаторы в методе кислотно-основного титрования
- •4.4.3. Кривые титрования
- •4.4.4 Кривая титрования сильной кислоты сильным основанием ( и наоборот)
- •Расчет кривой титрования 10,0 мл 0,1 м hCl раствором 0,1 м NaOh
- •Титрование сильного основания сильной кислотой
- •Расчет кривой титрования 10,0 мл 0,1 м NaOh раствором 0,1 м hCl
- •Расчет кривой титрования 10,0 мл 0,1 м сh3cooh раствором 0,1 м NaOh
- •4.4.5. Техника выполнения работ в титриметрических методах анализа
- •Общие правила работы с мерной посудой .
- •3. Стандартизация раствора хлороводородной кислоты по тетраборату натрия.
- •4. Определение содержания щёлочи в растворе
- •Контрольные вопросы :
- •Задачи для самостоятельного решения
- •Определение процентного содержания аммиака в солях аммония методом обратного титрования
- •5. Окислительно-восстановительное титрование .
- •5.1.Классификация методов окислительно-восстановительного титрования
- •5.2. Индикаторы окислительно-восстановительного титрования
- •5.3.Перманганатометрия
- •1. Приготовление раствора титранта кМnO4
- •2. Приготовление раствора первичного стандарта
- •3. Стандартизация раствора титранта кМnO4
- •4. Вычисления
- •5) Определение железа (II)
- •6. Физико - химические методы анализа.
- •Лабораторная работа № 10 Определение концентрации ионов меди в растворе
- •4. Определение меди в исследуемом растворе
4.3.5. Расчет результата прямого титрования при разных способах выражения концентрации раствора
Если известна молярная концентрация щелочи с (NaOH) и объем раствора V(NaOH), израсходованный на титрование кислоты, то количество вещества щелочи, затраченное на реакцию, будет равно:
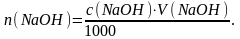 (4.4)
(4.4)
В точке эквивалентности количество вещества щелочи, израсходованное на реакцию, будет точно равно количеству вещества кислоты в анализируемом растворе:
n(NaOH)=n(HCL) (4.5)
Подставляем уравнение (4.5) в (4.4)

 (4.6)
(4.6)
Количество вещества эквивалента кислоты, находящееся в анализируемом растворе, можно также представить соотношением:
 (4.7)
(4.7)
При подстановке уравнения (4.6) и (4.7) в (4.5) получается очень важное уравнение
c (NaOH) · V(NaOH) = c(HCl) · V(HCl). (4.8)
Если известен объем анализируемого раствора, по уравнению (4.8) можно рассчитать его концентрацию. Уравнения типа (4.6) часто используется также при расчете различных ситуаций, возникающих при разбавлении растворов.
Так как количество вещества при разбавлении раствора не изменяется, то очевидно:
c1V1 = c2V2, (4.9)
где c1 и V1 – концентрация и объем раствора до разбавления; c2 и V2 – концентрация и и объем раствора после разбавления.
Как видно, уравнение (4.9) позволяет рассчитывать любую из четырех величин, если три другие известны.
Масса кислоты в анализируемом растворе m(HCl) рассчитывается по соотношению
 (4.10)
(4.10)
где M(HCl) – молярная масса эквивалента HCl.
Если, например, c(NaOH) = 0,1048 моль/л; V(NaOH) = 22,52 мл, то

Если титруется не весь раствор щелочи, а аликвота, результат анализа рассчитывается по уравнению
 (4.11)
(4.11)
где Vk и V п – объем мерной колбы и пипетки соответственно.
Широко распространен в практике способ расчета результатов анализа с помощью условного титра рабочего раствора или титра по определяемому веществу.
Он показывает массу (г) определяемого вещества, которая соответ-ствует 1мл рабочего раствора. В данном примере 1мл 0,1048М NaOH соответствует 0,003821г. HCI, т.е Т (NaOH/ HCI)= 0,003821.
Тогда результат анализа:
m(HCI) = Т (NaOH/ HCI) · V(NaOH) =0,003821· 22,52=0,08605г HCI.
Чтобы найти связь между разными способами выражения концентрацией, приравняем массу определяемого вещества, рассчитанную при использовании разных способов.
Пусть, например, известна молярная концентрация эквивалента NaOH, то рассчитать Т (NaOH/ HCI) можно следующим образом:

Отсюда
 (4.12)
(4.12)
Аналогично рассчитывается результат при титровании по методу замещения.
Примеры решения задач
Для вычисления эквивалентной массы соединения, участвующего в кислотно-основной реакции, рассчитывают, какая масса данного вещества соответствует одному молю атомов водорода (эквиваленту водорода).
Пример 4. Из 2,5000г Na2СОз приготовлено 500см3 раствора. Вычислить: а) Т (Na2CО3); б) молярную концентрацию; в) нормальную концентрацию.
Решение. Для вычисления титра (Т) нужно найти массу вещества в граммах, содержащегося в 1см3 раствора:
Т(Na2CО3)=m(Na2CО3)/V=2,500/500=0,0050г/см3.
Молярную концентрацию можно вычислить по известному титру:
СМ (Na2CО3)= Т(Na2CО3)•1000/М (Na2CО3)=0,005•1000/106=0,04717моль/л
Для вычисления нормальной концентрации раствора нужно найти эквивалентную массу Na2CО3:
Эм(Na2CО3)=М(1/2Na2CО3)=106/2=53г/моль.
Затем, используя величину титра, определяем нормальную концентрацию из соотношения:
СN (Na2CО3)= Т(Na2CО3)•1000/ Эм(1/2Na2CО3 •V)=0,005•1000/53=0,0943 моль/л, или, используя навеску, из соотношения:
СN (Na2CО3)=m(Na2CО3)•1000/ Эм(1/2Na2CО3 •V)=2,5•1000/53•500=0,0943 моль/л.
Пример5. На титрование 20см3 0,02М раствора НСl расходуется 15см3 раствора NaOH. Определить молярную концентрацию раствора.
Решение. Так как вещества реагируют между собой в эквивалентных количествах, то количество НСl в точке эквивалентности равно количеству NaOH:
n(HCl)=n(NaOH); n(HCl)=C(HCl) •V(HCl); n(NaOH)=C(NaOH) •V(NaOH);
C(HCl)•V(HCl) =C(NaOH) • V (NaOH); C(NaOH)=С(НСl) • V(НСl) / V(NaOH)=0,02•20,00 / 15,00=0,02667 моль/л.
Пример 6. Раствор карбоната натрия титруют раствором соляной кислоты (Т(НСl) - 0,00365г/см3) в присутствии метилового оранжевого. Вычислить титр раствора Na2CО3 .
Решение. Между эквивалентами реагирующих веществ и их титрами существует соотношение:
Э (НСl)- Э (Na2C03)
Т(НСl) -T(Na2C03)
Т(Na2CО3)=Т(НСl•Эм(Na2CО3)/Эм (НСl)=0,00365•53,0/36,5=0,0053 г/см3 .
Расчет результата анализа
Наиболее рациональный способ расчета состоит в вычислении количества определяемого вещества (n) с последующим пересчетом в массу (m) или массовую долю (W, %).
Пример 7. Вычислить массу серной кислоты в растворе, если на нейтрализацию требуется 200,00см3 раствора NaOH; T(NaOH)=0,004616 г/см3 .
Решение. Вычисляем концентрацию NaOH:
С(NaOH)= T(NaOH)•1000 / Эм(NaOH) = 0,004616•1000 / 40 = = 0,1154 моль/л.
m(H2SO4) = C(Na0H)-V(Na0H)- Эм(H2SO4) / 1000 = 49,0•0,1153•20,0 / 1000 = 0,1132г.
