
- •Нуклеотидный состав днк и рнк
- •Кислот в листьях и побегах растений может изменяться в пределах 0,1–1% сухой массы.
- •3.3.6.1. Генетическая роль и строение днк
- •3.1. Содержание и соотношение азотистых оснований в днк различных организмов
- •3.3.6.2. Виды рнк и их строение
- •3.3.7. Генетический код
- •3.2. Кодоны генетического кода*
- •3.3.8. Синтез днк
- •3.3.9. Cинтез рнк
- •3.3.10. Синтез белков
- •3.3.11. Синтез нуклеотидов
- •3.3.12. Процессы распада нуклеиновых кислот и нуклеотидов
- •3.3.13. Распад белков.
3.3.10. Синтез белков
Синтез белков представляет собой биохимический механизм образования полипептидов, аминокислотные последовательности которых закодированы в виде последовательности кодонов в соответствующей мРНК. В процессе синтеза полипептидов кодоны и протеиногенные аминокислоты вступают в непосредственное взаимодействие друг с другом. Роль посредников между ними выполняют тРНК и ферментные системы, катализирующие правильное связывание аминокислот с соответствующими тРНК, а также образование способных к синтезу белков рибосом и связывание их с мРНК. Поскольку процесс синтеза белков включает перевод генетической информации, закодированной в виде последовательности кодонов в молекулах мРНК, в последовательность аминокислотных остатков в белковых полипептидах, его называют трансляцией.
Синтез полипептидов начинается с активирования аминокислот и их ковалентного связывания с соответствующими тРНК, которое катализируют ферменты аминоацил-тРНК-синтетазы. Для каждой аминокислоты существует свой фермент, который с высокой точностью катализирует присоединение конкретной аминокислоты к соответствующей тРНК. На первом этапе фермент катализирует взаимодействие аминокислоты с АТФ, в результате образуется аденилат аминокислоты, содержащий макроэргическую связь, и пирофосфат:
О О
// //
R–СН–С + АТФ R–СН–С + Н4Р2О7
| \ | \
NH2 ОН NH2 ОАМФ
аминокислота аденилат аминокислоты
Н
O О
// //
R-CH-C
+ HO-АЦЦ – тРНК
R-CH-C
тРНК + АМФ |
\ |
NH2
O
АМФ NH2
аденилат
аминоацил-тРНК аминокислоты
О О
// //
R–СН–С + НО–АЦЦ-тРНК R–СН–СтРНК + АМФ
| \ |
NH2 ОАМФ NH2
аденилат аминокислоты аминоацил-тРНК
Следует отметить, что промежуточный продукт – аденилат аминокислоты – взаимодействует с тРНК, не выходя из ферментного комплекса, который кроме каталитической выполняет ещё две функции: контролирующую и корректирующую. При синтезе аминоацил-тРНК фермент точно выбирает и присоединяет к соответствующим акцепторным участкам определённую аминокислоту и определённую тРНК. Контролирующая функция аминоацил-тРНК-синтетазы заключается в том, что фермент распознает правильность присоединения к аденилату аминокислоты соответствующей тРНК. Если в ходе реакции произошла ошибка, то аминоацил-тРНК-синтетаза, соответствующая данной тРНК, подвергает гидролизу образовавшееся соединение.
Корректирующая функция связана с проверкой ферментом правильного подбора аминокислоты для соединения с определённой тРНК. В случае присоединения к молекуле тРНК неправильной аминокислоты образовавшаяся аминоацил-тРНК также подвергается гидролизу. В результате точной работы фермента, активирующего аминокислоты, вероятность неправильного соединения аминокислоты с тРНК очень мала и обычно не превышает 0,00006.
Следующий этап синтеза белков, называемый инициацией синтеза полипептидной цепи, происходит с участием рибосом, зрелой мРНК, специфических белковых факторов и инициаторной аминоацил-тРНК. В результате их взаимодействия образуется инициаторный комплекс, в котором осуществляется соединение мРНК с рибосомой и инициаторной аминоацил-тРНК.
Рибосомы – это нуклепротеидные частицы, в которых молекулы рибосомных РНК образуют комплексы с набором специфических рибосомных белков (55 у бактерий и около 70 у эукариот), многие из которых обладают основными свойствами, так как содержат большое количество остатков лизина и аргинина. Размеры рибосом цитоплазмы эукариотических клеток превышают размеры бактериальных рибосом в среднем в 1,17 раза.
Бактериальные 70S-рибосомы состоят из двух субъединиц – малой 30S-субъединицы и большой 50S-субъединицы. В цитоплазме клеток высших организмов содержатся 80S-рибосомы, которые распадаются на 40S и 60S-субъединицы. В хлоропластах и митохондриях клеток высших организмов имеются свои собственные рибосомы, которые по химическому составу и размерам ближе к рибосомам прокариот.
Инициация синтеза полипептидной цепи всегда начинается с участием особой метионил-тРНКi, которая с помощью водородных связей комплементарно присоединяется своим антикодоном УАЦ к кодону АУГ мРНК, называемому в связи с этим инициаторным кодоном. Таким образом, синтез любой полипептидной цепи начинается с включения в неё на N-конце остатка аминокислоты метионина, однако после того как синтез полипептида осуществлен, его молекула может подвергаться так называемой посттрасляционной модификации, в ходе которой концевые фрагменты молекулы полипептида могут отщепляться специфической протеазой, поэтому функционально активные полипептиды не всегда содержат на N-конце остатки метионина. С меньшей частотой в качестве инициаторного кодона может использоваться триплет ГУГ, к которому также присоединяется метионил-тРНКi. У бактерий к инициаторному кодону присоединяется N-формил-метионил-тРНКi, у которой аминогруппа метионина блокирована формильной группировкой, однако вскоре после начала синтеза полипептидной цепи формильная группировка отщепляется.
В отличие от аминоацил-тРНКi, участвующей в инициации синтеза полипептидной цепи, перенос остатков метионина в процессе дальнейшего синтеза полипептидной цепи осуществляется метионил-тРНК второго типа, которая не может взаимодействовать с инициаторным кодоном.
Образование инициаторного комплекса катализируют специфические белки, называемые белковыми факторами инициации синтеза полипептидной цепи. У бактерий это белковые факторы IF1, IF2, IF3, у растений и животных – IF-М1, IF-М2, IF-М3. Наиболее хорошо генетическая система синтеза белков изучена у бактерий.
В бактериальной клетке инициация синтеза белков начинается с того, что белок IF3 связывается с малой субъединицей рибосомы (рис. 3.14), предотвращая её соединение с большой субъединицей. Затем происходит присоединение малой рибосомной субъединицы к участку на мРНК, содержащему инициаторный кодон. После этого оказывается возможным комплементарное присоединение к инициаторному кодону N-формил-тРНКi с участием белковых факторов IF2, IF1 и образование так называемого инициаторного комплекса. При этом белок IF2 содержит в связанном состоянии ГТФ, который в дальнейшем подвергается гидролизу в процессе присоединения к инициаторному комплексу большой субъединицы рибосомы, а высвобождающаяся при гидролизе энергия используется для формирования комплекса рибосомы, мРНК и присоединённой к ней метионил-тРНКi. Образовавшийся комплекс способен в дальнейшем участвовать в следующем этапе синтеза белка – элонгации полипептидной цепи, а белковые факторы IF3, IF1 и IF2 высвобождаются.

Н3РО4
Рибосома, способная к синтезу белков
Рис. 3.14. Схема инициации синтеза полипептидной цепи
IF1, IF2, IF3 – белковые факторы инициации синтеза полипептидной цепи; АУГ – инициаторный кодон; тРНКmet – метионил-тРНКi, с участием которой начинается синтез полипептидной цепи.
В клетках высших организмов порядок формирования инициаторного комплекса несколько отличается – с малой субъединицей рибосомы вначале связывается метионил-тРНКi, а затем уже к рибосоме присоединяется молекула мРНК.
П
В торой
этап элонгации полипептидной цепи
заключается в образовании пептидной
связи между аминокислотными остатками
метионина и другой аминокислоты,
присоединённой через антикодон тРНК к
следующему кодону мРНК. Направление
размещения кодонов в мРНК происходит
от 5'-конца к 3'-концу, а направление
образования пептидных связей в
синтезирующемся пептиде – от N-конца
к С-концу. Образование пептидной связи
катализирует фермент пептидилтрансфераза,
который входит в состав большой
субъединицы рибосомы. Энергия, необходимая
для синтеза пептидной связи, высвобождается
в результате расщепления макроэргической
связи между остатком аминокислоты и
тРНК.
торой
этап элонгации полипептидной цепи
заключается в образовании пептидной
связи между аминокислотными остатками
метионина и другой аминокислоты,
присоединённой через антикодон тРНК к
следующему кодону мРНК. Направление
размещения кодонов в мРНК происходит
от 5'-конца к 3'-концу, а направление
образования пептидных связей в
синтезирующемся пептиде – от N-конца
к С-концу. Образование пептидной связи
катализирует фермент пептидилтрансфераза,
который входит в состав большой
субъединицы рибосомы. Энергия, необходимая
для синтеза пептидной связи, высвобождается
в результате расщепления макроэргической
связи между остатком аминокислоты и
тРНК.
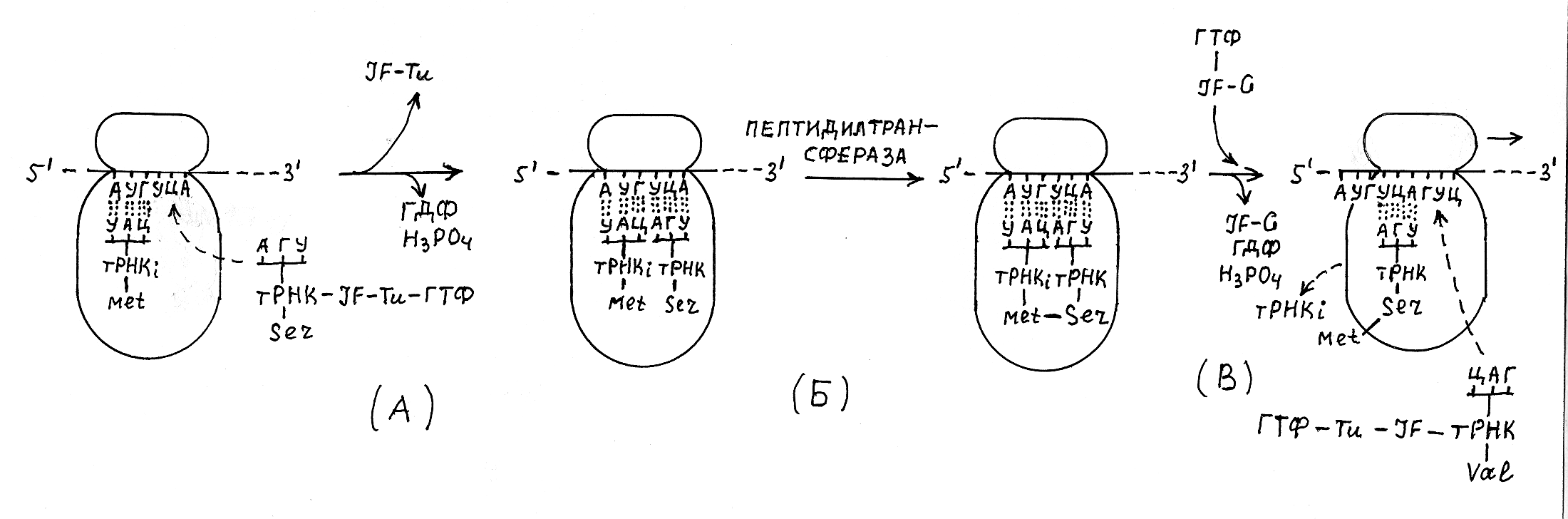
Рис. 3.15. Элонгация полипептидной цепи
А – присоединение к активной рибосоме аминоацил-тРНК с соответствующим антикодоном; Б – синтез пептидной связи между аминокислотными остатками в большой субъединице рибосомы; В – этап транслокации.
Третий этап процесса элонгации полипептилной цепи получил название транслокации. Этот этап катализирует белковый фактор IF2 в комплексе с ГТФ, под действием которого рибосома перемещается вдоль молекулы мРНК в направлении от 5' к 3'-концу на три нуклеотидных остатка, включая в сферу реакции присоединения аминоацил-тРНК следующий кодон. В ходе этой реакции, которая сопровождается гидролизом ГТФ, происходит высвобождение белкового фактора IF2 и выход из рибосомы тРНКi, а синтезированный дипептид остаётся связанным с тРНК2, присоединённой водородными связями к своему кодону в составе мРНК.
После этого уже к третьему кодону может присоединиться соответствующая тРНК, связанная со своим аминокислотным остатком, который соединяется новой пептидной связью с синтезированным дипептидом. Затем повторяется акт транслокации, и рибосома снова перемещается на один кодон, к которому может уже присоединиться с помощью тРНК следующий аминокислотный остаток и т.д., пока не будет синтезирована полностью полипептидная цепь, закодированная в виде последовательности кодонов в структуре мРНК. При этом последовательность соединения ами-нокислотных остатков в синтезированной полипептидной цепи будет определяться последовательностью кодонов в мРНК.
По мере продвижения рибосомы вдоль молекулы мРНК в ходе синтеза полипептидной цепи происходит высвобождение её конца, содержащего инициаторный кодон. И на нём начинается образование нового инициаторного комплекса и активной рибосомы, которая будет осуществлять синтез новой полипептидной цепи на одной и той же мРНК-матрице. В результате одновременного взаимодействия с одной и той же молекулой мРНК нескольких рибосом образуется полирибосома. В зависимости от линейных размеров мРНК полирибосома может включать от 3–5 до нескольких десятков рибосом. За счёт образования полирибосом значительно повышается эффективность использования клеткой мРНК, так как на одной молекуле мРНК с помощью присоединённых к ней рибосом одновременно может синтезироваться несколько полипептидных цепей (по числу рибосом в полирибосоме).
Синтез полипептидной цепи продолжается до тех пор, пока на пути
движения рибосомы по мРНК не встретится терминирующий кодон. Как было указано ранее (см. табл. 3.2), имеются три терминирующих кодона – УАГ, УГА и УАА. Они не кодируют аминокислотные остатки, но служат сигналами для прекращения синтеза полипептидной цепи. Эти кодоны способны узнавать специфические белки, называемые факторами терминации: у бактерий существуют два таких белковых фактора – RF1 и RF2, у высших организмов – один (RF – по-английски release factor).
Когда терминирующий кодон оказывается в составе рибосомы, с ним связывается белковый фактор терминации (рис. 3.16), который катализиру-ет гидролитическое расщепление сложноэфирной связи, соединяющей синтезированную полипептидную цепь с последней тРНК, комплементарно связанной своим антикодоном с соответствующим кодоном мРНК. В результате гидролиза этой связи синтезированный полипептид отделяется от рибосомы, а освобожденный от полипептидной цепи рибосомный комплекс диссоциирует с образованием свободных субъединиц рибосомы, мРНК, свободных белковых факторов терминации трансляции и оставшейся последней молекулы тРНК, от которой была отделена синтезированная полипептидная цепь. В дальнейшем они могут снова принять участие в синтезе новой молекулы белкового полипептида.

Рис. 3.16. Терминация синтеза полипептидной цепи
А – связывание белкового фактора терминации синтеза полипептидной цепи (RF) с терминирующим кодоном и высвобождение синтезированной полипептидной цепи; Б – диссоциация рибосомы на субъединицы и высвобождение матричной РНК (mРНК) и последней тРНК; 1 – синтезированная полипептидная цепь; 2 – малая субъединица рибосомы; 3 – большая субъединица рибосомы.
После отделения от рибосомы синтезированной полипептидной цепи она приобретает свойственную ей пространственную структуру в соответ-ствии с последовательностью соединённых в ней аминокислотных остатков. Образовавшиеся в процессе трансляции полипептиды под действием соответствующих ферментов подвергаются посттрансляционному процессингу, в ходе которого они превращаются в функционально активные белки, имеющие характерную для них нативную конформацию молекул.
В результате процессинга от белковых полипептидов специфическими протеазами могут отщепляться концевые фрагменты их полипептидных цепей. Возможна также модификация аминокислотных радикалов (например, превращение остатков пролина в остатки оксипролина), образование дисульфидных связей, фосфорилирование остатков серина или тирозина и др. В связи с тем что процесс трансляции осуществляет довольно сложный по структуре нуклеопротеидный комплекс, скорость синтеза полипептидной цепи существенно ниже, чем скорость образования молекул нуклеиновых кислот. В клетках бактерий с участием функционально активных рибосом за 1 мин может синтезироваться полипептидная цепь, включающая 300–400 аминокислотных остатков, а у растений и животных – полипептид, содержащий 30–50 радикалов аминокислот.
Т
–ААГ–АГТ
–АТА –АЦГ–ГТА– последовательность
кодонов в ДНК
–УУЦ–УЦА–УАУ–УГЦ–ЦАУ–
комплементарная ей последовательность
нуклеотидов в мРНК –Phe
– Ser – Tyr
– Cys – His
– последовательность аминокислотных
остатков
в синтезированном полипептиде
В процессе синтеза мРНК на ДНК-матрице последовательность дезоксирибонуклеотидных остатков ДНК переводится в последовательность рибонуклеотидных остатков мРНК. После осуществления процессинга и сплайсинга функционально активные молекулы мРНК связываются с рибосомами и используются в качестве биологических матриц для синтеза полипептидов. Выстраивание на мРНК-матрице аминокислотных остатков происходит с помощью тРНК, которые, присоединив аминокислотный остаток к ЦЦА-концу, переносят его в рибосому на основе комплементарного присоединения своего антикодона к соответствующему кодону мРНК. В результате синтеза пептидных связей на мРНК-матрице образуется полипептидная цепь, в которой последовательность соединения аминокислотных остатков определяется последовательностью кодонов в мРНК.
В этом процессе чрезвычайна важна роль тРНК. Именно с помощью своего антикодона каждая тРНК, соединяясь комплементарно с кодоном, определяет место аминокислотному остатку в синтезирующейся полипептидной цепи. Учитывая, что в молекулах ДНК и мРНК существует 61 значащий кодон, можно было бы ожидать и наличие такого же числа тРНК, имеющих соответствующие кодонам антикодоны. Однако обычно клетки организмов в процессе синтеза белков используют меньший набор тРНК. Это связано с тем, что при спаривании в ходе синтеза полипептидов кодонов с антикодонами допускаются определённые отклонения от принципа комплементарности, которые характерны для последних нуклеотидных остатков на 3'-конце кодона и 5'-конце антикодона.
Исходя из таких особенностей спаривания кодонов и антикодонов, некоторые антикодоны, могут спариваться с двумя разными кодонами, которые отличаются нуклеотидными остатками на 3'-конце, в связи с чем общее число антикодонов, используемых в синтезе полипептидов, может быть меньше существующего числа кодонов. Так, например, в клетках рас-тений для осуществления трансляции используются 37 типов тРНК.
Следует отметить, что процесс переноса генетической информации от ДНК или РНК на белки необратим. Для того чтобы реализовать обратный процесс, потребовалось бы иметь не менее сложную биологическую систему, чем система синтеза белков. Однако такой системы в организмах не существует. Поэтому обратный перенос информации от белков к РНК и ДНК никогда не наблюдался в живых организмах и, по-видимому, невозможен.
Подтверждением правильности представленных выше молекуляр-ных механизмов трансляции является создание искусственных бесклеточных систем синтеза белков. Так, например, для синтеза растительных белков в системе in vitro очень часто используют бесклеточный ферментный экстракт из зародышей пшеницы, содержащий молекулы тРНК и ферменты синтеза белков, к которому добавляют аминокислоты, АТФ, ГТФ, очищенные растительные рибосомы и функционально активные мРНК. В указанной бесклеточной системе синтезируются белки, первичная структура которых закодирована в молекулах мРНК. Если в бесклеточную систему синтеза белка добавляют мРНК из созревающих зерновок кукурузы, синтезируется запасной белок зерна кукурузы зеин , а если добавляют мРНК из созревающих семян гороха, образуется легумин гороха. Соответственно с участием мРНК созревающих зерновок ячменя синтезируется гордеин.
Перенос информации от РНК к ДНК наблюдается в животных клетках, инфицированных некоторыми вирусами, у которых происходит синтез молекул ДНК на РНК-матрице под действием ферментного комплекса обратной транскриптазы. Очищенные препараты этого фермента, выделенного из вирусных частиц, находят применение в экспериментах по синтезу генов, в которых в качестве матрицы для образования ДНК служат молекулы мРНК. При использовании в качестве матрицы химически модифицированных молекул РНК с помощью фермента обратной транскриптазы возможен также синтез искусственных генов.
