
- •Часть 4. Химическая стойкость и защитные свойства неметаллических материалов
- •Глава 17. Взаимодействие неметаллических материалов с агрессивными средами
- •- Перепад давления. В крупнопористых неметаллических материалах (более 60 103 нм) поток линейно возрастает с увеличением давления и может быть рассчитан при решении уравнения Дарси:
- •Сорбция воды полимером может вызывать его набухание, сопровождающееся увеличением массы, объема, изменением структуры. Предельным случаем набухания является растворение полимера.
- •Глава 18. Прочность и разрушение неметаллических материалов в агрессивных средах.
- •Часть 5. Номенклатура неметаллических материалов для антикоррозионной техники
- •Глава 19. Силикатные материалы
- •Свойства ситаллов
- •Глава 20. Материалы на основе высокополимеров
- •20.1. Общие положения, классификация, назначение
- •Относительное удлинение при разрыве, % 250 – 500
- •Относительное удлинение при разрыве, % 100 - 130
- •Относительное удлинение при разрыве, % 350 - 500
- •Ударная вязкость, кДж/м2 2 – 3 Коэффициент линейного расширения
- •Глава 21.. Каучуки и резины
- •Глава 22. Углеграфитовые материалы
- •Глава 23 Лакокрасочные и вяжущие материалы на органической основе.
- •Глава 24. Композиционные материалы
- •Глава 25. Материалы для прокладок
Часть 4. Химическая стойкость и защитные свойства неметаллических материалов
Глава 17. Взаимодействие неметаллических материалов с агрессивными средами
17.1.Классификация и общие представления о неметаллических материалах.
В зависимости от природы неметаллические материалы подразделяют на два класса: материалы неорганического происхождения и материалы органического происхождения. В том и в другом классе можно выделить по две группы материалов: материалы природные (естественные) и материалы искусственные. Например, гранит, мрамор, слюда, асбест являются природными материалами неорганического происхождения, тогда как неорганическое стекло, керамика и фарфор – это искусственные неорганические материалы. Древесина, уголь, растительные масла, получаемые из растительного сырья, относятся к природным органическим материалам, а синтетические смолы, пластмассы, синтетические каучуки – это искусственные органические материалы.
Следует отметить, что деление неметаллических материалов по их природе на материалы неорганического и органического происхождения в некоторой степени является условным, т.к. многие современные искусственные композиционные материалы сочетают в себе компоненты из неорганических и органических материалов. В частности, широко распространенные конструкционные материалы, объединенные общим названием «стеклопластики», состоят из стеклянных волокон (до 80% объемных) и из синтетических полимерных смол (до 20% объемных). Слово «пластик» в названии этих материалов автоматически относит их к материалам органического происхождения, хотя в них 80% неорганического материала. В общепринятом понимании «полимер» – это органический материал. Однако есть и неорганические полимеры.
Неметаллические материалы имеют свои достоинства и недостатки. К их достоинствам, прежде всего, следует отнести высокое сопротивление к воздействию на них многих химических реагентов. Из недостатков можно отметить низкую теплопроводность, невысокую температуру эксплуатацию для большинства из них, невысокие прочностные характеристики по сравнению с металлами. Хотя можно привести примеры неметаллических материалов, которые по своим прочностным характеристикам и теплостойкости существенно превосходят металлы, что позволяет эффективно использовать их в ракетно-космической технике. К ним относятся искусственные композиционные материалы.
17.2.Особенности взаимодействия неметаллических материалов с агрессивными средами.
В задачу раздела науки о химическом сопротивлении неметаллических материалов входит изучение механизмов и кинетики процессов их разрушения в контакте со средой. Целью таких исследований являются повышение сопротивляемости материалов действию среды и разработка методов прогнозирования их работоспособности.
При изучении механизма и кинетики протекающих процессов первостепенными становятся знания, каким образом изменение свойств материала скажется на работоспособности материала в изделии и умение предсказать время наступления отказа. Для неметаллических материалов эта задача чрезвычайно сложна, вследствие того, что исследователю приходится иметь дело с большим набором различных свойств материалов и изделий из них, а также с большим разнообразием процессов воздействия агрессивных сред на материалы. Кроме того, в силу сравнительной молодости науки и ряда методических ошибок исследователей на ранней стадии ее развития пока еще не произошло достаточного накопления фактических данных для квалифицированного решения ряда задач без постановки предварительных экспериментов.
Тем не менее, сейчас можно четко сформулировать общие положения, касающихся особенностей процессов в системе «неметаллический материал – среда».
Взаимодействие любого неметаллического материала со средой, аналогично коррозии металлов, является гетерогенным процессом, отличающимся сложностью и многостадийностью. Основными стадиями его являются: перенос (транспорт) компонентов агрессивной среды в место взаимодействия (реакционную зону); непосредственное взаимодействие компонентов среды с веществами, образующими материал (реакция); отвод (перенос) образовавшихся продуктов реакций из реакционной зоны. Каждая из перечисленных стадий состоит, как правило, из последовательно-параллельных элементарных актов, протекающих с различными скоростями.
Специфика процессов переноса и реакции взаимодействия обусловлена, прежде всего, особенностью строения и структуры неметаллических материалов. На первый план здесь выступает плотность материалов.
Представления о плотности различных материалов можно получить по значению коэффициента водородопроницаемости (объем газа, проникшего через единицу поверхности на глубину в единицу времени, при перепаде давления - см³·см/см²·с·мм Hg) при t= 200С:
металлы 10-17÷ 10-14
неорганические стекла 10-14÷ 10-10
полимеры 10-10÷ 10-7
жидкости 10-7÷ 10-5
бумага, кожа 10-5÷ 101
ткани 101÷ 103
Как видно плотность наиболее непроницаемых неметаллов (силикатные стекла, полимеры) на 3 – 7 порядков ниже, чем металлов.
Это обстоятельство делает неметаллические материалы более доступными для среды, что проявляется в более развитой поверхности контакта с ней. Если в металлических конструкциях поверхность контакта со средой, как правило, равна поверхности конструкции (коррозия – это процесс, протекающий главным образом на поверхности металла), то в неметаллических конструкциях, особенно из капиллярно-пористых материалов, реакционная поверхность многократно возрастает. Процесс взаимодействия среды с материалом идет не только на поверхности, но, в основном, в его объеме. Транспортные процессы доставки реагента и отвода продуктов взаимодействия здесь приобретают первостепенное значение. Поэтому возникает необходимость исследовать процессы переноса различных сред в неметаллах. И здесь исследователь сталкивается с гетерогенностью системы.
Перенос агрессивной среды и продуктов взаимодействия сопровождается их накоплением в материале, что приводит к возникновению дополнительных внутренних напряжений, таких как напряжения набухания, капиллярное и осмотическое давление, расклинивающий эффект и т.д. Вследствие изменения концентрации веществ в объеме материала возникающие напряжения также неравномерно распределяются по его объему, локализуются на дефектах структуры и создают трудно контролируемое сложно - напряженное состояние в материале конструкции. Таким образом, во многих случаях среда, контактирующая с неметаллическим материалом, может стать источником сложного напряженного состояния, которое, суммируясь с действующими нагрузками, может существенно повлиять на работоспособность конструкции и привести к ее не прогнозированному отказу, если при расчете не учтены отмеченные обстоятельства.
Далее. Подавляющее большинство неметаллических материалов является диэлектриками. Исключение составляют уголь и графит, графитонаполненные (с высокой степенью наполнения) полимерные композиты и полимерные композиты, в которых арматурой являются металлические порошки, волокна, нити.
Следовательно, при взаимодействии неметаллических материалов с различными химическими реагентами, включая электролиты, как правило, невозможно протекание электрохимических процессов. Изменение химического состава или структуры взаимодействующих материалов и веществ может быть лишь следствием различных химических реакций. То-есть, химическая устойчивость какого-либо неметаллического материала к действию того или иного химического реагента изначально будет определяться его химической природой (химическим составом).
Если основой силикатного материала является кислотообразующий диоксид кремния SiО2 (например, у плавленого кварца – 99%SiО2, у силикатной эмали – 75 - 90%SiО2), то такой материал будет обладать высокой химической стойкостью к действию кислот. Причем, чем концентрированнее будет кислота, тем большей химической стойкостью к ее действию обладает материал. Исключение здесь составляет фтороводородная (плавиковая) кислотаHF, которая, как известно, сильно разрушает диоксид кремния по реакции:
SiО2 + HF → SiO4↑ +2H2O (17.1)
Ряд материалов, содержащих SiО2, разрушается и при воздействии на них гексафторокремневойH2SiF6и фосфорной кислот. Но это взаимодействие имеет место при высоких температурах и протекает с меньшей скоростью
Если же материалы, состоящие из диоксида кремния, вступают в контакт с основаниями, особенно с едкими щелочами, то их разрушение предопределяется реакцией нейтрализации, например:
SiO2 + 2NaOH → Na2SiО3 + H2O (17.2)
Натриевая соль кремниевой кислоты (силикат натрия) Na2SiО3достаточно хорошо растворима в воде (жидкое стекло), что делает невозможным какое-либо торможение со временем реакции взаимодействия.
Точно также можно изначально судить о химической стойкости материалов на органической основе.
Известно, что органические соединения хорошо реагируют с различными окислителями. Следовательно, подавляющее большинство полимеров и пластмасс на их основе неустойчивы к действию окислительных сред (азотная, хромовая, концентрированная серная кислоты). Исключение здесь составляют фторполимеры, обладающие высокой устойчивостью к действию окислителей.
Из органической химии известно, что фенолы хорошо реагируют с едкими щелочами, а эфиры подвержены щелочному гидролизу, то и полимеры на их основе (например, фенолоформальдегидные и полиэфирные смолы) будут обладать низкой химической стойкостью в таких средах.
Приведенные примеры показывают, что предварительная оценка химической стойкости неметаллов может основываться на правиле химии: «подобные вещества в химическую реакцию друг с другом не вступают».
Другое дело – кинетика, с какой скоростью будет идти процесс взаимодействия разнородных веществ. Здесь немаловажную роль играют такие факторы, как плотность, морфология, структура и др. Например, материал, полученный плавлением горной базальтовой породы – плавленый базальт, содержит в своем составе всего 48% SiО2 и в этой связи не может считаться кислотостойким материалом. Однако высокая его плотность (отсутствие пористости) обуславливает только поверхностное взаимодействие с кислотами, протекающее с очень малой скоростью. Поэтому изделия из плавленого базальта в реальных условиях эксплуатации обеспечивают высокую работоспособность конструкций в кислых средах. С другой стороны, плавленый кварц, содержащий 99 %SiО2вследствие высокой плотности в реальных условиях эксплуатации достаточно работоспособен в контакте с основаниями и даже едкими щелочами при умеренных температурах.
Неметаллические материалы, применяемые в технике, являются многокомпонентными (гетерогенными) системами, что оказывает существенное влияние на их взаимодействие с агрессивными средами. Гетерогенность структуры неметаллов и возникновение, особенно в композиционных материалах, межфазных слоев (продуктов взаимодействия различных компонентов композита), может существенно изменить механизм доставки реагентов, механизм и кинетику взаимодействия и отвода продуктов реакций. Транспорт среды может осуществляться несколькими видами процесса переноса в материале, могут протекать несколько видов химических реакций, часто сопряженных с другими физико-химическими процессами, оказывающими вредное воздействие на работоспособность изделия.
Элементарный пример. Низкая плотность и высокая пористость строительных бетонов приводят к значительному поглощению ими влаги в дождливые осенне-зимние периоды в конструкциях, эксплуатирующихся на открытом воздухе. При понижении температуры эта влага, замерзая (кристаллизуясь) в порах, создает большие напряжения, вследствие увеличения объема, что приводит к разрушению конструкций.
Другой случай. Незначительное количество оксидов щелочных и щелочноземельных металлов в кислотостойком силикатном материале может вызвать вредные последствия. Так, при взаимодействии CaOс серной кислотой образуется гипс по реакции:
CaO + H2SO4 → CaSO4 + H2O, (17.3)
при этом протекает гидротация гипса
CaSO4 + 2H2O → CaSO4 2H2O, (17.4).
что приводит к увеличению его объема в 1,5 раза и к растрескиванию (разрушению) материала.
Здесь уместно напомнить, что понятие «материал» неотрывно связано с конкретным изделием (заготовка, полуфабрикат, изделие). Когда говорят «железо», «сталь», «алюминий» и т.д., то в техническом аспекте речь идет о реализации этих металлов в реальных изделиях: отливка, поковка, лист, профильный прокат и т.п.. Поэтому технологическая наследственность играет определенную роль в формировании различных эксплуатационных свойств конструкций.
Это обстоятельство особенно важно для неметаллических материалов, которые реализуются в конкретных изделиях при конкретных методах переработки. В самом деле, материал «фарфор» - это конкретное изделие (чашка, блюдце, насадочные кольца, трубы, ситчатая тарелка абсорбера и т.д.), материал «полиэтилен» – тоже конкретное изделие (пленка, лист, труба, вентиль и др.), полученные своими методами переработки.
В этой связи не всегда можно отождествлять понятия «химическая стойкость» материала и «эксплуатационная пригодность» (работоспособность) изделия из этого материала.
В приведенном выше примере плавленного базальта, он как материал, строго говоря, является химически нестойким к действию кислот, но изделия из него вполне работоспособны при их реальной эксплуатации в конструкциях.
Другой, противоположный пример. Силикатные кирпичи могут формоваться из композиции, состоящей в простейшем случае из 90 – 95% песка (диоксида кремния SiО2), связанного строительным цементом или известью (известнякCaCO3– основная соль). По химической природе – это кислотостойкий материал. Однако при контакте с кислотой, например серной, произойдет реакция:
CaCO3 + H2SO4 → CaSO4 + CO2 + H2O, (17.5)
при этом разрушится «связка», кирпич, как изделие, перестанет существовать (потеряет работоспособность) и появится кучка кислотостойкого песка из диоксида кремния.
Экспериментально доказан факт, что химическая стойкость неметаллических материалов существенно определяется физическим строением. Более стойкими являются кристаллические материалы, менее устойчивыми – аморфные. Современные технологии получения кристаллических структур силикатных стекол обеспечивают их более высокую химическую стойкость (равно, как и более высокие физико-механические характеристики) по сравнению с обычными силикатными стеклами – типичными аморфными веществами.
У материалов со смешанным строением химическая стойкость возрастает с увеличением степени кристалличности. Так химическая стойкость полипропилена с увеличением его степени кристалличности возрастает. В таких материалах среда атакует аморфную фазу.
Известно, что насыщенные углеводородные полимеры химически более устойчивы, чем ненасыщенные, т.к. наличие двойных или тройных ненасыщенных связей повышает химическую активность вещества.
Полимерные материалы циклического строения более стойки, чем линейные. Пространственно сшитые линейные полимеры, например резины, более стойки, чем несшитые – каучуки.
Что касается композиционных материалов, то в данном разделе уместно обратить внимание на одно общее правило: если хотя бы один из компонентов композита химически нестоек к действию конкретной среды, то применение такого материала нежелательно.
Из всего вышеизложенного становятся ясными сложности в изучении процессов, протекающих при контакте неметаллических материалов с различными средами с точки зрения определения эксплуатационной пригодности, чаще всего обозначаемой термином «химическая стойкость». В этой связи сам термин «агрессивная среда» имеет расширенный смысл, чем понятие «химический реагент».
Агрессивной средой для материалов, вообще, а для неметаллов, особенно, считается такая внешняя среда, которая, воздействуя на него, ухудшает свойства изделия из этого материала.
Чаще всего существенное изменение свойств происходит вследствие химического воздействия среды на материал, вызывающего необратимое изменение химического состава и структуры материала. Такие среды по отношению к рассматриваемому материалу считают химически активными.
Однако изменение свойств материала под воздействием среды может наблюдаться и без заметных изменений его химического состава и структуры.
Среды, оказывающие подобный эффект относят к разряду физически активных.
Наиболее яркими представителями этого класса сред, выделенные в отдельную группу, являются поверхностно-активные вещества (ПАВ), которые, адсорбируясь на поверхности твердого тела, существенно понижают его поверхностную энергии, снижая тем самым прочность материала. Действие таких веществ часто является обратимым. К примеру, влага является таким агрессором для стеклянных волокон, широко используемых для изготовления композиционных материалов – стеклопластиков. Однако удаление влаги с поверхности стеклянных волокон путем нагревания восстанавливает практически их первоначальную прочность.
Агрессивное воздействие физически активных сред, особенно ПАВ, наиболее эффективно проявляется на напряженно-деформированном материале. При совместном воздействии на полимеры механических напряжений и сред, к действию которых ненапряженный материал химически инертен, весьма часто наблюдается активизация химического взаимодействия, так называемые механохимические явления. В реальных условиях иногда затруднительно отделить физическое и химическое воздействие (в этом некоторая условность деления сред на физически и химически активные). Чаще приходится говорить о физико-химических процессах. Это создает определенные методические и экспериментальные проблемы, особенно при исследовании взаимодействия напряженно-деформированных материалов со средами.
Независимо от характера активности сред, их весьма часто разделяют по агрегатному состоянию: газовые и жидкие среды.
Такая классификация сред по агрегатному состоянию положена в основу построения многих монографий, учебников и учебных пособий по химическому сопротивлению материалов, особенно по коррозии и защите металлов. Такой подход оправдан, т.к. процессы взаимодействия материалов с газами, как по механизму, так и по кинетике, отличаются от процессов, протекающих в жидких средах. При изучении взаимодействия неметаллических материалов с газовыми средами, в отличие от металлов, допускается наличие конденсации влаги. Особенно при изучении взаимодействия с атмосферой бетонов, керамики и полимерных композиционных материалов. Для металлов возможно в таких условиях изменение механизма коррозии с химического на электрохимический, что для указанных неметаллических материалов исключено.
17.3.Взаимодействие неметаллических материалов с газами.
Как отмечено выше, взаимодействие (механизм и кинетика) неметаллических материалов с любой средой, независимо от ее агрегатного состояния во многом определяется транспортом среды – ее переносом в материале, что зависит от структуры: величины свободного объема, размера и количества пор, трещин и других дефектов.
В этой связи перенос газов в неметаллических материалах может осуществляться по различным механизмам, основными из которых являются молекулярно-диффузионный, фазовый и смешанный механизм переноса.
Молекулярно-диффузионный механизм (активированная диффузия) имеет место в материалах, у которых размеры пор существенно малы по сравнению с длиной свободного пробега молекулы газа, что характерно для плотных материалов (стекла, силикатные эмали, плавленные силикаты, большинство полимеров).
Кинетика молекулярно - диффузионного переноса описывается первым и вторым уравнениями Фика.
Фазовый перенос характерен для пористых материалов, например, неуплотненных цементов и бетонов, огнеупоров, фильтрующей керамики. В зависимости от размеров пор кинетика такого переноса подчиняется соответственно уравнениям Кнудсена - Пуазейля или Дарси.
Смешанный перенос, осуществляемый одновременно и по молекулярно-диффузионному, и по фазовому механизмам, имеет место для материалов с различными размерами пор. Такой вид переноса характерен для ряда композиционных материалов.
В любом случае переноса может быть контакт либо с инертными газами, либо с активными газами, вступающими в химическое взаимодействие с материалами. Понятно, что второй вариант является наиболее опасным с точки зрения сохранения эксплуатационной пригодностью и долговечности материала.
17.3.1. Взаимодействие силикатных материалов с газами
Для бетонных и железобетонных конструкций весьма активными являются присутствующие в обычной атмосфере кислород, диоксид углерода, водяной пар. Диоксид углерода (углекислый газ) является основным агрессивным агентом, действующим на бетоны, вызывая его карбонизацию по реакции:
Ca(OH)2 + CO2 → CaCO3 + H2O (17.6)
Этот процесс протекает с диффузионным контролем, и лимитирующей стадией является диффузия CO2 вглубь бетона. Основное уравнение кинетики этого процесса выражает зависимость толщины нейтрализованного слоя бетона х от времени τ:
х =
![]() ,
(17.7)
,
(17.7)
где D– коэффициент диффузииCO2 в бетон.
С0– концентрацияCO2в атмосфере,
m0– способность бетона поглощатьCO2.
Величину С0определяют путем замера состава атмосферы, а значениеm0 определяются экспериментально на шлифах бетона по фиксации глубины
нейтрализации с помощью индикаторов.
В промышленной атмосфере разрушение бетонов и железобетонов идет более интенсивно. Во-первых, потому что концентрация CO2повышается в 2 –3 раза по сравнению с обычной атмосферой (от 600 до 2000 мг/м3), а во-вторых, из-за наличия в атмосфере других агрессивных газов (SO2, HCl, Cl2,NO2,HFи др.), хотя концентрация которых в атмосфере строго контролируется. Из перечисленных газов наиболее агрессивным является HCl, который во влажном бетоне интенсивно взаимодействует с основным компонентом цементного камня -Ca(OH)2, превращая его в аморфную массу.
Тем не менее, в атмосферно-влажностной среде, даже в условиях сильного ее загрязнения, химические и физико-химические процессы, протекающие в бетонных конструкциях, не вызывают их существенного разрушения. Однако долговечность железобетонных конструкций может сильно снизится из-за возможной коррозии стальной арматуры.
В железобетонных конструкциях бетон защищает стальную арматуру от коррозии. Высокая щелочность бетона, вызванная наличием Ca(OH)2, обеспечивает перевод стальной арматуры в пассивное состояние, что имеет место при значениях рН в интервале 9,5 – 12, обычных для бетонов.
При воздействии газов на увлажненные железобетонные конструкции и сооружения, эксплуатируемые на открытом воздухе, их разрушение может происходить по двум механизмам. Газы либо непосредственно разрушают бетон защитного слоя с обнажением и коррозией арматуры, либо, не разрушая бетон, настолько изменяют его жидкую фазу (значение рН менее 9,5), что нарушается пассивное состояние арматуры, и начинается ее коррозия внутри бетона. Чаще всего этот коррозионный процесс идет со значительно большей скоростью, чем корродирует открытая стальная конструкция в тех же условиях воздействия среды.
Образующиеся продукты коррозии стали, имеют объем в 2 – 2,5 раза больший, чем объем прокорродировавшего металла. В бетоне возникают внутренние растягивающие напряжения, превышающие его прочность, вследствие чего образуются трещины, через которые облегчается доставка газа к арматуре и ускоряется коррозия. Развитие коррозии арматуры приводит к нарушению ее сцепления с бетоном (монолитности железобетона) и резкому снижению несущей способности конструкции. Это негативное явление получило название «рост бетона» («рост железобетона»).
В зависимости от свойств образующихся продуктов и воздействия на стальную арматуру кислые газы, воздействующие на бетон, подразделяют на три группы.
К первой группе относят СО2,HF,SiF4пары щавелевой кислоты. Они при взаимодействии с бетоном образуют нерастворимые или малорастворимые соли кальция, при этом происходит уплотнение бетона и снижение его проницаемости. Например, действиеSiF4 протекает по реакции:
2Са(ОН)2+SiF4→ 2CaF2↓ +Si(ОН)4(17.8)
Образование нерастворимого осадка приводит к уменьшению пористости и проницаемости, увеличению прочности (в 3 – 5 раз) и химической стойкости бетона.
Обработка бетонов фторидом кремния SiF4 широко используется на практике и носит название «флюатации». Уплотнение бетона под действием газов первой группы увеличивает его диффузионное сопротивление и уменьшает вероятность их доступа к стальной арматуре, т.е. снижает вероятность ее коррозии и «роста бетона».
Ко второй группе относят газы SO2,SO3,H2S. Особенностью их взаимодействия с бетонами является образование слаборастворимых солей кальция, способных при кристаллизации присоединять к себе значительное количество воды. Этот процесс сопровождается увеличением объема твердой фазы, что вызывает возникновение больших внутренних напряжений, которые могут не только снизить прочность бетона, но и вызвать его послойное разрушение, особенно при высокой влажности. Так при образовании гипса по реакции:
Са(ОН)2
+ SO3 →
CaSO4
![]() H2O,
(17.9)
H2O,
(17.9)
объем твердой фазы увеличивается в 2,2 раза.
Вследствие повреждения бетона, нейтрализации защитного слоя возникает опасность коррозии стальной арматуры и послойного разрушения конструкции в контакте с газами второй группы.
Газы третьей группы (HCl,Cl2,ClO2, пары брома), реагируя с гидроксидом кальция, образуют хорошо растворимые соли кальция, обладающие высокой гигроскопичностью. Образующиеся растворы солей (особенно при увлажнении бетона) способны проникать в объем бетона за счет капиллярного всасывания и за счет диффузии в жидкой фазе бетона, вызывая полное разложение цементного камня и послойное разрушение бетона. Коррозия арматуры в контакте с этими газами идет не только при нейтрализации защитного слоя бетона, но и по причине образования сильноагрессивных по отношению к стали хлористых солей. Ионы хлора разрушают стальную арматуру, вызывая ее коррозионное растрескивание.
Многие газовые среды, используемые или выделяющиеся в ходе осуществления технологических процессов в химической, нефтехимической промышленности, в металлургии, ядерной энергетике и других отраслях промышленности оказывают весьма агрессивное воздействие на силикатные материалы при высоких температурах, эффект которого возрастает с увеличением давления. К таким средам относятся водяной пар, оксиды углерода, углеводороды, водород, хлор, сероводород и другие газы. В результате силикатные материалы теряют механическую прочность, термостойкость, огнеупорность. Скорость разрушения силикатных материалов в газовых средах при высоких температурах и давлении зависит от химического состава и структуры материала, и от состава газа.
Под действием паров воды при температурах до 800 0С гидротации не происходит. Повышенной устойчивостью к действию паров воды при высоких температурах обладают силикаты на основе алюминатов, галлатов и индатов щелочноземельных металлов.
Сильнейшее агрессивное воздействие на силикатные материалы оказывает моноксид углерода СО. Под его воздействием восстанавливаются оксиды, входящие в состав огнеупоров, и осаждается сажистый углерод, который создает большие распирающие усилия в порах огнеупора. Этот процесс осуществляется по реакциям:
МеnOm + CO → MenOm-1 + CO2 (17.10)
2CO → CO2 + Cтв. (17.11)
Муллит (3Al2O3![]() 2SiO2),
составляющий основу шамотных огнеупоров,
также разрушается сажистым углеродом
с образованием летучего моноксида
кремнияSiO, приводящего
к растрескиванию материала:
2SiO2),
составляющий основу шамотных огнеупоров,
также разрушается сажистым углеродом
с образованием летучего моноксида
кремнияSiO, приводящего
к растрескиванию материала:
3Al2O3![]() 2SiO2
+ 2С → 3Al2O3
+ 2SiO + 2СО (17.12)
2SiO2
+ 2С → 3Al2O3
+ 2SiO + 2СО (17.12)
Реакция образования сажистого углерода катализируется в присутствии металлического железа и его оксидов.
Углеводороды метан, этан и природный газ также как и СО, осаждают сажистый углерод в присутствии катализаторов.
Замедлителями образования сажистого углерода являются вещества, содержащие медь, а также сульфиды и фосфаты. Наиболее устойчивыми к действию СО и углеводородов являются высокоглиноземистые огнеупоры. Оксид бериллия совсем не взаимодействует с оксидами углерода.
В среде водорода восстанавливаются многие оксиды огнеупоров: Na2O, TiO2, MgO, SiO2 и др. Водород разлагает муллит с образованием корунда и моноксида кремния:
3Al2O3![]() 2SiO2+ Н2→Al2O3+SiO+ Н2О (17.13)
2SiO2+ Н2→Al2O3+SiO+ Н2О (17.13)
Не устойчивы к действию водорода и плавленные силикаты при температурах свыше 1100 0С. в этом случае водород восстанавливает кремнезем до моноксида кремния с образованием паров воды:
SiO2+ Н2→SiO+ Н2О (17.14)
Стабильностью к действию водорода обладают высокоглиноземистые (с содержанием Al2O3 85% и выше) и корундовые огнеупоры.
Хлор разрушает многие огнеупоры, т.к. с большинством тугоплавких оксидами дает легкоплавкие или летучие соединения, испарение которых вызывает снижение прочности материала. К действию хлора устойчивы высокоглиноземистые и корундовые огнеупоры.
17.3.3. Взаимодействие полимеров с газами
Разрушение полимеров под действием внешних факторов (механические напряжения, температура, свет, ионизирующее излучение, химические вещества и др.), вызывающее разрыв химических связей в макромолекуле и приводящее к изменению свойств полимера, носит название деструкции. Различают физическую и химическую деструкцию в зависимости от воздействующих факторов. На практике одновременно протекают несколько реакций деструкции различного типа.
Применительно к взаимодействию полимеров с газовыми средами наибольшую опасность представляет воздействие тепла, кислорода и озона, которые вызывают термодеструкцию (воздействие только тепла) или термоокислительную деструкцию (действие кислорода и тепла). Полимеры подвергаются термоокислительной деструкции как в ходе их переработки в изделия, так и в процессе эксплуатации.
Устойчивость полимера к химическому разложению при повышении температуры определяет его термостойкость (термостабильность, термоустойчивость). Обычно указывается температура, выше которой происходит процесс термодеструкции (например, термостойкость до 120 0С). Есть термин «теплостойкость», который характеризует способность полимера сохранять при повышенных температурах твердость, обуславливающую работоспособность изготовленного из них изделия. Указывается верхний температурный предел эксплуатации.
Одним из важных факторов, определяющих термостойкость полимера, как и химическую устойчивость вообще, является энергия связи между атомами в главной цепи. Одной из наиболее устойчивых к термическим воздействиям является углерод – углеродная связь. Карбоцепные полимеры, имеющие в главной цепи связь С – С, являются более устойчивыми, чем гетероцепные полимеры, имеющие в основной цепи связь углерода с другими атомами, о чем свидетельствуют значения энергии связи:
Связь Значение энергии связи, кДЖ/моль
C –C 332
C – O 316
C – N 264
C – Si 228
На прочность связи С – С сильное влияние оказывает наличие заместителей в макромолекуле и степень ее разветвленности. Даже наличие атомов водорода в молекуле полимера сильно понижает энергию связи С – С и его термостойкость. Разветвленные полимеры также менее термостойки, чем неразветвленные. По мере увеличения числа заместителей в цепи энергия связи С – С сильно уменьшается. По этой причине полиэтилен более термостоек, чем полипропилен и полиизобутилен, имеющие метильные группы:
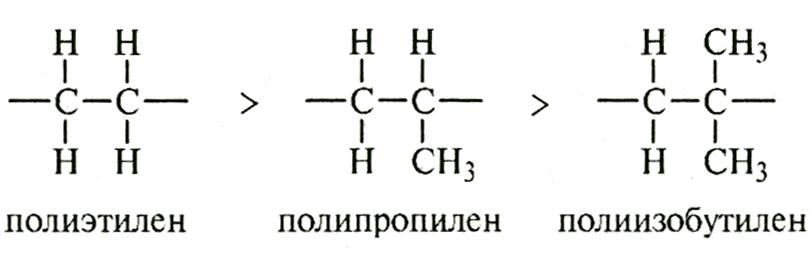
Однако не все заместители понижают термостойкость полимеров. При замещении атомов водорода на атомы хлора или фтора наблюдается эффект существенного повышения термостойкости:
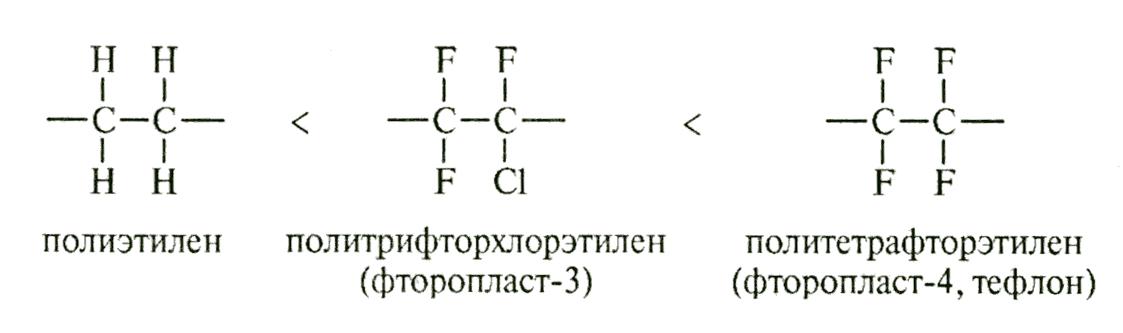
Термостойкость полиэтилена – 60 - 750С, фторопласта – 3 - 2300С, фторопласта – 4 - 3500С.
Устойчивость полимера к действию кислорода, озона и других окислителей зависит от его строения и, прежде всего, от наличия легкоокисляющихся групп и связей в макромолекуле. Из карбоцепных высокомолекулярных соединений окисляются ненасыщенные углеводороды, например натуральный и бутадиеновый каучуки. Окислительная деструкция протекает более интенсивно на свету и при нагревании.
Двойные ненасыщенные связи в главной цепи полимера более активны при окислении, чем двойные связи в боковых винильных группах. Озон сильно воздействует на натуральный каучук, что следует учитывать при эксплуатации изделий из него.
Карбоцепные насыщенные полимеры (полиэтилен, полипропилен, полистирол, полиизобутилен и др.) более устойчивы к окислению. Так, при умеренных температурах они практически не окисляются кислородом воздуха, а деструктурируют только при нагреве.
Хлор и фтор, введенные в полимер в качестве заместителей, делают его более устойчивым к действию окислителей. Наиболее устойчивым к действию всех окислителей является политетрафторэтилен (фторопласт-4) даже при нагреве до температуры 300 – 350 0С.
Гетероцепные
полимеры под влиянием окислителей
подвержены деструкции. В наибольшей
степени деструктурируют материалы,
имеющие ацетальные связи

Например, целлюлоза подвержена деструкции даже под воздействием кислорода воздуха.
Следует отметить, что во все выпускаемые промышленностью полимерные материалы вводятся различные стабилизаторы, повышающие их стойкость к действию света, тепла, кислорода и озона.
17.4.Взаимодействие неметаллических материалов с водой.
17.4.1.Физико-химическое воздействие воды на неметаллические материалы.
Уникальные физико-химические свойства воды предопределяют своеобразие и различные формы ее взаимодействия с неметаллическими материалами.
Размер молекулы воды составляет 0,29 нм (2,9 Å), что сопоставимо с размерами пор и дефектов большинства неметаллических материалов. Это обуславливает ее достаточно высокую проникающую способность, особенно в пористые силикатные материалы и композиты.
Молекулы воды способны участвовать в образовании связей, как между собой, так и с другими молекулами. Благодаря тому, что молекула воды может участвовать в четырех водородных связях, в ее жидком состоянии возможно возникновение пространственных структур. Это является причиной образования «кластеров» - агрегатов, состоящих из 50 – 60 молекул воды. Наличие в воде водородных связей сообщает ей свойство хорошего растворителя.
Молекула воды поляризована и имеет дипольный момент 1,84 D. Из-за этого, вода, попадая в силовое поле, способна ориентироваться относительно заряда поля, в результате чего возникает явление гидратации. Неполярные вещества также оказывают влияние на структуру прилегающей воды и за счет гидрофобных взаимодействий и водородных связей создают организованные структуры воды, называемые «айсбергами».
Все отмеченные свойства воды в той или иной мере влияют на характер переноса воды в неметаллических материалах, на растворение в ней других веществ (например, газов), вызывают появление внутренних напряжений в материале или понижение поверхностного натяжения, – все это негативно сказывается на его эксплуатационных характеристиках.
Взаимодействие неметаллических материалов с водой начинается с ее адсорбции на поверхности материала. Количество адсорбируемой воды определяется полярностью веществ, образующих материал. Силикатные материалы, состоящие из полярных оксидов, особенно щелочных и щелочно-земельных металлов, адсорбируют большое количество воды, образующей на поверхности полимолекулярный слой. Подобная многослойная адсорбция воды возможна и на полярных полимерах, содержащих полярные группы (ОН-, СООН-и др.). На неполярных полимерах адсорбированная на поверхности вода образует вначале мономолекулярный слой. Адсорбированные молекулы воды находятся на поверхности в непрерывном движении и при наличии градиента концентрации могут диффундировать по поверхности, передвигаясь от одного центра адсорбции к другому. Поверхностная диффузия играет важную роль в процессах смачивания и разрушения неметаллических материалов во влажной среде, инициируемого механическими растягивающими напряжениями. Адсорбированные молекулы воды помогают перестройке и способствуют разрыву межатомных и межмолекулярных связей в неметаллических материалах, облегчая их деформирование и разрушение под действием внешних сил, проявляя тем самым эффект адсорбционного понижения прочности.
Способность материала смачиваться водой зависит от соотношения сил взаимодействия молекул воды с материалом (адгезия) и сил взаимодействия молекул воды между собой (когезия). Если силы взаимодействия молекул воды с материалом выше сил когезии, то вода будет хорошо смачивать такой материал. В этом случае степень смачивания будет существенно зависеть от микрогеометрии поверхности материала (ее дефектности) и наличия открытой пористости в материале. Если на поверхности материала имеются дефекты структуры, соизмеримые с диаметром молекулы воды (0,29 нм), то молекулы воды могут внедриться в объем материала и при наличии такой же пористости (дефектности) в объеме материала будут диффундировать по механизму активированной диффузии, аналогично диффузии газов. Силикатные стекла способны вполне свободно поглощать пары воды, т.к. размер дефектов в них находится в пределах от 0,7 до 1,7 нм.
Но более всего молекулярное растворение и диффузия воды характерны для полимерных материалов, которые за счет адсорбции способны поглощать заметное количество влаги. Особенностью молекулярного растворения и диффузии воды в полимерах является агрегирование ее молекул в объеме материала. Этот процесс протекает по двум механизмам и определяется наличием в материала гидрофильных (полярных) центров. В неполярных полимерах (полиэтилен, полипропилен, фторопласты) при отсутствии полярных примесей происходит ассоциация воды в кластеры, которые могут образовывать упорядоченные структуры размером в 1 – 2 мкм, создавая гетерофазные области в полимере. При наличии гидрофильных примесей в таких неполярных полимерах ассоциация воды происходит около них до установления равновесного состояния по всему объему материала. У полярных полимеров ассоциация воды происходит у их гидрофильных групп по механизму образования гидратных оболочек.
Вне зависимости от формы связывания воды в процессе растворения и диффузии, ее молекулы, вошедшие в кластеры или ассоциаты, становятся менее подвижными и их участие в процессе переноса крайне ограничено.
Таким образом, при оценке защитных свойств полимерных материалов, нанесенных, например, на металлическую поверхность, необходимо учитывать наличие свободной и связанной воды. Свободная вода более подвижна, находится преимущественно в молекулярном виде и обеспечивает диффузионную водопроницаемость. Связанная (локализованная) вода вызывает пластификацию полимера, возникновение влажностных напряжений, осмотического давления и других физических явлений, способных создать в определенных условиях механическое разрушение материала. Наиболее интенсивно локализация воды в неметаллах идет при относительной влажности более 75%.
При наличии в неметаллических материалах дефектов диаметром 100 – 200 нм пары воды адсорбируются на стенках таких капилляров, заполняя их влагой за счет капиллярного поднятия. Вода, заполняющая капилляры за счет капиллярной конденсации и капиллярного поднятия, не переносится в таких капиллярах, а может только испаряться с их противоположной стороны или диффундировать через стенки капилляров в водопроницаемую матрицу.
Неметаллические материалы с протяженными дефектами диаметром менее 100 нм при обычных гидростатических напорах непроницаемы для воды.
Когда диаметр пор достигает величины 20 103нм, водопроницаемость становится чувствительной к гидростатическому напору, и транспорт ее подчиняется законам вязкого течения. Количество переносимой воды Q за времяпо Пуазейлю равен:
Q=
![]() , (17.15)
, (17.15)
где
![]() - плотность жидкость,
- плотность жидкость,
![]() - динамическая
вязкость,
- динамическая
вязкость,
dиl- диаметр и длина капилляра,
n- число капилляров на единицу поверхности,
