
- •Роль физики пласта в современных технологиях углеводородоизвлечения
- •Связь физики пласта с науками
- •3. Роль в создании новых технологий.
- •4 Научные и практические задачи, решаемые физикой пласта.
- •5. Физическое свойство пласта.
- •6. Методы изучения физических свойств пласта
- •7 .Физико-технологическое свойство см. Вопрос №5.
- •12 Природные и технологические условия существования нефтегазового пласта.
- •15. Типы коллекторов нефти и газа.
- •37 Понятие проницаемости (характеристика и физический принцип измерения)
- •42 Относи.Тельные фазовые проницаемости пластов, совместное движение несмешивающихся флюидов в пористой среде и области их использования
- •54. Перечислите основные фильтрационные и емкостные свойства нефтегазовых пластов, дайте понятие анизотропии нефтегазового пласта
- •57 Понятие напряжений и деформаций в нефтегазовых пластах
- •58. Первичные и вторичные напряжения, их связь с условиями залегания пластов и технологическими факторами.
- •59. Понятие нормальных и касательных напряжений, тензор напряжений.
- •61. Виды напряженного состояния нефтегазовых платов, тензор напряжений.
- •63. Зависимость деформаций от напряжений, упругие и пластические деформации.
- •65. Обобщенный закон Гука и область его существования.
- •67 .Понятие истинных и эффективных напряжений в нефтегазовых пластах. Связь эффективных напряжений с внутрипластовым давлением.
- •1 . Волновые процессы в нефтегазовых пластах, их общая характеристика и роль в нефтепромысловом деле.
- •2. Деформации при колебательных и динамических нагрузках (специфика проявления и отличительные черты).
- •3.4 Частотная характеристика волн в нефтегазовых пластах, характерные длины волн.
- •5. Типы волн в нефтегазовых пластах
- •9. Явление поглощения упругих волн и коэффициенты, характеризующие поглощение.
- •10. Явления отражения волн и их преломления. Коэффициенты, характеризующие эти явления.
- •12 . Природные и техногенные тепловые процессы в нефтегазовых пластах
- •17. Тепловые свойства нефтегазового пласта
- •19. Теплопроводность и температуропроводность минералов и нефтегазовых пластов. Явление анизотропии теплопроводности
- •22 Типы залежей по состоянию углеводородных систем
- •23 Состав и классификация нефтей
- •Состав и классификация природных газов
- •Идеальные и природные газы
- •31. 32. Парциальное давление, закон Дальтона
- •33. Уравнение состояния идеальных газов, коэффициент сверхсжимаемости.
- •34. Уравнение Ван-дер-Вальса и его физический смысл.
- •35. Приведенные и критические параметры газов и их смесей.
- •36.Зависимость коэффициента сверхсжимаемости природного газа от приведенного давления и температуры
- •Плотность природного газа и стабильного углеводородного конденсата
- •Вязкость газа и газовых смесей
- •Закон Генри
- •Ткр.Эксп. Ткр.Расч.
- •Аномальные жидкости.
36.Зависимость коэффициента сверхсжимаемости природного газа от приведенного давления и температуры
Приведенный параметр – это безразмерная величина, показывающая, во сколько раз параметры P,V, больше или меньше критических.

![]()
Плотность природного газа и стабильного углеводородного конденсата
Плотность газа. Чем больше в газе доля компонентов с высокой молекулярной массой, тем больше молекулярная масса газа, которая линейно связана с плотностью газа:
ρсм = Мсм/22,41
Обычно ρ находится в пределах 0,73 - 1 кг/м3. плотность индивидуальных компонентов углеводородных газов (и сероводорода), за исключением метана, больше 1.
Для характеристики плотности газа используют также ее отношение к плотности воздуха в тех же условиях (плотность воздуха при нормальных условиях составляет 1,293 кг/м3).
![]()
где
![]() -
относительная плотность газа; ρсм, ρв
– плотность газа и воздуха соответственно.
Связь между плотностью газа и его
молекулярной массой, давлением и
температурой определяется законом
состояния газов, который можно представить
в виде:
-
относительная плотность газа; ρсм, ρв
– плотность газа и воздуха соответственно.
Связь между плотностью газа и его
молекулярной массой, давлением и
температурой определяется законом
состояния газов, который можно представить
в виде:
![]()
Вязкость газа и газовых смесей
Вязкость газов. Вязкость газа зависит от его состава, давления и температуры. Вязкость газов обусловлена обменом количеством движения между слоями газа, движущимися с разными относительно друг друга скоростями. Этот обмен происходит за счет перехода молекул из одного слоя в другой при их хаотическом движении. Так как крупные молекулы обладают меньшей длиной свободного пробега (вероятность их столкновения между собой относительно велика), то количество движения, переносимое ими из слоя в слой, меньше чем небольшими по размерам молекулами. Поэтому вязкость газов с увеличением их молекулярной массы как правило уменьшается.
С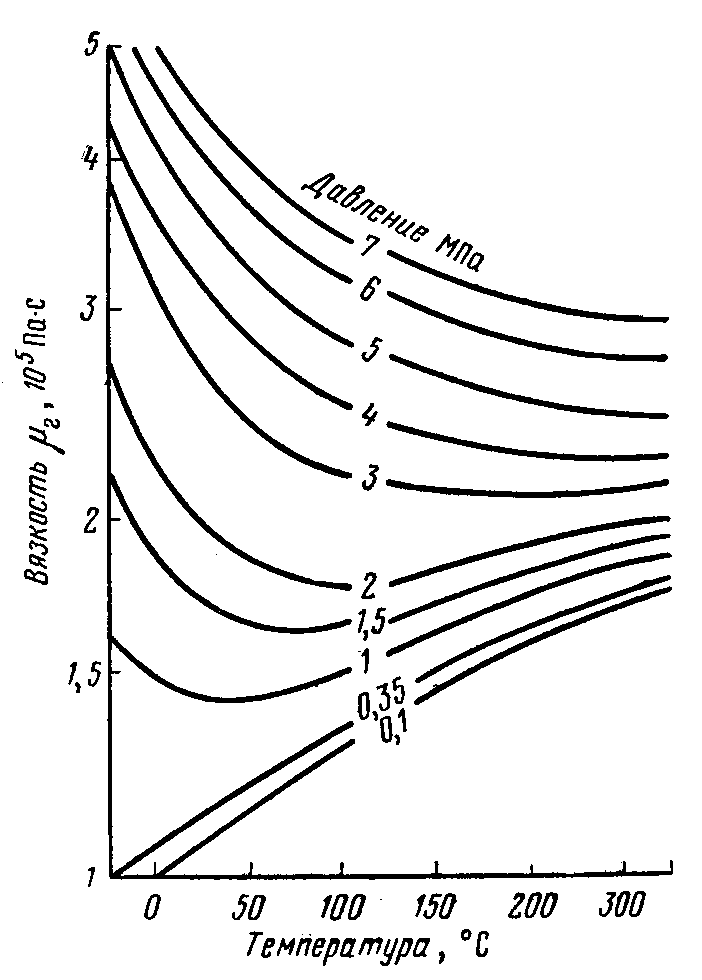 повышением температуры увеличивается
скорость движения молекул и соответственно
количество движения, переносимое ими
из слоя в слой, поэтому при невысоких
давлениях вязкость газа с повышением
температуры возрастает. При высоких
давлениях, когда расстояния между
молекулами невелики, несколько меняется
передача количества движения из слоя
в слой. Она происходит главным образом
как и у жидкостей за счет временного
объединения молекул на границе слоев,
движущихся с разными скоростями.
Вероятность такого объединения с ростом
температуры уменьшается. Поэтому при
высоких давлениях с ростом температуры
вязкость газов снижается.
повышением температуры увеличивается
скорость движения молекул и соответственно
количество движения, переносимое ими
из слоя в слой, поэтому при невысоких
давлениях вязкость газа с повышением
температуры возрастает. При высоких
давлениях, когда расстояния между
молекулами невелики, несколько меняется
передача количества движения из слоя
в слой. Она происходит главным образом
как и у жидкостей за счет временного
объединения молекул на границе слоев,
движущихся с разными скоростями.
Вероятность такого объединения с ростом
температуры уменьшается. Поэтому при
высоких давлениях с ростом температуры
вязкость газов снижается.
С увеличением давления вязкость газов возрастает: при низких давлениях незначительно и более интенсивно в области высоких давлений.
Вязкость газа определяют экспериментально, измеряя скорость течения его в капиллярах, скорость падения шарика в газе, затухание вращательных колебаний диска и другими методами. Изменение вязкости при различных давлениях и температурах можно определять расчетным путем и по графикам в зависимости от приведенных давления и температуры.
42. Уравнение состояния Пента-Робинсона.
43. Уравнение Пента-Робинсона относительно коэффициента сверхсжимаемости.
44. Использование уравнения Пента-Робинсона для описания отклонения теплофизических свойств природных и идеальных газов.
45. Упругость насыщенных паров углеводородов и их смесей.
Состояния углеводородных систем приобретают особую актуальность, т.к. находятся в области критических состояний, где имеют место фазовые превращения. Все уравнения, полученные на основе эксперимента, носят полуэмпирический характер. Решение задач, относящихся к добыче, транспорту и переработке газа, связано с уравнением Пенга-Робинсона (1975 г.):
Р=RТ/(v–в)=а(Т)/(v(v+в)+в(v-в)),
где а(Т), в – коэффициенты, определяющиеся критическими параметрами, причём а(Т) – некоторая функция. v – молекулярный объём.
z3 – (1 - В)z2+(А - 3В2 - 2В)z – (АВ – В2 – В3)=0,
где А=а(Т)Р/(R2Т2),
В=вР/(RТ)
Если смесь находится в двухфазном состоянии, то больший корень соответствует фазе пара, а меньший – жидкости. В критических условиях zкр=соnst – величина постоянная - и zкр=0.307. Тогда:
а(Ткр)=0.45724R2Ткр2/Ркр
в(Ткр)=0.0778RТкр/Ркр
Если температура отлична от критической, то эти коэффициент зависят от Ткр:
а(Т)=а(Ткр)(Ткр,);
в(Т)=в(Ткр), где - безразмерная функция.При Т=Ткр =1. Связь между и температурой (Т) можно записать следующим образом:
0.5=1+m(1 – Т0.5), m=f() ля смеси уравнение Пенга-Робинсона выглядит так:
асм(Т)=уiаi;
всм(Т)=уiвi, где аi и вi вычисляются по формулам:
аi=0.457(R2Ткрi2/Ркрi)i;
вi=0.0778RТкрi/Ркрi
