
- •1 Наука хімія та її предмет
- •2 Фундаментальні закони хімії
- •2.1 Закони стехіометрії
- •Закон сталості складу
- •Закон еквівалентів
- •Закон кратних відношень
- •2.2 Закони газового стану
- •Закон об'ємних відношень
- •Закон авогадро
- •Кінетична теорія газів
- •Виведення законів ідеального газу
- •3 Види хімічних формул
- •4 Закономірності перебігу хімічних реакцій
- •Класифікація хімічних реакцій
- •5 Енергетика хімічних реакцій основні поняття термодинаміки
- •Перший закон термодинаміки
- •Закони термохімії
- •Напрямленість перебігу хімічних реакцій
- •2.3.1. Можливість перебігу хімічних реакцій
- •Другий закон термодинаміки
- •Третій закон термодинаміки
- •Визначення характеру і напрямку хімічних реакцій
- •6 Дисперсні системи
- •Характеристика розчинів
- •Способи вираження складу розчинів
- •Розчинність речовин
- •Колігативні властивості розчинів
- •. Тиск пари розчинів
- •Температури замерзання та кипіння розчинів
- •Явище осмотичного тиску
- •7 Властивості розчинів електролітів
- •Теорія електролітичної дисоціації
- •Електрохімічні процеси
- •Хімічні процеси на електродах
- •Електродний потенціал
- •Електроліз
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •Корозія металів
- •8 Основні класи неорганічних сполук
- •Принципи класифікації неорганічних сполук
Закон об'ємних відношень
У хімічних реакціях з участю газуватих реагентів і (або) продуктів об'єм реакційної суміші на відміну від її маси може змінюватися. Зміна об'єму кожного газу підлягає певним закономірностям.
Об'ємні співвідношення в хімічних реакціях між газами визначає закон об'ємних відношень (Гей-Люссак, 1808): у хімічних реакціях об'єми газуватих речовин (реагентів і продуктів) відносяться між собою як невеликі цілі числа. Наприклад, з одним об'ємом кисню реагують два об'єми діоксиду Сульфуру з утворенням двох об'ємів триоксиду Сульфуру, тобто їхні об'ємні співвідношення дорівнюють 1:2:2.
Закон Гей-Люссака не уточнює, у вигляді яких частинок (атомів чи молекул) реагують одноелементні гази. В той час вважали, що гази складаються з атомів, оскільки розміри атомів різних газів неоднакові, то й число атомів у рівних об'ємах різних газів повинно бути різним. Це суперечило експериментальним спостереженням. Протиріччя було усунене лише після того, як виявилось, що багато газів складається з двохатомних молекул.
Закон авогадро
Одним з основних газових законів є закон Авогадро, сформульований спочатку як гіпотеза (1811): у рівних об'ємах будь-яких газів за однакових умов міститься однакова кількість молекул. Згідно з законом, кількість молекул, а отже, і кількість газу п повинна бути пропорційна об'єму газу V:
n = kV (при сталих р і Т),
де k — коефіцієнт пропорційності, що залежить від тиску та температури. Для двох різних станів одного й того ж газу матимемо:

Погляди Авогадро не відразу були прийняті хіміками, оскільки на той час у хімії панували погляди Берцеліуса про електрохімічний дуалізм речовин. Існувала думка, що можуть сполучатись тільки атоми з різними зарядами. Лише завдяки працям Канніц-царо (1860) закон Авогадро був визнаний. Авогадро встановив логічний зв'язок між емпіричним законом Гей-Люссака, з одного боку, і атомною теорією Дальтона — з другого. Він пояснив уже відомі факти, які привели до відкриття закону об'ємних відношень, обгрунтував поняття про молекулу, дав змогу визначити склад молекул і основну їхню характеристику — молекулярну масу.
Із закону Авогадро можна зробити щонайменше три висновки, корисні для кількісних розрахунків:
Оскільки моль будь-якої речовини містить однакове число структурних частинок (NA = 6,02 • 1023 моль -1), то їхні об'єми в газуватому стані за однакових умов будуть однаковими. За нормальних умов (н.у.) — р0 = 1,01 • 105 Па, То = 273,15 К — молярний об'єм різних газів становить 22,4 л/моль. Зокрема, відомо, що маса 1 л кисню за н.у. дорівнює 1,42 г, звідки

Знаючи число Авогадро і молярну масу, можна обчислити абсолютні маси атомів і молекул. Маса одного атома Гідрогену

Маси однакових об'ємів різних газів за однакових умов відносяться як їхні молярні маси
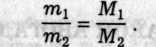
Ці відношення називають відносною густиною d першого газу за другим (відомим).
Оскільки густина газу р = М/Ут, то нормальна густина газу
![]()
а кількість речовини, що міститься в даному об'ємі газу,
![]()
Розглянуті закони, як і інші закони газового стану, були встановлені емпірично, але їх можна вивести з кінетичної теорії газів.
