
- •1 Наука хімія та її предмет
- •2 Фундаментальні закони хімії
- •2.1 Закони стехіометрії
- •Закон сталості складу
- •Закон еквівалентів
- •Закон кратних відношень
- •2.2 Закони газового стану
- •Закон об'ємних відношень
- •Закон авогадро
- •Кінетична теорія газів
- •Виведення законів ідеального газу
- •3 Види хімічних формул
- •4 Закономірності перебігу хімічних реакцій
- •Класифікація хімічних реакцій
- •5 Енергетика хімічних реакцій основні поняття термодинаміки
- •Перший закон термодинаміки
- •Закони термохімії
- •Напрямленість перебігу хімічних реакцій
- •2.3.1. Можливість перебігу хімічних реакцій
- •Другий закон термодинаміки
- •Третій закон термодинаміки
- •Визначення характеру і напрямку хімічних реакцій
- •6 Дисперсні системи
- •Характеристика розчинів
- •Способи вираження складу розчинів
- •Розчинність речовин
- •Колігативні властивості розчинів
- •. Тиск пари розчинів
- •Температури замерзання та кипіння розчинів
- •Явище осмотичного тиску
- •7 Властивості розчинів електролітів
- •Теорія електролітичної дисоціації
- •Електрохімічні процеси
- •Хімічні процеси на електродах
- •Електродний потенціал
- •Електроліз
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •Корозія металів
- •8 Основні класи неорганічних сполук
- •Принципи класифікації неорганічних сполук
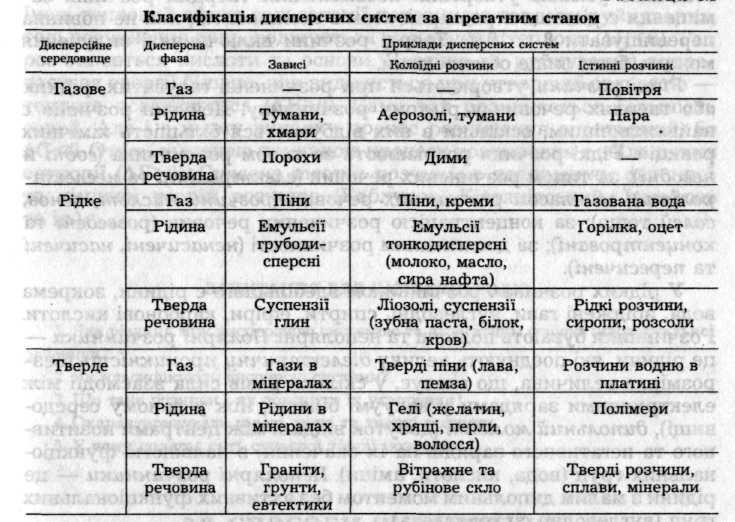
6 Дисперсні системи
Дисперсними називають системи, в яких одна із речовин у вигляді дуже дрібних частинок рівномірно розподілена в об'ємі іншої. Під дуже дрібними розуміють частинки, розмір яких умовно не перевищує 2 • І О3 нм. Мінімальний розмір частинок визначається розмірами молекул, атомів, іонів або радикалів диспергованої (подрібненої) речовини. Дисперговані речовини називають дисперсною фазою, а середовище, в якому вони перебувають,— дисперсійним середовищем. Властивості дисперсних систем, їх стійкість залежать від ступеня подрібненості дисперсної фази. Залежно від розмірів частинок дисперсної фази розрізняють: грубодисперсні системи, або зависі (мікрогетерогенні), з розміром частинок понад 100 нм; тонкодисперсні, або колоїдні (ультрамікрогетерогенні), з розміром частинок у межах 1...100 нм; істинні розчини (гомогенні) з розміром частинок (іонів, атомів або молекул) у межах 0,1 ...1 нм.
Залежно від агрегатного стану диспергованої речовини та середовища можливі 9 типів дисперсних систем.
Характеристика розчинів
У хімії найбільше значення мають розчини. Розчинами називають гомогенні термодинамічно стійкі рівноважні системи змінного складу з двох і більше компонентів. Той компонент, що кількісно переважає і зберігає свій агрегатний стан при утворенні розчину, прийнято вважати розчинником, інші компоненти — розчиненими речовинами. Розчини займають проміжне положення між механічними сумішами та хімічними сполуками. З першими їх поріднює несталість складу, з другими — однорідність, значні об'ємні й енергетичні ефекти та неподільність без зміни агрегатного стану. Розчини класифікують за розміром частинок (істинні й колоїдні) та за агрегатним станом розчинника й розчиненої речовини (газові, рідкі, тверді).
Газові розчини за звичайних тисків — це фізичні суміші, в яких кожний компонент виявляє притаманні йому індивідуальні фізичні та хімічні властивості. За високих тисків утворення газових розчинів супроводжується зміною об'єму та тепловим ефектом.
Тверді розчини — це однорідні кристалічні або аморфні тверді речовини змінного складу з двох (або більше) компонентів. Залежно від розміщення частинок розчиненої речовини в кристалічній грат-ці розчинника розрізняють тверді розчини: включення, коли частинки однієї речовини розміщуються в порожнинах між частинками іншої (наприклад, вуглець у залізі); заміщення, коли різні частинки статистично заміщують одна одну в гратці; вилучення, що характеризуються наявністю в структурі вакансій (дефектні структури). Тверді розчини бувають обмежені і необмежені , частково або повністю упорядковані, неупорядковані (зі статистичним розміщенням частинок).
Розчинність у твердому стані визначається характером хімічного зв'язку, подібністю фізико-хімічних властивостей та кристалічних ґраток і залежить від розмірного фактора — співвідношення розмірів атомів взаємодіючих компонентів. Необхідною, але недостатньою умовою утворення необмежених твердих розчинів заміщення є різниця в розмірах атомів компонентів, яка не повинна перевищувати 8 ... 15%. Тверді розчини включення і вилучення можуть бути лише обмеженими.
Рідкі розчини утворюються при розчиненні газуватих, рідких або твердих речовин у рідкому розчиннику. Цей тип розчинів є найважливішим, оскільки в них відбувається більшість хімічних реакцій. Рідкі розчини розрізняють за типом розчинника (водні й неводні); за типом розчинених речовин (електроліти та неелект-роліти); за класом розчинених речовин (розчини кислот, основ, солей тощо); за концентрацією розчинених речовин (розведені та концентровані); за досягненням розчинності (ненасичені, насичені та пересичені).
У рідких розчинах розчинником здебільшого є рідини, зокрема вода, зріджені гази, вуглеводні, спирти, ефіри, карбонові кислоти. Розчинники бувають полярні та неполярні. Полярні розчинники — це рідини, які поєднують велику діелектричну проникність (безрозмірна величина, що вказує, у скільки разів сила взаємодії між електричними зарядами у вакуумі більша, ніж у даному середовищі), дипольний момент (добуток віддалі між центрами позитивного та негативного зарядів на їх значення) з наявністю функціональних груп (вода, кислоти, аміни). Неполярні розчинники — це рідини з малим дипольним моментом без активних функціональних груп (вуглеводні, сірковуглець).
Утворення розчинів відбувається спонтанно аж до стану стійкої рівноваги. Фізична теорія розчинів (Вант-Гофф, Арреніус, 1884— 1887) розглядає процес розчинення як хаотичний розподіл частинок розчиненої речовини в індиферентному середовищі. Згідно з хімічною теорією розчинів (Менделєєв, 1887) між компонентами розчину відбувається хімічна взаємодія. Утворені сполуки називають сольватами (якщо розчинником є вода — гідратами), а процес їх утворення — сольватацією (гідратацією). Існування сольватів (гідратів) підтверджується виділенням відповідних сполук із розчинів у вигляді кристалосольватів або кристалогідратів. Утворення сольватів супроводжується зміною об'єму (контракція), забарвлення і певним енергетичним ефектом. Зміна ентальпії при розчиненні одного моля речовини називається ентальпією розчинення цієї речовини у даному розчиннику.
При утворенні розчинів ΔG<0, ΔН<>О і ΔS<>0, але при розчиненні газів ΔН<0 і ΔS'<0. Ентальпія розчинення (ΔН) дорівнює алгебричній сумі ендоефектів руйнування кристалічної ґратки, розриву зв'язків між атомами, руйнування структури розчинника (ΔH1>0), екзоефектів сольватації (ΔН2<0) та дифузії (ΔH3>0):
![]()
Іноді тепловий ефект сольватації перевищує теплоту руйнування, тоді розчинення супроводжується виділенням теплоти (ΔH<0). Так розчиняються кислоти та основи. Частіше на руйнування витрачається енергії більше, ніж виділяється при утворенні сольватів — теплота поглинається (ΔН>0). Саме так розчиняється більшість солей. Але і в цьому випадку процес розчинення спонтанний, бо ΔG<0. Отже, головною причиною процесу розчинення є збільшення ентропії (ΔS>0). Сучасна теорія розчинів є поєднанням фізичної та хімічної теорій розчинів (Каблуков, Кістяківський, Ізмайлов та ін.).
