
- •1 Наука хімія та її предмет
- •2 Фундаментальні закони хімії
- •2.1 Закони стехіометрії
- •Закон сталості складу
- •Закон еквівалентів
- •Закон кратних відношень
- •2.2 Закони газового стану
- •Закон об'ємних відношень
- •Закон авогадро
- •Кінетична теорія газів
- •Виведення законів ідеального газу
- •3 Види хімічних формул
- •4 Закономірності перебігу хімічних реакцій
- •Класифікація хімічних реакцій
- •5 Енергетика хімічних реакцій основні поняття термодинаміки
- •Перший закон термодинаміки
- •Закони термохімії
- •Напрямленість перебігу хімічних реакцій
- •2.3.1. Можливість перебігу хімічних реакцій
- •Другий закон термодинаміки
- •Третій закон термодинаміки
- •Визначення характеру і напрямку хімічних реакцій
- •6 Дисперсні системи
- •Характеристика розчинів
- •Способи вираження складу розчинів
- •Розчинність речовин
- •Колігативні властивості розчинів
- •. Тиск пари розчинів
- •Температури замерзання та кипіння розчинів
- •Явище осмотичного тиску
- •7 Властивості розчинів електролітів
- •Теорія електролітичної дисоціації
- •Електрохімічні процеси
- •Хімічні процеси на електродах
- •Електродний потенціал
- •Електроліз
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •Корозія металів
- •8 Основні класи неорганічних сполук
- •Принципи класифікації неорганічних сполук
Колігативні властивості розчинів
Властивості розчинів можуть залежати як від природи розчинених речовин (зміна кольору, густини, об'єму), так і від відносного числа частинок речовини в розчині. Властивості розчинів, які залежать тільки від концентрації й не залежать від природи розчинених речовин, називають колігативними. Закони колігатив-них властивостей дійсні лише для ідеальних розчинів (для них сили взаємодії між різнойменними частинками рівні -F(А-А) =F(В-В)=F(А-В) і ΔH = 0, ΔV = 0) і наближені для розведених. Властивості таких розчинів змінюються пропорційно числу розчинених частинок.
Тиск пари над розчинником за сталої температури — величина стала, бо одночасно з ендотермічним процесом випаровування відбувається зворотний екзотермічний процес конденсації (ΔG= 0). Рівноважний стан системи рідина—пара характеризується тиском насиченої пари.
Гетерогенні рівноваги в процесах переходу речовини з однієї фази в іншу, що не супроводжується зміною хімічного стану цієї речовини, називають фазовими рівновагами. Одним із загальних законів таких рівноваг є правило фаз Гіббса (1878), згідно з яким у рівноважній системі число фаз Ф, ступенів вільності С і незалежних компонентів К записують у вигляді співвідношення
С = К - Ф + 2.
Цифра 2 означає, що враховуються лише два інтенсивних параметри стану — температура й тиск. Якщо один з параметрів рівноваги постійний (сплави, солі), то
С = К - Ф + 1.
Рівновага системи залежить від умов (температури, тиску, концентрації). Число умов, які можна довільно змінювати в певних межах без зміни числа та виду фаз у системі, називають числом ступенів вільності. Графічне зображення залежності між різними величинами, що характеризують стан системи, називають діаграмою стану. На рис. 3.5 зображено діаграму стану води, де будь-якій точці відповідають певні значення температури та тиску. Наприклад, точка, якій відповідає рівновага між трьома фазами лід—рідина—пара, називається потрійною, де Ф = З, К = 1, С = 0. У потрійній точці перетинаються усі три криві, що відокремлюють фазові поля. Рівновага в ній можлива лише при тиску 0,6105 кПа (0,006 атм) і температурі 273,16 К (0,01 0С). Крива рівноваги рідина—пара, або крива кипіння закінчується в критичній точці, у якій зникає відмінність між рідиною та її парою. Крива рівноваги лід—рідина, прямуючи догори, зміщується вліво (лід плавиться). Цим вода відрізняється від більшості інших речовин, які при підвищенні тиску тверднуть. Температура плавлення (Тпл) і кипіння (Ткип) води при тиску р0 =101,325 кПа (1 атм) становить відповідно 273,15 К (0°С) і 373,15 К (100°С). Критичні параметри, які характеризують фізичні властивості рідини й пари, для різних речовин різні.

. Тиск пари розчинів
При розчиненні в рідині нелеткої речовини тиск насиченої пари над цією рідиною знижується, бо зменшення концентрації розчинника зумовлює порушення рівноваги системи рідина—пара. Згідно з принципом Ле Шательє, відбувається процес конденсації, що спричинює зниження тиску пари.
Залежність зниження тиску пари розчинів від їхньої концентрації виражається першим законом Рауля (1887): відносне зниження тиску насиченої пари розчинника над розчином дорівнює молярній частці розчиненої речовини:
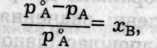
де Р 0а і Ра - тиск пари чистого розчинника (компонента А в бінарному розчині) і тиск пари цього розчинника над розчином; xB=nB/(nA+nB) — молярна частка розчиненої речовини (компонента В); nA, nB — кількості компонентів А і В у розчині.
Оскільки тиск пари над розчином менший, ніж над чистим розчинником (водою), крива кипіння для розчину розташована нижче, ніж для води (рис. 3.6). Здійснюємо перетворення: р0А —рА = Р°а * xB, pа = р°а — Р°а *xB = р°А(1 — xB), а (1 — хB) = хА, тоді рА=p°А *xA, де xА=nА/(nA+nB) - молярна частка компонента А і хА + хв = 1. Аналогічно для леткого компонента В одержуємо співвідношення. Таким чином, за даної температури тиск пари леткого компонента над розчином пропорційний його молярній частці в розчині.

Розглянемо залежність парціальних тисків рА і рв компонентів А і В від складу (рис. 3.7). Абсциса АВ, довжина якої дорівнює одиниці, зображує склад бінарного розчину в молярних частках. На ординатах відкладені тиски пари чистих розчинників. Верхня пряма зображує тиск пари розчину залежно від його складу:
![]()
Закон Рауля виведено для розчинів нелетких речовин у летких розчинниках. Якщо парціальним тиском розчиненої речовини не можна знехтувати, то закон Рауля залишається справедливим для розчинника. А для розчиненої речовини справедливий закон Генрі, згідно з яким розчинність леткої речовини пропорційна її парціальному тиску рА = к • хА. Константа к не має фізичного змісту тиску пари розчиненої речовини при х=1, оскільки закон Генрі справедливий виключно для дуже розведених
Таким чином, у дуже розведеному розчині парціальний тиск розчинника визначається законом Рауля, а парціальний тиск розчиненої речовини — законом Генрі. Поблизу ординати компонента А (розчинник) його парціальний тиск визначається законом Рауля, а парціальний тиск компонента В — законом Генрі. Поблизу ординати компонента В (розчинник) його парціальний тиск визначається законом Рауля, а парціальний тиск компонента А — законом Генрі. Закон Генрі має таке ж значення для розчиненої речовини, як закон Рауля для розчинника.
Властивості реальних розчинів відхиляються від ідеальних. Криві залежності тисків пари від складу розчину відображають поведінку реальних розчинів з позитивним
і негативним відхиленням від ідеальності (рис. 3.8).


Пунктиром показані залежності тисків компонентів від складу для ідеальних розчинів.
