
- •1 Наука хімія та її предмет
- •2 Фундаментальні закони хімії
- •2.1 Закони стехіометрії
- •Закон сталості складу
- •Закон еквівалентів
- •Закон кратних відношень
- •2.2 Закони газового стану
- •Закон об'ємних відношень
- •Закон авогадро
- •Кінетична теорія газів
- •Виведення законів ідеального газу
- •3 Види хімічних формул
- •4 Закономірності перебігу хімічних реакцій
- •Класифікація хімічних реакцій
- •5 Енергетика хімічних реакцій основні поняття термодинаміки
- •Перший закон термодинаміки
- •Закони термохімії
- •Напрямленість перебігу хімічних реакцій
- •2.3.1. Можливість перебігу хімічних реакцій
- •Другий закон термодинаміки
- •Третій закон термодинаміки
- •Визначення характеру і напрямку хімічних реакцій
- •6 Дисперсні системи
- •Характеристика розчинів
- •Способи вираження складу розчинів
- •Розчинність речовин
- •Колігативні властивості розчинів
- •. Тиск пари розчинів
- •Температури замерзання та кипіння розчинів
- •Явище осмотичного тиску
- •7 Властивості розчинів електролітів
- •Теорія електролітичної дисоціації
- •Електрохімічні процеси
- •Хімічні процеси на електродах
- •Електродний потенціал
- •Електроліз
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •Корозія металів
- •8 Основні класи неорганічних сполук
- •Принципи класифікації неорганічних сполук
8 Основні класи неорганічних сполук
Неорганічні сполуки за схожістю властивостей та будови поділяють на певні класи, що визначаються як кількісним і якісним складом, так і природою хімічного зв'язку.
Принципи класифікації неорганічних сполук
Хімічні сполуки розрізняють за відношенням щодо законів стехіометрії (постійного або змінного складу), за ефектом теплоутворення (екзотермічні та ендотермічні), за кількістю елементів, що входять до їх складу (бінарні, тернарні, тетрарні, пентарні), та за функціональними ознаками (кислоти, основи, солі тощо). Проте жоден з принципів класифікації не може претендувати на досконалість. Тому розглядаючи властивості, покладені в основу певної класифікації, користуються відповідним принципом.
Взаємозв'язок між найважливішими класами неорганічних речовин ілюструє класична схема (рис. 9.1).
Речовини поділяють на прості (гомосполуки) й складні (гете-росполуки). Прості речовини складаються з атомів одного елемента {метали, неметали та металоїди). їх склад завжди постійний. Проте явища алотропії й поліморфізму та наявність дефектів у реальних кристалах роблять залежними властивості простих речовин від їх хімічної і кристалохімічної будови. Із 110 відомих хімічних елементів 88 належать до металів і лише 22 — до неметалів. У періодичній системі метали розміщені у лівій нижній частині, причому межа (нечітка) переходить за діагональну лінію, проведену з лівого верхнього кута до правого нижнього. На межі між металами і неметалами розміщені елементи, у яких відсутня повна сукупність властивостей металів (Германій, Арсен, Стибій, Телур та ін.). їх називають напівметалами, або металоїдами.
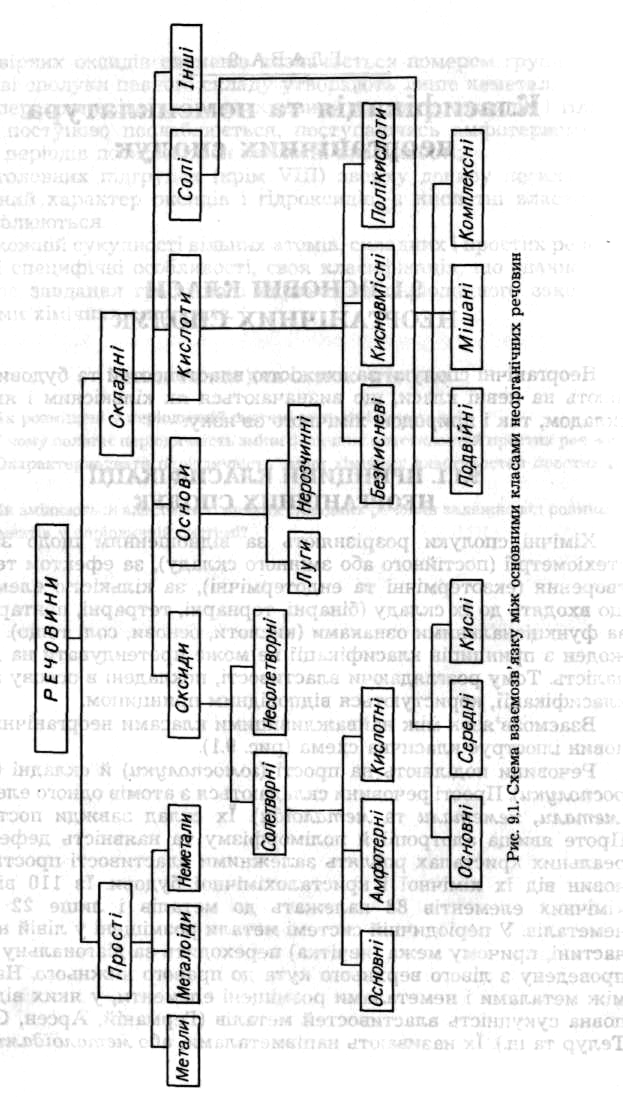
Складними речовинами називають продукти взаємодії атомів різних елементів. Найпростіші гетеро сполуки, що складаються з атомів двох видів, називають бінарними. Це — проміжні фази в двокомпонентних системах, утворених простими речовинами. Серед них зустрічаються сполуки як сталого, так і змінного складу. Сталий склад мають лише сполуки з молекулярною структурою. Сполуки з координаційною структурою завжди змінного складу (дальтоніди і бертоліди).
До бінарних належать сполуки різних елементів з Гідрогеном, Оксигеном, галогенами тощо: гідриди, оксиди, галогеніди (фториди, хлориди, броміди, іодиди, астатиди), халькогеніди (оксиди, сульфіди, селеніди, телуриди, полоніди), нітриди, фосфіди, арсеніди, стибіди, бісмутиди, карбіди, силіциди, германіди, бориди тощо. Особливе місце серед бінарних сполук займають сполуки з Оксигеном. За складом і властивостями їх поділяють на субоксиди, оксиди, пероксиди, супероксиди та озоніди.
Оксидами називають бінарні оксигенвмісні сполуки, в яких усі атоми Оксигену безпосередньо зв'язані з атомами більш електропозитивних елементів. Лише у оксидів співвідношення компонентів відповідає правилам валентності, а Оксиген має ступінь окислення -2. Усі інші сполуки елементів з Оксигеном — пероксиди, в яких ступінь окислення Оксигену дорівнює -1.
За хімічним характером оксиди поділяють на солетворні й несолетворні. Солетвірні оксиди, у свою чергу, відносять до основних, кислотних або амфотерних. Перші є оксидами металів, другі генетично пов'язані з неметалами. Амфотерність оксидів визначається не лише місцем елемента в періодичній системі, але й залежить від його ступеня окислення.
За функціональними ознаками бінарні сполуки поділяють на такі класи:
сольово-оснбвний — сполуки активних металів з неметалами (основні оксиди, сульфіди, галогеніди, нітриди, гідриди);
кислотний — сполуки багатовалентних металів і неметалів з активними неметалами (кислотні оксиди, галоген- і тіоангідриди);
амфотерний (амфотерні оксиди, галогеніди, сульфіди тощо);
ковалентно-оснбвний — сполуки з високою донорною функцією (типу амоніаку, гідразину, води);
елементоводневий (елементоводні НС1, H2S, HN3 тощо);
несольовий — координаційно насичені сполуки, що нездатні утворювати солі (ССІ4, SF6, OsO4 тощо);
металідний — сполуки металів з металами та неметалами, які виявляють металічні властивості (інтерметалічні сполуки, бориди, карбіди, силіциди тощо).
Складні гетеросполуки містять три і більше компонентів. Якщо бінарні сполуки є продуктами взаємодії простих речовин, то складні можна розглядати як продукти взаємодії бінарних сполук.
Важливу групу серед складних сполук становлять гідроксиди — продукти прямої або посередньої взаємодії оксидів з водою.
За теорією електролітичної дисоціації основи — це електроліти, які у водному розчині дисоціюють з утворенням одного типу аніонів — гідроксид-іонів. Числом гідроксидних груп, здатних заміщуватись на кислотні залишки з утворенням солей, визначають кислотність основ. Тому основи можуть бути однокислотні, наприклад КОН, двокислотні — Ва(ОН)2, трикислотні — La(OH)3, чотирикислотні — Th(OH)4.
За складом основи поділяють на прості та складні, або комплексні, що містять комплексний катіон. За розчинністю у воді — на розчинні й нерозчинні. Розчини основ називають лугами.
Як електроліти кислоти у водних розчинах дисоціюють, відщеплюючи лише один вид катіонів — іони Гідрогену.
Солі — це продукти повного чи часткового заміщення атомів Гідрогену у кислотах на атоми металів або гідроксидних груп в основних на кислотні залишки. За властивостями й складом солі поділяють на середні, кислі, основні, подвійні, мішані та комплексні.
Середні солі (нормальні) — це продукти повного заміщення атомів Гідрогену кислот на атоми металу (або групи атомів) чи гідроксогруп основ на кислотні залишки, наприклад K2SO4.
Кислі солі (гідросолі) утворюються внаслідок неповного заміщення атомів Гідрогену багатоосновних кислот на атоми металу, наприклад KHSO4.
Основні солі (гідроксосолі) розглядають як продукти неповного заміщення гідроксогруп багатокислотних основ кислотними залишками, наприклад Ві(ОН)2С1. До них відносять і оксосолі, наприклад ВіОСІ, утворені дегідратацією гідроксосолей.
Подвійні солі отримують шляхом заміщення атомів Гідрогену кислот на атоми двох металів, наприклад KNaSO4.
Мішані солі — продукти заміщення гідроксогруп багатокислотних основ різними кислотними залишками, наприклад Са(ОС1)С1.
