
- •1 Наука хімія та її предмет
- •2 Фундаментальні закони хімії
- •2.1 Закони стехіометрії
- •Закон сталості складу
- •Закон еквівалентів
- •Закон кратних відношень
- •2.2 Закони газового стану
- •Закон об'ємних відношень
- •Закон авогадро
- •Кінетична теорія газів
- •Виведення законів ідеального газу
- •3 Види хімічних формул
- •4 Закономірності перебігу хімічних реакцій
- •Класифікація хімічних реакцій
- •5 Енергетика хімічних реакцій основні поняття термодинаміки
- •Перший закон термодинаміки
- •Закони термохімії
- •Напрямленість перебігу хімічних реакцій
- •2.3.1. Можливість перебігу хімічних реакцій
- •Другий закон термодинаміки
- •Третій закон термодинаміки
- •Визначення характеру і напрямку хімічних реакцій
- •6 Дисперсні системи
- •Характеристика розчинів
- •Способи вираження складу розчинів
- •Розчинність речовин
- •Колігативні властивості розчинів
- •. Тиск пари розчинів
- •Температури замерзання та кипіння розчинів
- •Явище осмотичного тиску
- •7 Властивості розчинів електролітів
- •Теорія електролітичної дисоціації
- •Електрохімічні процеси
- •Хімічні процеси на електродах
- •Електродний потенціал
- •Електроліз
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •Корозія металів
- •8 Основні класи неорганічних сполук
- •Принципи класифікації неорганічних сполук
Способи вираження складу розчинів
Склад розчину можна виражати якісно й кількісно. Розчини з відносно низьким вмістом розчиненої речовини називають розведеними, а з відносно високим — концентрованими. Якісна оцінка досить умовна, бо для розчинів різних речовин ці поняття мають свої обмеження. Кількісний склад розчину визначається концентрацією.
Концентрація — це безрозмірна або розмірна величина, яка виражає співвідношення компонентів у системі. Для системи, що складається з розчинника та розчиненої речовини, концентрацією (не розчину, а розчиненої речовини) називають кількість розчиненої речовини, що міститься в певній кількості розчину або розчинника. Найчастіше застосовують такі способи вираження концентрації:
1. Молярна частка — відношення кількості даного компонента до загальної кількості всіх компонентів розчину:
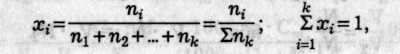
де ni — кількість i-го компонента (у молях).
Аналогічно визначають масову та об'ємну частки.
Масова (об'ємна) частка — відношення маси (об'єму) розчиненої речовини до загальної маси (об'єму) розчину:
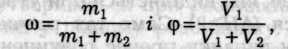
де т1 і m2 — маси, а V1 i V2 — об'єми розчиненої речовини та розчинника.
2. Молярність розчину — величина, що чисельно дорівнює молярній концентрації розчиненої речовини. Молярна концентрація — це відношення кількості розчиненої речовини до об'єму розчину V (у літрах):
![]()
Розчини однакової молярності (еквімолярні) реагують між собою в об'ємах, пропорційних стехіометричним коефіцієнтам у рівнянні реакції.
Моляльність розчину (моляльна концентрація) визначається відношенням кількості розчиненої речовини до маси розчинника (а не розчину!) в кілограмах:
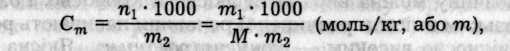
де m2/1000 — маса розчинника в кілограмах. Моляльність розчину, на відміну від його молярності, не залежить від температури.
4. Нормальність розчину — величина, що чисельно дорівнює молярній концентрації еквівалентів. Виражається відношенням еквівалентної кількості розчиненої речовини до об'єму розчину в літрах:
![]()
де Ет — молярна маса еквівалента розчиненої речовини.
Розчини однакової нормальності реагують у однакових об'ємах. У разі неоднакових нормальностей розчинів останні взаємодіють в об'ємах, обернено пропорційних їхнім нормальностям:
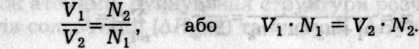
Нормальність і молярність розчинів збігаються для однокис-лотних основ та одноосновних кислот.
Молярну концентрацію еквівалентів розчиненої речовини можна уявити як відношення молярної концентрації до фактора еквівалентності fе цієї речовини в конкретній реакції Се = См/fе.
5. Титр — відношення маси розчиненої речовини в грамах до об'єму розчину в мілілітрах:
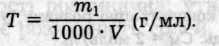
Розчин кожної речовини має певну густину р (г/мл, або кг/л), яку враховують при переході від масових концентрацій до об'ємних, і навпаки.
Розчинність речовин
Розчинністю речовини називають її здатність розчинятися у тому чи іншому розчиннику. Мірою розчинності речовини за певних умов є концентрація її у насиченому розчині. Тому чисельно розчинність можна виразити тими ж способами, що й концентрацію. Часто розчинність виражають також числом одиниць маси речовини у 100 одиницях маси розчинника в насиченому розчині і називають його коефіцієнтом розчинності δ.
Насичені розчини перебувають у стані рівноваги з надлишком речовини, що розчиняється (осадом). У ненасичених розчинах не досягнута межа насичення для певних зовнішніх умов. Пересичені розчини містять більше розчиненої речовини, ніж це зумовлено межею розчинення. Термодинамічно — це метастабільні (нестійкі) системи.
Розчинність залежить від природи розчинюваної речовини та розчинника, їх концентрації, температури. Для газів вона суттєво залежить ще й від тиску. Причини різної розчинності речовин на сьогодні не виявлені, хоч їх пояснюють характером взаємодії частинок розчинника та розчиненої речовини. Давно відоме правило, згідно з яким подібне розчиняється у подібному. Наприклад, речовини з іонним (солі, луги) або полярним (спирти, альдегіди) типом зв'язку краще розчиняються у полярних розчинниках (вода, спирти), а неполярні речовини — в неполярних розчинниках (бензол, сірковуглець).
Для передбачення розчинності неелектролітів використовують наближену теорію Гільдебрандта, згідно з якою взаємна розчинність речовин зростає зі зменшенням різниці їх параметрів розчинності δ:
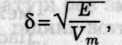
де Е і Vm — відповідно питома енергія випаровування та молярний об'єм чистого компонента.
Для електролітів відомі лише деякі емпіричні правила. Наприклад, розчинність багатьох електролітів зростає пропорційно кубу діелектричної проникності розчинника; утворення кристалосоль-ватів звичайно збільшує розчинність солей.
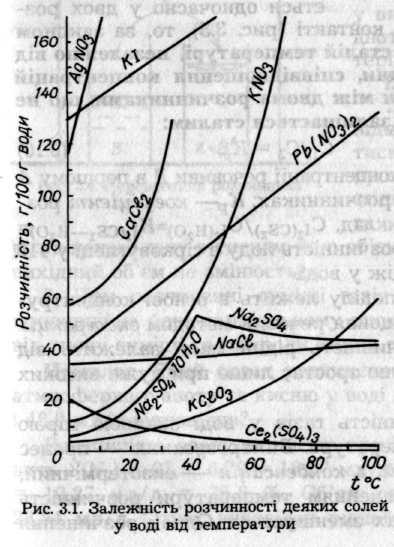
Розчинність різних твердих речовин у тому ж розчиннику змінюється в широких межах. Оскільки розчинення більшості твердих речовин супроводжується поглинанням теплоти, то за принципом Ле Шательє підвищення температури повинно зумовлювати збільшення розчинності. Якщо ж утворення розчину супроводжується виділенням енергії, то розчинність зі зростанням температури знижується (при розчиненні у воді лугів, багатьох солей Літію, Магнію, Алюмінію). У деяких випадках зниження розчинності зумовлене зміною характеру твердої фази, що насичує розчин. Залежність між розчинністю та температурою зображають графічно у вигляді кривих розчинності (рис. 3.1.). На основі кривих розчинності можна зробити висновок щодо доцільності очищення речовин від домішок перекристалізацією. Розчинність твердих речовин практично не залежить від тиску.
При взаємному розчиненні рідин спостерігаються такі випадки: необмежена розчинність (спирт—вода), практична нерозчинність (бензин—вода), обмежена розчинність (ефір—вода). Загалом з підвищенням температури взаємна розчинність
рідин збільшується доти, доки не буде досягнуто температури (критична температура розчинення К), за якої обмежена розчинність переходить у необмежену (рис. 3.2)
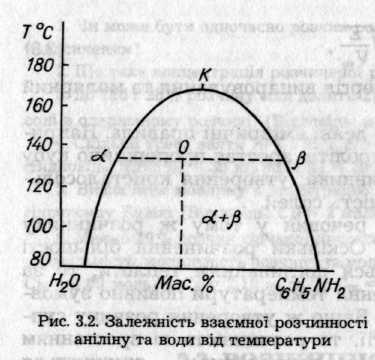
Конода (ізотермічна лінія, що сполучає співіснуючі фази) αβ ілюструє концентрацію речовин у насичених розчинах:α— аніліну у воді, β— води в аніліні. Правило важеля описує співвідношення мас рідин, що не розчиняються, в суміші певного складу:
Якщо речовина розчиняється одночасно у двох розчинниках, що перебувають у контакті (рис. 3.3), то, за законом розподілу (Нернст, 1890), при сталій температурі, незалежно від кількості розчиненої речовини, співвідношення концентрацій цієї речовини між двома розчинниками, що не змішуються, залишається сталим:
![]()
де С1 і С2 — концентрації речовини Д в першому А та другому В розчинниках; Кр— коефіцієнт розподілу.
Закон розподілу лежить в основі концентрування та очищення речовин методом екстракції. Взаємна розчинність рідин мало залежить від тиску й помітно зростає лише при дуже високих тисках.
На розчинність газів у воді значною мірою впливає температура. Випаровування — процес ендотермічний, а конденсація — екзотермічний, тому з підвищенням температури розчинність газів у рідинах зменшується. Однак розчинення газів в органічних рідинах часто супроводжується поглинанням теплоти, тому у цьому випадку з підвищенням температури розчинність газів зростає.
Кип'ятіння розчину дає змогу практично повністю позбутись розчинених у рідині газів. Але азеотропні суміші не розділяються за температурами кипіння, оскільки киплять при сталій температурі без зміни складу.
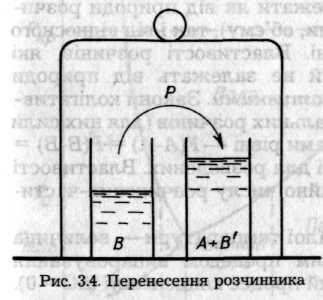
При розчиненні газу в рідині встановлюється рівновага між газом і його розчином (ΔG= 0), при цьому об'єм системи істотно зменшується. Якщо тепер підвищити тиск (ΔG<0), то це приведе до зміщення рівноваги в бік збільшення розчинності й перенесення розчинника (рис. 3.4), де В — розчинник; А — розчин; В' — перенесений розчинник; Р — пара розчинника; п(В)>п(В'). Отже, з цього випливає висновок, відомий як закон розчинності газів (Генрі, 1802): кількість газу, що розчиняється за сталої температури у певному об'ємі розчинника, пропорційна його тискові: S=К* р, де S- розчинність газу; К — константа, яка залежить від природи газу, розчинника та температури. Закон справджується для розведених розчинів, а також у випадку, коли гази не взаємодіють з розчинником, що спостерігається при низьких тисках.
Висновки із закону Генрі:
1. Об'єм розчиненого газу, на відміну від маси, не залежить від тиску. Це пояснюється оберненою пропорційністю тиску та об'єму згідно зі законом Бойля—Маріот-та: при збільшенні концентрації розчиненого газу з тиском його об'єм пропорційно зменшується, а вихідний об'єм не змінюється.
2. При розчиненні суміші газів розчинність кожного з них пропорційна його парціальному тиску над рідиною і не залежить від тиску суміші та природи інших газів (Дальтон, 1803).
