
- •Учебно-методический комплекс,
- •1 Применение основных газовых законов для расчета характеристик веществ
- •1.1 Законы идеального газа
- •1.1.1 Закон Бойля-Мариотта
- •1.1.2 Законы Гей-Люссака и Шарля
- •1.1.3 Закон Авогадро
- •1.1.4 Уравнение Менделеева — Клапейрона
- •1.1.5 Закон Дальтона
- •1.1.6 Закон объемных отношений Гей-Люссака
- •1.1.7 Определение молекулярных масс газообразных веществ
- •2 Расчеты по эквивалентам, законам эквивалентов и атомной теплоемкости
- •2.1 Общие положения
- •2.2 Определение эквивалентов сложных веществ
- •2.3 Определение эквивалентов простых веществ
- •2.4 Расчет количества реагирующих веществ по эквивалентам
- •2.5 Расчеты по закону эквивалентов совместно с законом атомной теплоемкости
- •3 Вывод химических формул по весовому составу вещества
- •4 Расчеты по химическим формулам
- •5 Составление структурных формул
- •6 Расчеты по химическим уравнениям
- •6.1 Общие сведения
- •6.2 Расчет по данным стехиометрии
- •58,5 Г NaCl реагирует с 170 г AgNo3
- •143,5 Г AgCl выпадает из 170 г AgNо3
- •2 Валентных электрона
- •7 Валентных электронов
- •8 Химическая связь
- •Гибридизация орбиталей и пространственная конфигурация молекул представлены в таблице.
- •9 Термохимия. Кинетика
- •Растворы
- •10.1 Общие свойства растворов
- •10.2 Свойства растворов электролитов
- •11 Окислительно-восстановительные процессы
- •Решение. Определяем степени окисления n и s в уксусных соединениях
- •Решение. На катоде из двух возможных процессов
- •Решение. На катоде будет восстанавливаться медь, т.К. Потенциал процесса
1.1.5 Закон Дальтона
Сформулирован этот закон так: общее давление смесей газов, не реагирующих друг с другом, равно сумме парциальных давлении составных частей (компонентов).
P = p1 + p2 + p3 + ….. + pn (14)
где Р — общее давление смеси газов; p1, p2, p3, …., pn – парциальные давления компонентов смеси.
Парциальным давлением называется давление, оказываемое каждым компонентом газовой смеси, если представить этот компонент занимающим объем, равный объему смеси при той же температуре. Иными словами, парциальным давлением называется та часть общего давления газовой смеси, которая обусловлена данным газом.
Из закона Дальтона следует, что при наличии смеси газов п в уравнении (12) представляет собой сумму числа молей всех компонентов, образующих данную смесь, а Р— общее давление смеси, занимающей при температуре Т объем V.
Зависимость между парциальными давлениями и общим выражается уравнениями:
![]() ;
;
![]() ;
;
![]() (15а) ,
(15а) ,
где n1, n2 , n3 — число молей компонента 1, 2, 3, соответственно, в смеси газов.
Отношения
![]() называются мольными долями данного
компонента.
называются мольными долями данного
компонента.
Если мольную долю обозначить через N, то парциальное давление любого i-го компонента смеси (где i = 1,2,3,...) будет равно:
![]() (15б)
.
(15б)
.
Таким образом, парциальное давление каждого компонента смеси равно произведению его мольной доли па общее давление газовой смеси.
Помимо парциального давления у газовых смесей различают парциальный объем каждого из газов v1, v2, v3 и т. д.
Парциальным называют объем, который занимал бы отдельный идеальный газ, входящий в состав идеальной смеси газов, если бы при том же количестве, он имел давление и температуру смеси.
Сумма парциальных объемов всех компонентов газовой смеси равна общему объему смеси
V = v1, + v2 + v3 + ... + vn (16) .
Отношение
![]() и т. д. называется объемной долей первого,
второго и т.д. компонентов газовой смеси.
Для идеальных газов мольная доля равна
объемной доле. Следовательно, парциальное
давление каждого компонента смеси
равно также произведению его объемной
доли на общее давление смеси.
и т. д. называется объемной долей первого,
второго и т.д. компонентов газовой смеси.
Для идеальных газов мольная доля равна
объемной доле. Следовательно, парциальное
давление каждого компонента смеси
равно также произведению его объемной
доли на общее давление смеси.
![]() ;
;
![]() ; pi
= riP
(17).
; pi
= riP
(17).
Парциальное давление обычно находят из величины общего давления с учетом состава газовой смеси. Состав газовой смеси выражают в весовых процентах, объемных процентах и в мольных процентах.
Объемным процентом называется объемная доля, увеличенная в 100 раз (число единиц объема данного газа, содержащегося в 100 единицах объема смеси)
![]() ;
;
![]()
Мольным процентом q называется мольная доля, увеличенная в 100 раз.
![]() ;
;
![]()
Весовой процент данного газа — число единиц массы его, содержащихся в 100 единицах массы газовой смеси.
![]() ;
;
![]()
где m1, m2 – массы отдельных компонентой газовой смеси; m – общая масса смеси.
Для перехода от объемных процентов к весовым, что бывает необходимым в практических расчетах, пользуются формулой:
![]() (18)
,
(18)
,
где ri(%) — объемное процентное содержание i-гo компонента газовой смеси; Mi —молекулярная масса этого газа; Мср - средняя молекулярная масса смеси газов, которую вычисляют по формуле
Мср = М1r1 + M2r2 + M3r3 + ….. + Miri (19)
где М1, M2, M3, Mi — молекулярные мaccы отдельных газов.
Если состав газовой смеси выражен количеством масс отдельных компонентов, то среднюю молекулярную массу смеси можно выразить по формуле
 (20)
,
(20)
,
где
G1,
G2,
G3,
Gi
– доли масс газов в смеси:
![]() ;
;
![]() ;
;
![]() и т.д.
и т.д.
Пример 14. 5 л азота под давлением 2 атм, 2 л кислорода под давлением 2,5 атм и 3 л углекислою газа под давлением 5 атм перемешаны, причем объем, предоставленный смеси, равен 15 л. Вычислить, под каким давлением находятся смесь и парциальные давления каждого газа.
Решение
Азот, занимавший объем 5 л при давлении Р1 = 2 атм, после смешения с другими газами распространился в объеме V2 = 15 л. Парциальное давление азота рN2 = Р2 находим из закона Бойля-Мариотта (P1V1 = P2V2). Откуда
![]()
Парциальное давления кислорода и углекислого газа находим аналогичным способом:
![]() ;
;
![]()
Общее
давление смеси равно
![]() .
.
Пример 15. Смесь, состоящая из 2 молей водорода, некоторого количества молей кислорода и 1 моля азота при 20°С и давлении 4 атм, занимает объем 40 литров. Вычислить число молей кислорода в смеси и парциальные давления каждого из газов.
Решение
Из уравнения (12) Менделеева-Клапейрона находим общее число молей всех газов, составляющих смесь
![]() ;
;
![]()
Число молей кислорода в смеси равно
![]() ;
;
![]()
Парциальные давления каждого из газов вычисляем по уравнениям (15а):
![]() ;
;
![]() ;
;
![]()
Пример 16. Смесь газов имеет следующий объемный состав: водорода — 3%, двуокиси углерода — 11%, окиси углерода — 60%. Вычислить парциальные давления составляющих смесь газов, если общее давление газовой смеси равно 1 атм. Определить массу 80 м3 этом смеси при данном давлении и температуре 15ºС.
Решение
Парциальные давления отдельных газов в смеси можно вычислить, используя уравнение (17) pi = riP :
![]() ;
;
![]() ;
;
![]() ;
;
![]()
Для определения массы газовой смеси вначале определяем ее среднюю молекулярную массу по формуле (19)
![]()
Мср = 20,03 + 440,11 + 280,26 + 280,60 = 28,98 .
Используя уравнение (13), находим
![]() ,
откуда
,
откуда
![]()
Пример 17. Состав паров бензольных углеводородов над поглотительным маслом в бензольных скрубберах, выраженный в единицах массы, характеризуется такими величинами: бензола C6H6 — 73%, толуола С6Н5СН3 - 21%, ксилола С6Н4(СН3)2 — 4%, триметилбензола С6Н3(СН3)3 — 2%. Вычислить содержание каждой составной части по объему и парциальные давления паров каждого вещества, если общее давление смеси равно 200 мм рт. ст.
Решение
Для вычисления содержания каждой составной части смеси паров по объему используем формулу (18)
![]() .
.
Следовательно, необходимо знать Мср , которую можно вычислить из формулы (20):
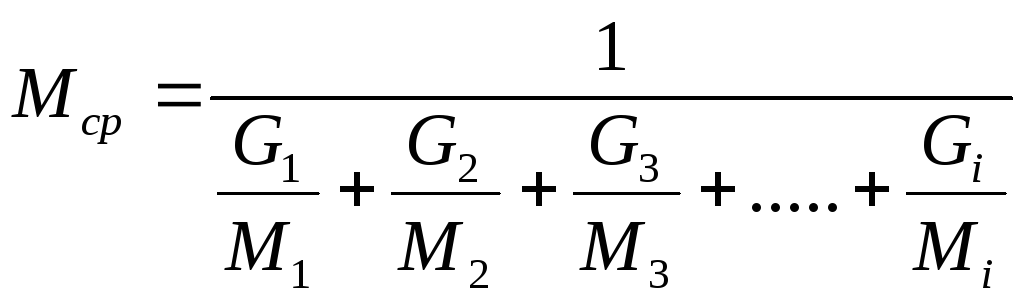 .
.
Тогда

Содержание каждой составной части смеси паров в объемных процентах равно
![]() ;
;
![]() ;
;
![]() ;
;
![]()
Парциальные давления каждого компонента в смеси вычисляем, используя уравнение (17)
pбензола = 0,7678200 = 153,56 мм рт.ст. ; pтолуола = 0,1875200 = 37,50 мм рт.ст. ;
pксилола = 0,0310200 = 6,20 мм рт.ст. ; pтриметилбензола = 0,0137200 = 2,74 мм рт.ст.
