
- •Министерство образования и науки
- •Содержание
- •К решению задач и выполнению контрольной работы
- •Список литературы
- •1. Молекулярная физика
- •1.1. Примеры решения задач.
- •Окончательно
- •Из него
- •С учетом последнего соотношения, для молярной массы смеси имеем
- •1.2. Внутренняя энергия и теплоемкости идеального газа
- •1.2. Примеры решения задач
- •1.3. Функции распределения
- •1.3. Примеры решения задач
- •Данное уравнение является общей формой записи закона распределения скоростей молекул, справедливой для любых интервалов скоростей.
- •1.4. Фазы и условия равновесия фаз. Реальные газы
- •В связи с этим, для реальных газов, Ван-дер-Ваальс предложил
- •1.4. Примеры решения задач
- •После сокращений на a/27b и в правой части на r получи
- •Подставив значения величин в си и произведя вычисление, получим:
- •2. Явления переноса
- •Диффузией называют процесс взаимного проникновения молекул (атомов) вещества, обусловленный их тепловым движением.
- •2. Примеры решения задач
- •Таким образом
- •3. Элементы термодинамики
- •3. Примеры решения задач
- •Подставив эти значения и выполнив вычисление, получим
- •Однако это выражение еще не является ответом, ибо Aвн есть сумма двух работ: работы a силы, приложенной к поршню (например, силы руки), и работы Aатм силы атмосферного давления, т.Е.
- •4. Термодинамические потенциалы
- •4. Примеры решения задач
- •С учетом этого будем иметь
- •5. Строение и свойства жидкостей
- •5. Примеры решения задач
- •Контрольная работа 2
- •Приложения
- •3,723 2,4 5,1846 Следует вычислять выражение
- •2.Основные физические постоянные (округленные значения)
- •3.Плотность твердых тел
- •4. Плотность жидкостей
- •5. Эффективный диаметр молекул, динамическая вязкость и теплопроводность газов при нормальных условиях
- •6. Критические параметры и поправки Ван – дер – Ваальса
- •8. Поверхностное натяжение жидкостей при 20o
- •9.Некоторые астрономические величины
1.1. Примеры решения задач.
1.1.1. Определить для серной кислоты: 1) относительную молекулярную массу; 2) молярную массу.
Решение. 1. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, атомы которых входят в состав молекулы данного вещества,и определяется по формуле
r=niAri,
где ni – число атомов i-го элемента, входящих в молекулу;
Ari – относительная атомная масса i-го элемента.
Химическая формула серной кислоты имеет вид H2SO4. Так как в состав молекулы серной кислоты входят атомы трех элементов, то стоящая в правой части равенства сумма будет состоять из трех слагаемых и формула примет вид
r=n1Ar1+n2Ar2+n3Ar3.
Из формулы серной кислоты далее следует, что n1=2, n2=1, n3=4.
Значения относительных атомных масс водорода, серы и кислорода соответственно равны Ar1=1, Ar2=32, Ar3=16. Подставив численные значения ni и Ari будем иметь:
r=2+32+64=98.
2. Зная относительную молекулярнуюмассу, найдем молярную массу серной кислоты по формуле
=rk,
где k=10-3 кг/моль.
Подставив в последнее выражение значения величин, получим =98710-3 кг/моль.
1.1.2. Определить молярную массу смеси см кислорода массой m1=25 г и азота массой m2=75 г.
Решение. Молярная масса см смеси, есть отношение массы смеси mсм к количеству вещества см смеси:
см=mсм/см.
Масса смеси равна сумме масс компонентов смеси: mсм=m1+m2.
Количество вещества смеси равно сумме количеств вещества компонентов
![]()
Подставив выражения mсм и см в ранее записанную формулу для молярной массы получим
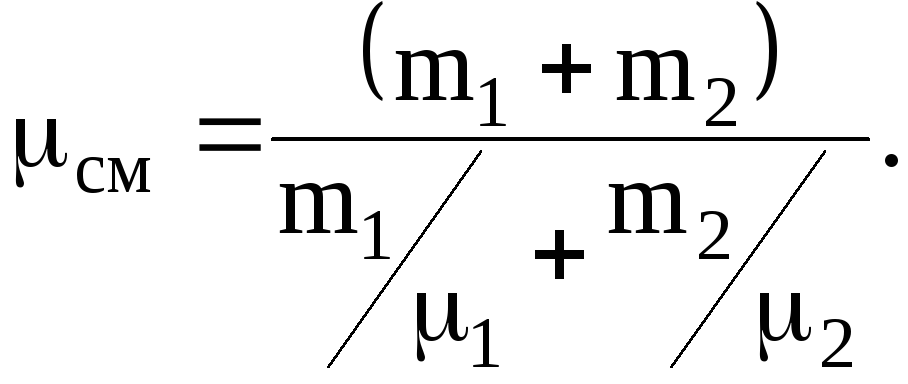
где 1=3210-3 кг/моль, 2=2810-3 кг/моль.
Подставив, значение величин и произведя вычисление, будем иметь
см=28,9.10-3 кг/моль.
1.1.3. Определить число молекул N, содержащихся в объеме V=1 мм3 воды, и массу m1 одной молекулы воды. Считая условно, что молекулы воды имеют вид шариков, соприкасающихся друг с другом, найти диаметр d молекул.
Решение. Число молекул N, содержащихся в некоторой системе массой m, равнопроизведению постояннойАвогадро на количество вещества N=NА.
Так как =m/, где -молярная масса,то
N=(m/)NА.
Выразив в формуле массу как произведение плотности на объем V, получим
N=(V/)NА.
Произведем вычисления, учитывая =1810-3 кг/моль, =1103 кг/м3, V=110-9 м3, N=6,021023 моль-1:
![]() .
.
Массу одной молекулы m1 можно найти по формуле
![]()
Если молекулы воды плотно прилегают друг к другу, то можно считать, что на каждую из них приходится объем (кубическая ячейка)
V1=d3,
где d-диаметр молекулы.
Отсюда
d=V11/3.
Объем V1 найдем, разделив молярный объем V на число молекул в моле, т.е. на NА:
V1=Vm/NА.
Тогда для диаметра одной молекулы будем иметь:
d=(Vm/NА)1/3,
где Vm=/p
Окончательно
d=(/(pNА))1/3.
Произведем вычисления
![]()
1.1.4. В баллоне объемом 10 л находится гелий под давлением p1=1 МПа и при температуре T=300 К. После того как из баллона было взято m=10 г гелия,температура газа понизилась до Т=290 К Определить давление p гелия оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, применив его дважды к начальному и конечному состояниям газа:
![]() ;
;
![]() ,
,
где m1, m2 – массы гелия в баллоне в начальном и конечном состояниях;
– молярная масса гелия;
R – универсальная газовая постоянная;
T1 и T2 – температуры газа в начальном и конечном состояниях.
Массы m1 и m2 гелия найдем из уравнения Менделеева-Клапейрона:
m1=p1V/(RT1),
m2=mp2V/(RT2).
Тогда масса гелия оставшегося в баллоне будет равна
![]()
Для давления p гелия, оставшегося в баллоне, будем иметь:
![]()
или
![]()
Численно
![]() .
.
1.1.5. Баллон содержит 80 г кислорода и 320 г аргона. Давление смеси 1МПа, температура 300 К. Принимая данные газы за идеальные, определить объем баллона.
Решение. По закону Дальтона, давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. Парциальные давления кислорода p1 и аргона p2 можно определить, воспользовавшись уравнением Менделеева-Клапейрона
p1=m1RT/(1V), p2=m2RT/(2V).
Следовательно, по закону Дальтона, давление смеси газов
![]() или
или
![]()
Откуда объем баллона
![]()
Подставив численные значения, будем иметь
![]()
1.1.6. Какое количество молекул находится в комнате объемом 80 м3 при температуре 17 oС и давлении 750 мм. рт. ст?
Решение. Количество молекул N, содержащееся в комнате, можно определить, зная массувоздуха m,его молярную массу и число Авогадро NА. Число молекул в одном киломоле газа равно числу Авогадро. А число киломолей содержащихся в массе m, определяется соотношением:
=m/.
Следовательно,
N=m/(NА).
Массу m содержащегося в комнате воздуха определяем из уравнения Менделеева-Клапейрона
![]()
![]()
где p – давление воздуха;
V – объем;
R – универсальная газовая постоянная;
T – абсолютная температура (T=t+ 273 );
m – масса воздуха.
Следовательно, для числа молекул воздуха имеем:
![]()
Подставляя все данные, предварительно выразив их в системе СИ, будем иметь
![]()
1.1.7. Найти среднюю кинетическую энергию вращательного движения одной молекулы кислорода при температуре T=350 К, а также кинетическую энергию вращательного движения всех молекул кислорода массой 4 г.
Решение. Согласно теореме о равномерном распределении энергии по степеням свободы, накаждую степень свободы приходится энергия:
![]() ,
,
где k – постоянная Больцмана;
Т – абсолютная температура.
Молекула кислородадвухатомная, поведение такой молекулы описывается 5-ю степенями свободы (три изних приписываются поступательному движению и две- вращательному).
Следовательно, кинетическая энергия вращательного движения молекулы кислорода может быть рассчитана по формуле:
<Wвр>=2 <Wк>=21/2 kТ=kТ.
Энергия вращательного движения всех молекул, содержащихся в 4 г кислорода, может быть определена как произведение числа молекул N на энергию одной молекулы:
Wк=N<Wвр>=NkТ.
Число молекул определяется соотношением:
![]()
где – молекулярная масса кислорода;
m – его масса;
NА – число Авогадро.
Таким образом
![]()
Подставив численные значения, предварительно выразив их в системе СИ, будем иметь:
<Wвр>=1,3810-23.350=4,8310-21 Дж;
![]() .
.
1.1.8. Масса 10 г кислорода находится при давлении 304 кПа и температуре 10 oС. После расширения вследствие нагревания при постоянном давлении кислород занял объем 10 л. Найти объем газа до расширения, температуру газа после расширения, плотности газа до и после расширения.
Решение. Согласно условию задачи, расширение газа вследствие нагревания происходило при постоянном давлении. В этом случае оказывается справедливым соотношение
![]() .
.
Для определения температуры газа после расширениявоспользуемся уравнениемМенделеева-Клапейрона для конечного состояния газа
![]() ,
,
где p2 – давление газа после расширения;
V2 – его объем после расширения;
m – масса газа;
– молекулярная масса кислорода;
R – универсальная газовая постоянная;
T2 – абсолютная температура газа.
Следовательно, дляконечной температуры имеем
![]()
Для определения объема газа до расширения можно вновь воспользоваться уравнением Менделеева-Клапейрона, записанным для первоначального состояния газа:
![]()
где p1, V1, T1 – его давление, объем и температура до расширения.
Из данногоуравнения имеем
![]() .
.
Учитывая то, что плотность газа 1=m/V1, подставляя значения V1 и V2 из уравнений Менделеева-Клапейрона, записанные для соответствующих состояний, для плотности кислорода до и после расширения будем иметь
![]() и
и
![]()
Подставляя численные значения в системе СИ, окончательно имеем:
![]()
![]()
1=4,14 кг/м3,
2=1кг/м3.
1.1.9.Масса газа 12 г занимает объем 4 л при температуре 7 oC. После нагревания газа при постоянном давлении его плотность стала равной 0,6 кг/м3. До какой температуры нагрели газ?
Решение. Воспользовавшись уравнением Менделеева-Клапейрона
![]()
можно показать, что между плотностью газа =m/V и давлением существует связь
![]()
Следовательно, в начальномсостоянии давление газа:
![]()
В конечном:
![]()
Так как нагревание газа производилось при постоянном давлении, то p1=p2
![]() .
.
Отсюда
![]()
Подставляя численные значения, в системе СИ, для конечной температуры будем иметь:
![]()
1.1.10. В баллоне находилась масса m1=10 кг газа при давлении p1=10 МПа. Какую массу газа взяли из баллона, если давление стало равным p2=2,5 МПа? Температуру газа считать постоянной.
Решение. Запишем уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) для двух состояний: начального и конечного
![]() и
и
![]()
Из второгосоотношения определяем объем сосуда и подставляем его значение в первое, имеем:
![]()
![]()
Из последнего соотношения получаемсвязь между давлением газа в сосуде и его массой для данного случая:
![]()
Отсюда масса газа оставшегося в баллоне:
![]() .
.
Так как масса израсходованного газа m=m1-m2,то окончательно, после соответствующих преобразований, имеем
![]()
Подставляячисленные значения в системе СИ определяем массу взятого из баллона газа:
![]()
1.1.11. В сосуде находится масса m1=14 г азота и масса m2==9 г водорода при температуре 10 oС и давлении 1 МПа. Найти молярную массу смеси и объем сосуда.
Решение. По закону Дальтона давление смеси газов равно сумме парциальных давлений компонентов входящих в смесь
p=p1+p2,
где p – давление смеси;
p1 – парциальное давление азота;
p2 – парциальное давление водорода.
Из уравнения Менделеева-Клапейрона:
![]()
Для каждого из давлений (смеси и парциальных) можно записать:
![]()
![]()
![]()
Следовательно, так как p=p1+p2, имеем
![]()
![]()
откуда
![]()
Из последнего соотношения для молекулярной массы смеси будем иметь
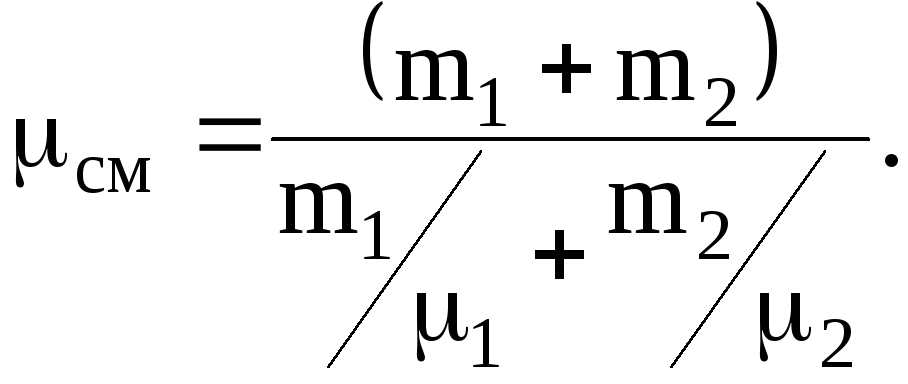
Изуравнения Менделеева-Клапейрона, для смеси газов, объем сосуда равен:
![]()
Подставляячисленные значения в системе СИнаходиммолекулярную массу смеси:
![]()
и объем сосуда
![]()
1.1.12. Для получения хорошего вакуума в стеклянном сосуде необходимо прогревать стенки сосуда при откачке для удаления, адсорбированного газа. На сколько может повыситься давление в сферическом сосуде радиусом 10 см, если адсорбированные молекулы перейдут со стенок в сосуд? Площадь поперечного сечения молекул So==10-19 м2. Температура газа в сосуде 300 oС. Слой молекул на стенках считать мономолекулярным.
Решение. Для определения давления воспользуемся основным уравнением молекулярно-кинетической теории в виде
p=nokT,
где no – число молекул в единице объема;
k – постоянная Больцмана;
Т – абсолютная температура газа.
С учетом того, что
no=N/V,
где N – число молекул в объеме V, для давления имеем
![]()
Поусловиюзадачи слой молекул в сосуде мономолекулярный, следовательно число молекул в нем можно определить исходя из соображений:
![]()
где S=4r2 – площадь поверхности сосуда;
So – площадь поперечного сечения молекул газа.
Так как сосуд сферический, то его объем V=4/3r3.
Таким образом, окончательно для давления газа в сосуде будем иметь соотношение:
![]()
Подставляячисленные значения в полученноесоотношение в системе СИ определяем давление газа в сосуде
![]()
1.1.13. В воздухе содержится 23,6 % кислорода и 76,4 % азота (по массе) при давлении 100 кПа и температуре 13 oС. Найти плотность воздуха и парциальные давления кислорода и азота.
Решение. Для определения плотности воздуха воспользуемся уравнением Менделеева-Клапейрона
![]()
откуда
![]() а
а
![]() .
.
Для определения парциальных давлений также воспользуемся уравнением Менделеева-Клапейрона, записанным для каждого из компонентов, входящих в смесь воздуха:
![]()
![]()
где V – объем воздуха.
Откуда
![]()
![]()
Так как =m/V, то V=m/, следовательно
![]()
![]()
Подставляячисленные значения в системе СИ для плотности воздуха и парциальных давлений кислорода иазота будем иметь:
![]()
![]()
![]()
1.1.14. В сосуде находится количество =10-7 моль кислорода и масса m2==10-6 г азота. Температура смеси 100 oС, давление в сосуде p=133 мПа. Найти объем сосуда, парциальные давления кислорода и азота и число молекул в единице объема.
Решение. Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, записанным для смеси газов в виде
![]()
где см=1+1=(1+m2/2) – число молей или киломолей газов составляющих смесь.
Имеем
pV=(1+m2/2) RT.
Отсюда
V=(1+m2/2) (RT/p).
Парциальные давления компонентов образующих смесь определяем так же из уравнения Менделеева-Клапейрона, записанным для каждого из газов
p1V=1RT и p2V =(m2/2)RT.
Откуда для парциальных давлений кислорода и азота соответственно имеем
p1=1RT/V;
p2=m2RT/2V.
Для определения числа молекул в единице объема необходимо воспользоваться основным уравнением молекулярно-кинетической теории для давления
p=nokT.
