
- •I. Общие положения
- •II. Комплекты измерительных материалов
- •2.1. Комплект измерительных материалов текущего контроля (Контрольная точка 1)
- •1. Паспорт оценочных средств контрольной точки № 1
- •2. Форма текущего контроля и процедура оценивания
- •Система и критерии оценок результатов текущей аттестации
- •4. Пакет заданий
- •Условия выполнения задания
- •5. Эталон ответов Вариант №1
- •Вариант № 2
- •Вариант № 3
- •Вариант №4
- •Вариант №5
- •Вариант№6
- •Задачи повышенной сложности
- •II. Комплекты измерительных материалов
- •2.2. Комплект измерительных материалов текущего контроля (Контрольная точка 2)
- •1. Паспорт оценочных средств контрольной точки № 2
- •Форма текущего контроля и процедура оценивания
- •Система и критерии оценок результатов текущей аттестации
- •4. Пакет заданий Условия выполнения задания
- •Эталон ответов
- •7. Протокол результатов текущего контроля
- •2.N. Комплект измерительных материалов промежуточного контроля
- •1. Паспорт оценочных средств промежуточного контроля
- •2. Форма промежуточного контроля и процедура оценивания
- •3. Система и критерии оценок результатов промежуточной аттестации
- •4. Пакет заданий
- •4.1. Теоретические задания теоретическое задание (тз) № 1-n
- •4.2. Практические задания практическое задание (пз) № 1-n
- •5. Бланк ответов (для тестов)
- •6. Эталон ответов (ключ или решение)
- •7. Протокол результатов промежуточного контроля
- •Зачетная ведомость
Условия выполнения задания
Контрольная работа выполняется студентами в аудитории по химии на учебном занятии
Время выполнения 1 час 20 минут
Оборудование: периодическая система химических элементов Д.И. Менделеева, таблица растворимостей гидроксидов и солей в воде, таблица электрохимического ряда напряжений металлов
5. Эталон ответов Вариант №1
Свойства элементов и их соединений находятся в периодической зависимости от величины заряда ядра атома.
-Взаимодействие натрия с неметаллами
2Na+Cl2→2NaCl
-Взаимодействие со сложными веществами
а) с водой
2Na+2H2O→2NaOH+H2
б) взаимодействие с кислотой
2Na+2HCl→2NaCl+H2
S→SO2→SO3→H2SO4→CaSO4
S+O2→SO2
2SO2+O2→2SO3
SO3+H2O→H2SO4
S O3+H2O
2H1++SO42-
O3+H2O
2H1++SO42-
H2SO4+CaO→CaSO4+H2O
2H1++SO42-+CaO→CaSO4+H2O
Дано:

V(H2)-2,24л Решение
H2SO4-избыток x y 2,24л
Сa+H2SO4→CaSO4+H2
m(Ca)-? 1моль 1моль 1моль 1моль
m(CaSO4)-? Y(H2)
=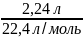 =
0,1 моль
=
0,1 моль
Y(Ca) = Y(H2) = 0,1 моль
Y(CaSO4) = Y(H2) = 0,1 моль
М(Ca) = 40г/моль
М(CaSO4) = 40+32+64 = 136 г/моль
m(Ca) = 40г/моль * 0,1 моль = 4г
m(CaSO4) = 136г/моль * 0,1 моль = 13,6г
Ответ: m(Ca) – 4г; m(CaSO4) – 13,6г
Вариант № 2
-Всякое чистое вещество независимо от способов его получения имеет постоянный качественный и количественный состав.
-Масса веществ, вступивших в реакцию равна массе веществ, образующихся в результате реакции
-Взаимодействие кальция с неметаллами.
Ca + Cl2 → Ca Cl2
2Ca + O2→2CaO
-Взаимодействие кальция со сложными веществами
а) с водой
Ca
+ 2H2O
→ Ca(OH)2
+ H2
б) с кислотой
Ca + 2HCl → Ca Cl2 + H2
CuCl2
 Сu2
+ 2 Cl1-
Сu2
+ 2 Cl1-
H2 O ⇄ H1+ + OH1-
K(-) Cu2+ + 2ē → Cu0 ( восстановление )
А(+) Cl1- - 1ē → Cl0 ( окисление)
2 Cl0 → Cl2 ↑
Д ано: Решение:
1,12г 13,06КДж
m(CaO) – 1,12г CaO + H2 O → Ca (OH)2
Q1 – 13,06 КДж 1моль 1моль 1моль
Q
- ? M(Cao)
= 40 + 16 = 56
(CaO)
=
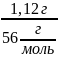 =0,02 моль
=0,02 моль
0,02 моль CaO ─ 13,06 кДж
1моль CaO ─ Q
Q = 653 кДж
Ответ : CaO + H2 O → Ca (OH)2 + 653 кДж
Вариант № 3
1. Химическое равновесие – это состояние системы, при котором скорости прямой и обратной реакции равны. Если на систему , находящуюся в равновесии оказывают внешнее воздействие ( изменение концентрации веществ, температуры, давления), то в системе возникает процесс, ослабляющий этот процесс.
2. -Взаимодействие алюминия с простыми веществами.
2Al + 3Cl2 → 2 AlCl3
4Al +3O2 → 2Al2 O3
-Взаимодействие алюминия со сложными веществами.
а) с водой
2Al + 6 H2 O → 2 Al ( OH)3 ↓ + 3H2
б) с кислотой
2Al + 6HCl → 2 Al Cl3 + 3H2 ↑
В) с солью
Al + Fe Cl3 → AlCl3 + Fe
3. Ca Cl2 ⇄ Ca2+ + 2 Cl1-
H2 O ⇄ H1+ + OH1-
K(-) H1+ + 1ē → H0 (восстановление)
2H0 → H2 ↑
A(+) Cl1- ─ 1ē → Cl0 (окисление)
2Сl0 → Cl2 ↑
4 .Дано : Решение :
CuO M ( CuO)= 64+16=80
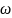 (Cu)
-?
(Cu) =
(Cu)
-?
(Cu) =
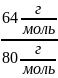 * 100% = 80%
* 100% = 80%
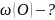 (О2
) =
(О2
) =
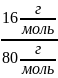 * 100% = 20%
* 100% = 20%
Ответ: (Cu) - 80% , (О2 ) -20%
