
- •Механика и молекулярная физика Лабораторный практикум
- •Механика и молекулярная физика: лабораторный практикум / cост. С.Г.Гильмиярова, н.Ф.Косарев, ф.Ф.Тимерханов. – Уфа: Изд-во бгпу, 2010. – с.
- •Isbn Издательство бгпу, 2010
- •V. Фазовые переходы......................................................................... .....83
- •1. Место физики среди естественных наук и роль измерений в физике
- •Порядок работы в лаборатории
- •Оценки по выполнению отдельных этапов заносятся в таблицу на первой странице рабочей тетради:
- •Виды физических измерений
- •Единицы измерения физических величин
- •Элементы теории погрешностей
- •Ошибки измерения (погрешности) и причины их возникновения
- •2. Определение величины ошибки при прямых измерениях
- •Коэффициенты Стьюдента
- •Относительная ошибка
- •Пример записи результатов прямых измерений
- •Определение физической величины и ее ошибки при косвенных измерениях
- •6. Некоторые правила приближенных вычислений
- •7. Построение графиков
- •Простейшие физические измерения Нониус и микрометрический винт
- •Часть I
- •Форма отчета
- •Лабораторная работа № 2 Определение объема и плотности твердого тела
- •Определение плотности вещества
- •Форма отчета Лабораторная работа № 2
- •1. Определение плотности цилиндра
- •II. Определение плотности твердого тела неправильной формы
- •Вопросы к допуску
- •Краткая теория
- •Ход работы и обработка результатов измерения
- •Второй способ (экспериментальный)
- •Ход работы и обработка результатов измерения
- •Контрольные вопросы
- •Лабораторная работа № 5 изучение незатухающих гармонических колебаний и упругих свойств пружины
- •Вопросы к допуску
- •Краткая теория
- •Упражнение I Определение основных величин, характеризующих гармонические незатухающие колебания Ход работы и обработка результатов измерения
- •Упражнение II Изучение зависимости периода колебаний от массы колеблющегося груза и определение коэффициента жесткости пружины Ход работы и обработка результатов измерения
- •Контрольные вопросы
- •Лабораторная работа № 6 изучение незатухающих гармонических колебаний математического маятника
- •Вопросы к допуску
- •Ход работы и обработка результатов измерения
- •Контрольные вопросы
- •Описание установки. Вывод расчетных формул
- •Порядок выполнения работы
- •5. Данные установки и таблица результатов измерения
- •6. Обработка результатов измерений
- •Контрольные вопросы
- •Часть II молекулярная физика
- •I. Молекулярно-кинетическая теория
- •Идеального газа
- •Лабораторная работа №1 определение газовой постоянной методом откачки
- •Вопросы к допуску:
- •Содержание и метод выполнения работы
- •Порядок выполнения работы:
- •Цель работы: проверка соотношения между изменениями объема и давления определенного количества газа при его изотермическом сжатии. Содержание и метод выполнения работы
- •Порядок выполнения работы
- •Упражнение 2 изучение изобарного процесса
- •Содержание и метод выполнения работы
- •Порядок выполнения работы
- •Контрольные вопросы
- •II. Жидкости
- •Порядок выполнения работы
- •Если искривленная поверхность жидкости имеет сферическую форму то:
- •Порядок выполнения работы
- •Упражнение 3 определение коэффициента поверхностного натяжения по методу счета капель
- •Содержание и метод выполнения работы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Порядок выполнения работы
- •Контрольные вопросы
- •III. Явления переноса
- •Лабораторная работа №5 определение коэффициента внутреннего трения жидкости капиллярным вискозиметром
- •Вопросы к допуску:
- •Содержание и метод выполнения работы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Порядок выполнения работы
- •Контрольные вопросы
- •IV. Реальные газы
- •Влажность воздуха
- •Упражнение 2 определение психрометрической постоянной аспирационным психрометром Порядок выполнения работы
- •Контрольные вопросы
- •V. Фазовые переходы
- •Порядок выполнения работы
- •Упражнение 2 наблюдение за отвердеванием аморфного тела
- •Содержание и метод выполнения работы
- •Порядок выполнения работы
- •Упражнение 3 исследование свойств переохлажденной жидкости
- •Содержание и метод выполнения работы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Приложения
- •Плотность некоторых твердых веществ при 200 с
- •Механика. Молекулярная физика
6. Обработка результатов измерений
1. Рассчитать средний диаметр каждого шарика по формуле:
 .
.
По формуле (5) рассчитать коэффициент внутреннего трения жидкости для каждого опыта.
Определить среднее (из пяти опытов) значение коэффициента внутреннего трения ηср.
Провести статистическую обработку результатов измерения для одного из шариков (выбрать шарик, для которого значения d1, d2, d3 отличаются наиболее сильно). Рассчитать d.
Примечание. Отметим, что для времени статистическую обработку проводить нельзя; это было бы возможно, если бы каждый раз вынимали шарик из сосуда и проводили бы эксперимент с одним и тем же шариком.
Убедиться, что относительная погрешность в измерении диаметра шарика значительно превышает погрешности табличных величин, а также погрешности измерения и L. В этом случае можно считать, что погрешность в определении коэффициента внутреннего трения жидкости обусловлена только погрешностями в определении диаметра шарика. Погрешностями в определении остальных величин можно пренебречь.
Относительную погрешность косвенного измерения коэффициента внутреннего трения рассчитать по приближенной формуле:
![]() .
.
Абсолютную погрешность определить по формуле: Δηср=ε·ηср.
Записать результат с учетом погрешности измерений в виде: ηср ± Δηср.
Контрольные вопросы
В чем заключается явление внутреннего трения?
Запишите закон Ньютона для внутреннего трения и поясните его.
Какое движение называют ламинарным, какое - турбулентным?
Какие силы действуют на шарик при его движении в жидкости?
Сделайте вывод формулы, по которой определяется коэффициент внутреннего трения в данной лабораторной работе.
Зависит ли коэффициент внутреннего трения жидкости от температуры? Проанализируйте данные вашего повседневного опыта. Можете ли вы объяснить эту зависимость с молекулярно-кинетической точки зрения?
Почему метод Стокса не применяют для определения коэффициента внутреннего трения воздуха?
Как влияет вязкость биологических жидкостей на здоровье человека?
Часть II молекулярная физика
I. Молекулярно-кинетическая теория
Идеального газа
В молекулярно-кинетической теории принято оперировать понятием идеализированная модель газа, согласно которой считается, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой намного меньше, чем со стенками сосуда. Такие газы называются идеальными. Иными словами, в идеальном газе отсутствуют силы межмолекулярного притяжения, а бесконечно большие силы отталкивания возникают только при непосредственном соприкосновении молекул при их соударении.
С достаточной степенью точности множество газов, в том числе и воздух, при комнатной температуре и атмосферном давлении можно считать идеальным газом, поскольку среднее расстояние между молекулами при обычных условиях гораздо больше размеров самих молекул. Состояние данной массы идеального газа M характеризуется следующими параметрами: давлением (P), объемом (V), и абсолютной температурой (T). Связь между параметрами газа описывается экспериментально открытыми законами:
Закон
Бойля-Мариотта
(изотермический процесс): для
данной массы
газа при
постоянной температуре произведение
давления газа на его объем
есть величина
постоянная:
![]() при
при
![]() ,
,
![]() .
.
Для определенного количества газа при его изотермическом сжатии, закон Бойля-Мариотта имеет вид:
![]() ,
,
где
![]() и
и
![]() – объемы, занимаемые газом соответственно
до и после сжатия, а
– объемы, занимаемые газом соответственно
до и после сжатия, а
![]() и
и
![]() – его давления.
– его давления.
К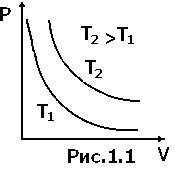 ривая,
изображающая зависимость между величинами
ривая,
изображающая зависимость между величинами
![]() и
и
![]() ,
характеризующим свойства вещества при
постоянной температуре, называется
изотермой.
,
характеризующим свойства вещества при
постоянной температуре, называется
изотермой.
Изотермы представляют собой гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (рис.1.1).
Закон Гей-Люссака (изобарный процесс): для данной массы газа при постоянном давлении объем газа прямо пропорционален абсолютной температуре:
![]() при
при
![]() .
.
Для определенного количества газа при его изобарном охлаждении (или нагреве) закон Гей-Люссака имеет вид:
![]() ,
,
где
и
– объемы, занимаемые данной массой газа
соответственно до и после охлаждения,
а
![]() и
и
![]() – его температуры.
– его температуры.
Н а
диаграмме в координатах V
и T
(рис.1.2) этот процесс изображается прямой
линией (изобара)
с разным углом наклона, определяемым
значением
.
Чем меньше давление, тем больше угол
наклона изобары, изображенного на
диаграмме. При низких температурах
изобары изображаются на графике
пунктирной линией.
а
диаграмме в координатах V
и T
(рис.1.2) этот процесс изображается прямой
линией (изобара)
с разным углом наклона, определяемым
значением
.
Чем меньше давление, тем больше угол
наклона изобары, изображенного на
диаграмме. При низких температурах
изобары изображаются на графике
пунктирной линией.
Закон Шарля (изохорный процесс): Для данной массы газа при постоянном объеме его давление прямо пропорционально абсолютной температуре:
![]() при
при
![]() .
.
Из закона Шарля следует, что если объем определенного количества газа не изменяется, то изменение его давления и температуры удовлетворяет условию:
![]() ,
,
г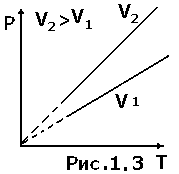 де
и
– давление газа в исходном и конечном
состояниях, а
и
– температура в этих состояниях.
де
и
– давление газа в исходном и конечном
состояниях, а
и
– температура в этих состояниях.
Таким образом, изохорный процесс представляет собой нагрев (или охлаждение) данной массы газа при постоянном объеме.
На
диаграмме (![]() )
график изохорного процесса (изохора)
– прямая линия, выражающая линейную
зависимость
от
)
график изохорного процесса (изохора)
– прямая линия, выражающая линейную
зависимость
от
![]() газа, угол наклона которой к оси
определяется значением
(рис.1.3).
газа, угол наклона которой к оси
определяется значением
(рис.1.3).
Введем абсолютную температуру, связанную с температурой по шкале Цельсия соотношением:
![]() .
.
Абсолютная
температура измеряется в Кельвинах
(К). 1К
численно равен
![]() .
Нуль шкалы абсолютной температуры
составляет
.
Нуль шкалы абсолютной температуры
составляет
![]() .
.
Комбинируя выражения экспериментальных газовых законов, было получено уравнение Менделеева-Клапейрона, которое однозначно описывает состояние идеального газа. Поэтому его называют еще и уравнением состояния идеального газа:
![]() ,
,
где
![]() – молярная масса газа,
– молярная масса газа,
![]() – универсальная газовая постоянная.
– универсальная газовая постоянная.
Д ля
определения физического смысла
рассмотрим процесс изобарного расширения
идеального газа. Пусть при нагревании
1 моля
идеального
газа на 1К
(
)
поршень площадью
ля
определения физического смысла
рассмотрим процесс изобарного расширения
идеального газа. Пусть при нагревании
1 моля
идеального
газа на 1К
(
)
поршень площадью
![]() поднимается на: h
(рис.1.4).
Работа газа по подъему поршня:
поднимается на: h
(рис.1.4).
Работа газа по подъему поршня:
![]() ,
,
где
![]() –
изменение объема газа. Согласно уравнению
Менделеева-Клапейрона для одного моля
газа:
–
изменение объема газа. Согласно уравнению
Менделеева-Клапейрона для одного моля
газа:
![]() .
.
Отсюда:
![]() .
.
Таким образом, газовая постоянная R численно равно работе, совершаемой одним молем идеального газа при нагревании его на 1К при постоянном давлении.
Ее численное значение равно:
![]() .
.
Зная газовую постоянную, можно определить постоянную Больцмана:
![]() ,
,
где
![]() ·
·![]() моль-1
– число Авогадро. Единица измерения
постоянной Больцмана – Дж/К.
Зная постоянную Больцмана, можно
определить среднюю энергию одной
молекулы идеального газа:
моль-1
– число Авогадро. Единица измерения
постоянной Больцмана – Дж/К.
Зная постоянную Больцмана, можно
определить среднюю энергию одной
молекулы идеального газа:
![]() ,
,
где i – число степеней свободы молекул воздуха (воздух можно считать двухатомным газом, i = 5).
