
§ 3. Второй закон термодинамики
Согласно второму закону термодинамики теплота самопроизвольно может переходить только от более нагретого тела к менее нагретому. Установлено, что в работу может превращаться только часть той теплоты, которая переходит от нагревателя к холодильнику, и тем большая, чем больше разность температур:
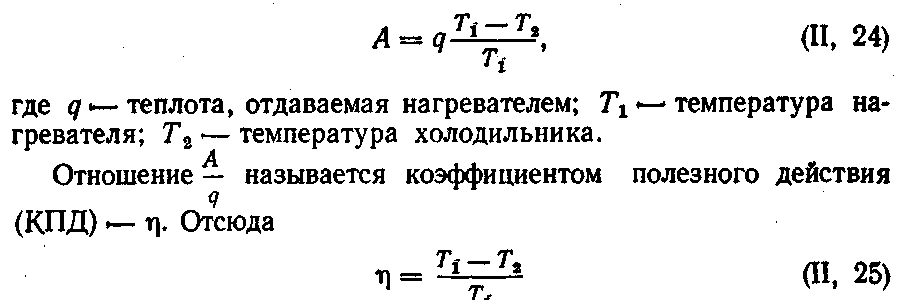
Теплота сгорания твердого углерода равна –393,8 кДж/моль, теплота сгорания водорода равна –286 кДж/моль, теплота сгорания ацетилена равна –1300 кДж/моль.
На основе второго закона термодинамики Клаузиус ввел понятие энтропии ΔS— термодинамической функции системы. Изменение энтропии А5 в каком-либо процессе зависит только от начального и конечного состояний системы и не зависит от пути перехода. Наиболее просто ΔS определяется для обратимых неизолированных изотермических процессов:
![]()
где q— количество теплоты, сообщенное системе.
При изотермическом плавлений или испарении количества вещества 1 моль;
![]()
где ΔH •— теплота плавления или теплота испарения.
Если происходит изотермическое расширение п моль идеального газа, то
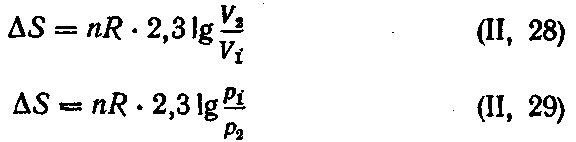
Если же в системе, состоящей из идеального газа, изменяется одновременно несколько параметров, то
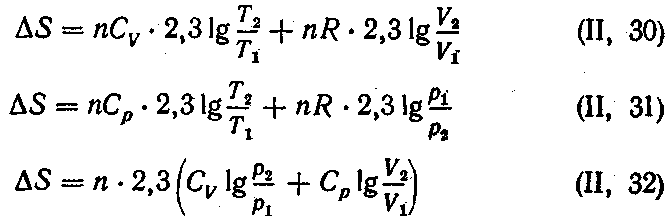
Вычисление ΔS в необратимых процессах ведут по уравнениям для процессов обратимых. Это вполне закономерно, так как изменение энтропии при заданном начальном и конечном состояниях системы не зависит от пути перехода и, в частности, от обратимости процесса. Если необратимый и обратимый процессы проводятся в одних и тех же граничных условиях, то ΔS обр = ΔS необр.
Примеры
1. К котлу с водой, находящейся при 100 °С, подвели 8374 Дж теплоты. Найти КПД и максимальную работу, которую можно получить от котла, если температура холодильника 30 °С.
Решение. Максимальную работу находим по уравнению (11,24):
![]()

2. При временном контакте тела с температурой 200 °С с телом, нагретым до 100 °С, перешло 418,7 Дж теплоты. Найти общее изменение энтропии системы.
Решение. Изменение энтропии теплоотдатчика и теплоприемника находим по уравнению (II, 26):
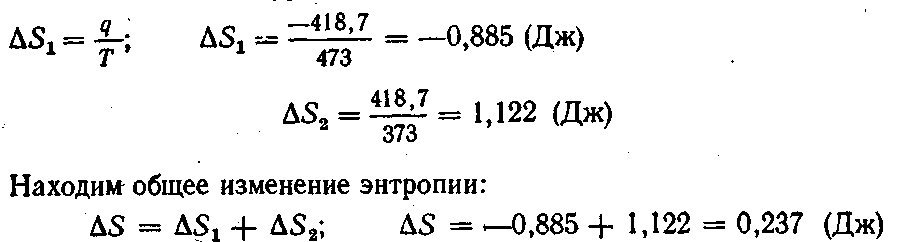
3. Азот объемом 0,001 м3 смешан с кислородом объемом 0,002 м3 при 27 °С и давлении 1,013 • 105 Па. Найти общее изменение энтропии системы.
Решение. При смешении газы будут диффундировать друг в друга. Межмолекулярным взаимодействием газов можно пренебречь, так как при данных условиях газы можно принять за идеальные. Поэтому общее изменение энтропии при смешении газов будет равно сумме изменений энтропии каждого газа при его расширении до объема смеси. Так как процесс изотермический, то из уравнения (II, 28) для каждого газа
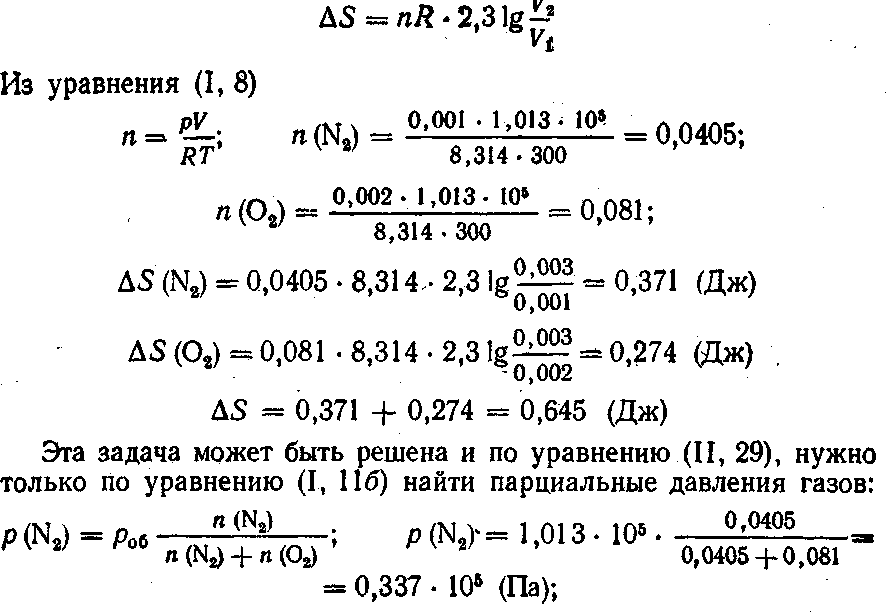

4. Вода массой 1 кг, взятая при 0 °С, переведена в состояние перегретого пара с температурой 200 °С и давлением 101,3 кПа. Вычислить изменение энтропии этого перехода, если удельная теплота испарения воды при 100 °С равна 2257 Дж/г, удельная теплоемкость воды равна 4,187 Дж (г • К), а удельная теплоемкость водяного пара при давлении в 1,013 • 105Па равна 1,968 Дж (г • К).
Решение. Общее изменение энтропии будет складываться из трех составляющих: изменения энтропии ΔSХ при нагревании воды до температуры кипения, изменения энтропии ΔS2 при переходе воды из жидкого состояния в парообразное и, наконец, изменения энтропии ΔS3 при нагревании сухого пара от 100 до 200 С:
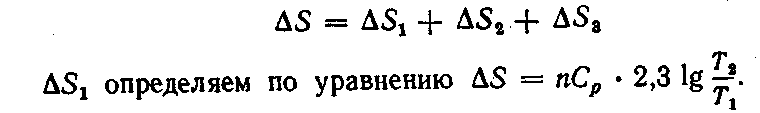
Оно получено из уравнения (II, 31), если предположить, что система подчиняется законам для идеальных газов и что объем воды при нагревании не изменяется. Молярная теплоемкость Ср равна удельной теплоемкости, умноженной на молярную массу:
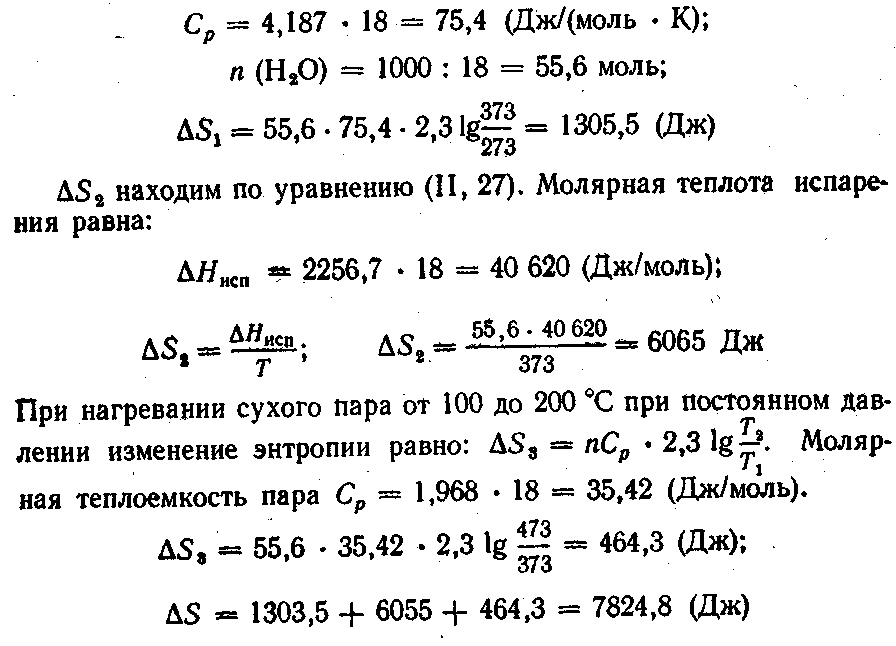
Вопросы и упражнения
29. Приведите несколько формулировок второго закона термодинамики и напишите его математическое выражение.
30. Что такое КПД? Почему он всегда бывает меньше единицы?
31. В чем состоит значение второго закона термодинамики для физической химии и химической технологии?
32. В отличие от первого закона термодинамики второй закон носит статистический (вероятностный) характер. Что это значит?
33. Что такое свободная и связанная энергия?
34. Что такое энтропия?
35. Как будет изменяться энтропия воды при ее переходе из твердого состояния в жидкое и из жидкого в парообразное?
36. Почему энтропия системы всегда больше нуля?
37. Напишите уравнения изменения энтропии для изотермических обратимых неизолированных, обратимых изолированных и изолированных необратимых процессов.
38. Почему несостоятелен вывод Клаузиуса о тепловой смерти Вселенной?
39. В чем состоит физический смысл изобарно-изотермического и изохорно-изотермического потенциалов? Напишите уравнения, показывающие связь между термодинамическими потенциалами и другими термодинамическими функциями.
40. Знак изобарно-изотермического потенциала позволяет судить о том, может ли данная реакция идти самопроизвольно, а его величина указывает, на какую глубину должна пройти реакция, чтобы система достигла равновесия. Выясните, какие из нижеприведенных реакций будут протекать в прямом, а какие — в обратном направлении. Какая из этих реакций будет ближе всего к равновесию в момент смешения эквимолярных количеств всех веществ, участвующих в реакции, а какая — дальше всего? Все вещества газообразные, температура и давление постоянны.
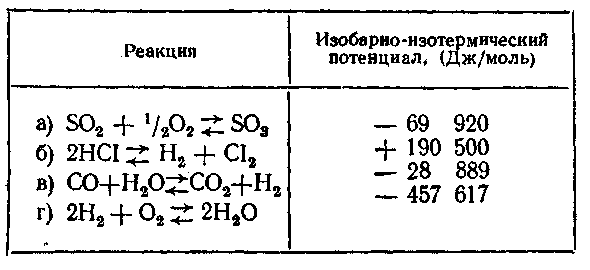
Задачи
49. Определите максимальную работу, которую можно получить, если к воде при 100 °С подводится 4000 Дж теплоты, а температура конденсата 20 °С.
50. Сравните термодинамическую эффективность паровой машины и машины, работающей на ртутном паре, если котел первой имеет температуру 200 °С, второй 460 °С, а холодильник каждой из машин имеет температуру 30 °С.
51*. В термостате поддерживается температура 96,6 °С Температура воздуха в комнате 26,9 °С. Потеря теплоты через изоляцию термостата за некоторый промежуток времени составляет 4187 Дж. Найдите общее изменение энтропии.
52. Определите изменение энтропии при плавлении меди массой 63,5 г, если теплота плавления меди равна 12 980 Дж/моль, а температура плавления меди 1083 °С.
53. Вычислите изменение энтропии при плавлении свинца массой 100 г, если температура плавления свинца 327,4 °С, а теплота плавления 5485 Дж/моль.
54. В двух сосудах одинаковой вместимости находится: в первом азот массой 2,8 г, во втором аргон массой 4 г. Определите изменение энтропии при диффузии, возникающей в результате соединения сосудов с газами. Температура и давление постоянны.
55. Найдите изменение энтропии в процессе обратимого изотермического сжатия 1 моль кислорода от 1,013 • 105до 10,13 • 105 Па.
56*. Как изменится энтропия 1 моль гелия при нагревании его от 20 до 70 °С, если объем газа при этом изменился от 24 до 28,1 л?
57*. Вода массой 100 г при 25 °С превращена в пар с температурой 150 °С и давлением 1,013 • 105 Па. Вычислите изменение энтропии этого перехода, если удельная теплота испарения воды при 100 °С равна 2257 Дж/г, удельная теплоемкость воды 4,187Дж/(г • К), а удельная теплоемкость водяного пара при давлении 1,013 • 105 Па равна 1,968 Дж/(г * К).
58*. Рассчитайте изменение энтропии при смешении 1 моль водорода с 1 моль азота при давлении 1,013 • 105 Па и постоянной температуре.
59*. Найдите изменение энтропии при переходе 3 моль кислорода от объема 0,0336 м3 под давлением 2,026 • 105 Па к объему 0,0672 м3 под давлением 1,013 • 105 Па. Молярная теплоемкость кислорода Ср равна 29,37 ДжДмоль • К), температура постоянна.
