- •Дисперсні системи. Поняття про розчини
- •1. Поняття про розчини
- •2. Розчинність газів та твердих речовин
- •3. Дисперсні системи. Колоїди
- •4. Осмотичний тиск
- •5. Роль осмосу в живих організмах
- •6. Тиск пари розчинів
- •Де 1 і 2 – відповідно кількість розчиненої речовини і розчинника, моль.
- •7. Температури кристалізації і кипіння розчинів
- •І замерзання деяких розчинів
- •8. Способи вираження концентрації розчинів
- •540 Г складає 27 мастин
- •9. Теорія електролітичної дисоціації
- •Натрій хлориду у водному розчині
- •10. Іонні рівняння реакцій
- •1. Утворення малодисоційованої сполуки.
- •2. Утворення малорозчинної сполуки.
- •3. Утворення газоподібної сполуки.
- •11. Лабораторна робота Фізико-хімія дисперсних систем
- •Приготування розчину натрій хлориду Приготування розчину натрій хлориду з заданою масовою часткою.
- •12. Контрольні запитання
6. Тиск пари розчинів
Пара, що знаходиться у рівновазі з рідиною, називається насиченою. Для кожної рідини характерний визначений тиск насиченої пари, який збільшується з підвищенням температури. Встановлено, що при розчинен-ні будь-якої нелеткої речовини у певному розчиннику тиск насиченої пари над розчином буде меншим, ніж тиск насиченої пари над чистим розчин-ником при сталій температурі.
Цей факт обумовлений такими властивостями:
– зменшенням ефективної поверхні випаровування розчину у порів-нянні з чистим розчинником, оскільки частину поверхні розчину зайнято нелеткими молекулами розчиненої речовини;
– взаємодією між молекулами розчиненої речовини і розчинника з ут-воренням гідратів (розчинник – вода) або сольватів (неводний розчинник), стійкіших, ніж з’єднання молекул розчинника між собою.
Якщо позначити тиск пари розчинника Р0 , а тиск розчину – Р, то різ-ниця Р0 – Р = Р показує величину зниження тиску пари. Відношення цієї різниці до тиску пари розчинника дає так зване відносне зниження тиску пари розчинника:
|
(111) |
У 1887 році французький фізик Рауль, вивчаючи розчини різних не-летких рідин і речовин у твердому стані, встановив закон, що пов’язує зни-ження тиску пари над розбавленими розчинами неелектролітів з концен-трацією (перший закон): відносне зниження тиску насиченої пари роз-чинника над розчином дорівнює мольній частці розчиненої речовини.
Математичний вираз закону Рауля має такий вигляд:
|
(112) |
Де 1 і 2 – відповідно кількість розчиненої речовини і розчинника, моль.
7. Температури кристалізації і кипіння розчинів
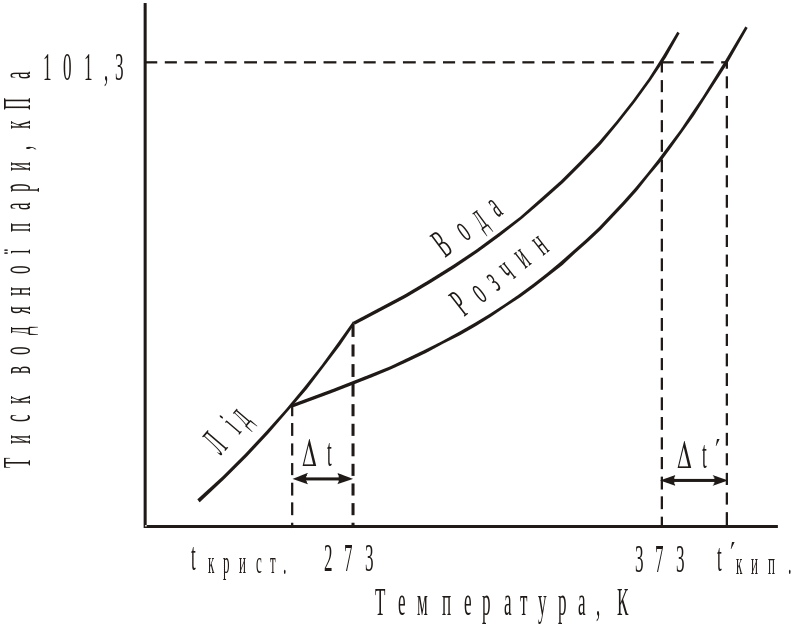
Температури замерзання і кипіння розчинів залежать від тиску пари над розчином. Внаслідок зниження тиску пари над розчином температу-ра кипіння розчину завжди вища, ніж чистого розчинника (рис. 38).
Різниця між температурами кипіння розчину нелеткої ре-човини і чистого розчинника називається підвищенням тем-ператури кипіння (tкип.). Рідина завжди кристалізу-ється, коли тиск її пари досягає тиску насиченої пари відповід-ної твердої фази. Як видно із рис. 38, тиск пари льоду досяга-ється у розчині при більш низь-кій температурі, ніж у розчин-ника (води). |
|
Рис. 38. Пониження температури криста-лізації і підвищення температури кипіння водних розчинів |
Різницю між температурами кристалізації чистого розчинника і розчину називають пониженням температури кристалізації (tкрист.).
Залежність між пониженням температури замерзання і підвищенням температури кипіння і концентрацією розчинів визначається другим зако-ном Рауля: для розведених розчинів підвищення температури кипіння і зниження температури замерзання пропорційні моляльній концентра-ції розчину.
Математичний вираз закону Рауля має вигляд:
tкип.= ЕСm; |
(113) |
tкрист.= КСm, |
(114) |
де К і Е – відповідно ебуліоскопічна та кріоскопічна сталі; Сm – моляльна концентрація розчину.
Ебуліоскопічною сталою називається молекулярне підвищення темпе-ратур кипіння, тобто підвищення, яке спостерігається при розчиненні 1 моля речовини в 1000 г розчинника; кріоскопічною сталою – зниження температур кристалізації, що відповідає розчиненню 1 моля речовини в 1000 г розчинника, тобто молекулярне зниження.
Ебуліоскопічна та кріоскопічна сталі залежать від природи розчинника, але не залежать від природи розчиненої речовини. У табл. 18 наведено ебуліоскопічну та кріоскопічну сталі деяких розчинників.
Таблиця 18. Характеристики процесів кипіння