
- •1. Константы кислотности (Кк) и основности (Ко) слабых электролитов в водных растворах при 298,15 к [1–4]
- •2. Произведения растворимости (пр) малорастворимых электролитов в водном растворе при 298,15 k [1, 2, 4–6]
- •3. Стандартная энтропия (s0298), изменение стандартной энтальпии (h0298) и энергии гиббса (g0298) образования веществ при 298,15 k [1, 4, 5, 7]
- •4. Кислотно-основные индикаторы [2]
- •5. Окислительно-восстановительные индикаторы [2]
- •6. Индикаторы в комплексометрии (металлоиндикаторы) [2]
- •7. Стандартные потенциалы (e0) окислительно-восстановительных пар в водном растворе при 298,15 k [1–4]
- •8. Приближенные значения коэффициентов активности () ионов при различных ионных силах раствора () [7]
- •9. Криоскопические (kт) и эбуллиоскопические (eт) коэффициенты
- •10. Общие константы образования комплексов (n) в водном растворе при 298,15 к [1, 2]
- •11. Плотности (), массовые доли () и молярные концентрации (с) растворов при 293 к [2, 3]
- •Библиографический список
- •620002, Екатеринбург, ул. Мира, 19
- •620002, Екатеринбург, ул. Мира, 19
6. Индикаторы в комплексометрии (металлоиндикаторы) [2]
Индикатор |
Определяемые ионы |
рН |
Переход окраски |
Ализариновый красный С |
Th4+, РЗЭ3+, Sc3+ Al3+ |
2,2–3,4 3,5–3,6 |
розовая – желтая |
Арсеназо I |
Pu4+, Th4+, U4+ РЗЭ3+ Ca2+, Mg2+ |
2 7 10 |
фиолетовая – розовая (оранжевая) |
Кислотный хром синий Т |
Ca2+, Mg2+, Pb2+, Zn2+ |
10–12 |
красная – сине-фиолетовая |
Индикатор |
Определяемые ионы |
рН |
Переход окраски |
Ксиленоловый оранжевый |
Zr4+, Th4+, Bi3+, Sc3+, In3+ Cd2+, Co2+, Fe2+, Pb2+, Zn2+, РЗЭ3+ Ba2+, Cd2+, Mg2+, Sr2+ |
1–3 5–6
11–12 |
красная (красно-фиолетовая) – желтая красная – синяя |
Мурексид |
Co2+, Cu2+, Ni2+, Zn2+ Ag+, Ca2+ |
7–9 11–12 |
красная (оранжевая) – фиолетовая |
ПАН (пиридил-азонафтол) |
Bi3+, In3+, Tl3+, Th4+ Cu2+, Ni2+, UO22+ Zn2+, Cd2+ |
1,8–3,5 3–5 4–6 |
красная (розовая) – желтая (желто-зеленая) |
Пирокатехиновый фиолетовый |
Bi3+, Ga3+ Cu2+, Pb2+, Fe3+, In3+ Cd2+, Co2+, Ni2+, Mn2+, Mg2+, Zn2+ |
2–3,5 5–6,5 8–10 |
синяя – желтая
зеленовато-голубая – красно-фиолетовая |
Торон |
Th4+, U4+ Sc3+, Y3+ |
1–3 4,5–6 |
фиолетовая (розовая) – желтая |
Хромазурол С |
Th4+ Al3+, VO2+ Ca2+, Mg2+ |
1–3 4 11 |
красно-фиолетовая – желтая (оранжевая) |
Эриохром черный Т |
Al3+, Ga3+, In3+ Ba2+, Bi3+, Ca2+, Cd2+, Co2+,Mg2+, Mn2+, Zn2+, Ni2+, Pb2+,VO2+ и др. |
7–9 9–10 |
винно-красная – синяя |

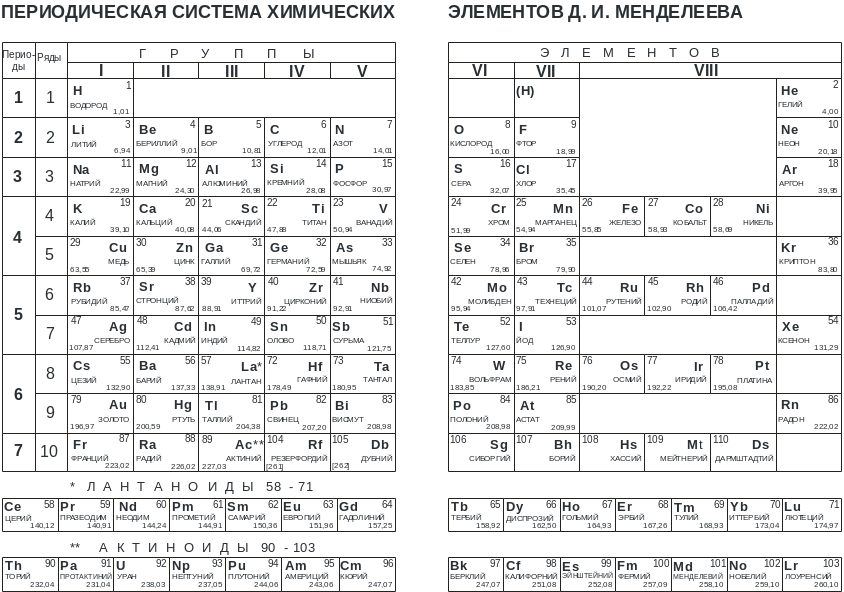
7. Стандартные потенциалы (e0) окислительно-восстановительных пар в водном растворе при 298,15 k [1–4]
Приведены значения E0 электрохимических полуреакций восстановления некоторых окисленных форм (атомов, молекул, ионов, формульных единиц) Ox + ne = Red, где n – число участвующих в процессе электронов (e). Все окисленные (Ox) и восстановленные (Red) формы, находящиеся в водном растворе, считаются гидратированными. Нейтральные частицы в растворе отмечены индексом (р). Агрегатное состояние жидких (ж) и газообразных (г) веществ указано также нижним индексом, а для твердых веществ обозначение опущено.
Элемент |
Электрохимическая полуреакция |
Е0, B |
Ac |
Ac3+ + 3e = Ac |
-2,600 |
Ag |
Ag+ + e = Ag |
+0,799 |
AgBr + e = Ag + Br- |
+0,071 |
|
[Ag(CN)2] + e = Ag + 2CN |
-0,430 |
|
AgCl + e = Ag + Cl |
+0,222 |
|
AgI + e = Ag + I |
-0,151 |
|
Al |
Al3+ + 3e = Al |
-1,700 |
AlO2 + 2H2O +3e = Al + 4OH |
-2,35 |
|
Am |
Am3+ + 3e = Am |
-2,320 |
As |
AsO2 + 2H2O +3e = As + 4OH |
-0,68 |
AsO43 + 2H2O +2e = AsO2 + 4OH |
-0,67 |
|
HAsO2(р) + 3H+ +3e = As + 2H2O |
+0,25 |
|
H3AsO4(р) +2H+ + 2e = HAsO2(р) + 2H2O |
+0,56 |
|
Au |
Au+ + e = Au |
+1,691 |
Au3+ + 3e = Au |
+1,498 |
Элемент |
Электрохимическая полуреакция |
Е0, B |
Au |
[Au(CN)2] + e = Au + 2CN |
-0,764 |
Ba |
Ba2+ +2e = Ba |
-2,905 |
Be |
Be2+ + 2e = Be |
-1,847 |
Bi |
Bi3+ + 3e = Bi |
+0,317 |
BiCl4 + 3e = Bi + 4Cl |
+0,168 |
|
BiO+ + 2H+ + 3e = Bi + H2O |
+0,320 |
|
NaBiO3 + 4H+ + 2e = BiO+ + Na+ + 2H2O |
>+1,8 |
|
Br |
Br2(ж) + 2e = 2Br |
+1,065 |
BrO + H2O + 2e = Br + 2OH |
+0,76 |
|
2BrO3 + 12H+ + 10e = Br2(р) + 6H2O |
+1,52 |
|
2BrO3 +6H2O + 10e = Br2(р) + 12OH |
+0,50 |
|
BrO3 + 6H+ + 6e = Br + 3H2O |
+1,45 |
|
BrO3 + 3H2O + 6e = Br + 6OH |
+0,61 |
|
HBrO(р) + H+ + 2e = Br + H2O |
+1,34 |
|
C |
2CO2(г) + 2H+ + 2e = H2C2O4(р) |
-0,47 |
CO2(г) + N2(г) + 6H+ + 6e = H2O + CO(NH2)2(р) карбамид |
+0,1 |
|
CO2 + 2H+ + 2e = CO + H2O |
-0,104 |
|
C6H4O2(р) + 2H+ +2e = C6H4(OH)2(р) хинон гидрохинон |
+0,70 |
|
HCOOH(р) +2H+ +2e = HCHO(р) + H2O |
-0,01 |
|
HCOO + 2H2O + 2e = HCHO(р) + 3OH |
-1,07 |
|
Ca |
Ca2+ + 2e = Ca |
-2,864 |
Cd |
Cd2+ + 2e = Cd |
-0,404 |
Ce |
Ce3+ + 3e = Ce |
-2,483 |
Ce4+ + e = Ce3+ |
+1,743 |
|
CeCl62 + e = Ce3+ +6Cl |
+1,28 |
|
Ce(ClO4)62 + e = Ce3+ + 6ClO4 |
+1,70 |
Элемент |
Электрохимическая полуреакция |
Е0, B |
Ce |
CeO2 + 4H+ + e = Ce3+ + 2H2O |
+1,293 |
Ce(NO3)62 + е = Ce3+ + 6NO3 |
+1,61 |
|
Ce(SO4)32 + e = Ce3+ + 3SO42 |
+1,44 |
|
Cl |
Cl2(г) + 2e = 2Cl |
+1,358 |
HClO(р) + H+ +2e = Cl + H2O |
+1,494 |
|
ClO + H2O +2e = Cl + 2OH |
+0,88 |
|
HClO2(р) +3H+ +4e = Cl + 2H2O |
+1,57 |
|
ClO2 + 2H2O +4e = Cl +4OH |
+0,77 |
|
ClO3 + 6H+ +6e = Cl +3H2O |
+1,451 |
|
2 ClO3 + 12H+ +10e = Cl2(г) + 6H2O |
+1,47 |
|
ClO3 +3H2O +6e = Cl + 6OH |
+0,63 |
|
ClO4 +8H+ +8e = Cl + 4H2O |
+1,38 |
|
ClO4 + 4H2O +8e = Cl +8OH |
+0,56 |
|
Co |
Co2+ + 2e = Co |
-0,277 |
Co3+ + e = Co2+ |
+1,380 |
|
Co(NH3)63+ + e = Co(NH3)62+ |
+0,178 |
|
Cr |
Cr3+ +3e = Cr |
-0,74 |
Cr3+ + e = Cr2+ |
-0,409 |
|
CrO42 +4H2O +3e = Cr(OH)3 + 5OH |
-0,125 |
|
CrO42 + 4H2O + 3e = [Cr(OH)4] + 4OH |
-0,165 |
|
Cr2O72 +14H+ +6e = 2 Cr3+ +7H2O |
+1,333 |
|
Cs |
Cs+ + e = Cs |
-2,923 |
Cu |
Cu+ + e = Cu |
+0,52 |
Cu2+ + 2e = Cu |
+0,338 |
|
Cu2+ + e = Cu+ |
+0,158 |
|
Cu2+ + I +e = CuI |
+0,86 |
|
[Cu(CN)2] + e = Cu + 2CN |
-0,43 |
Элемент |
Электрохимическая полуреакция |
Е0, B |
Cu |
Cu(NH3)42+ + e = Cu(NH3)2+ +2NH3(р) |
-0,01 |
CuI + e = Cu + I |
-0,185 |
|
Eu |
Eu3+ + e = Eu2+ |
-0,429 |
F |
F2 + 2e = 2F- |
+2,866 |
Fe |
Fe2+ + 2e = Fe |
-0,441 |
Fe3+ + e = Fe2+ |
+0,771 |
|
Fe3+ +3e = Fe |
-0,058 |
|
[Fe(CN)6]3- + e = [Fe(CN)6]4- |
+0,543 |
|
Fe3O4 + 2e +8H+ = 3Fe2+ + 4H2O |
+1,21 |
|
H |
2H+ +2e = H2(г) |
0,000 |
2H2O + 2e = H2(г) +2OH (среда нейтральная) |
-0,414 |
|
2H2O + 2e = H2(г) +2OH |
-0,828 |
|
H2 + 2e = 2H |
-2,23 |
|
Hg |
Hg2+ + 2e = Hg(ж) |
+0,852 |
2Hg2+ + 2e = Hg22+ |
+0,908 |
|
Hg22+ + 2e = 2Hg(ж) |
+0,79 |
|
Hg2Cl2 +2e = 2Hg(ж)+ 2Cl |
+0,268 |
|
I |
I2 +2e = 2I |
+0,535 |
HIO(р) + H+ +2e = I + H2O |
+0,99 |
|
IO + H2O +2e = I + 2OH |
+0,49 |
|
2HIO(р) +2H+ +2e = I2 + 2H2O |
+1,45 |
|
2IO3 + 12H+ + 10e = I2 + 6H2O |
+1,19 |
|
2IO3 + 6H2O + 10e = I2 + 12OH |
+0,21 |
|
IO3 +6H+ +6e = I + 3H2O |
+1,09 |
|
IO3 + 3H2O +6e = I + 6OH |
+0,26 |
|
IO4 +8H+ +8e = I + 4H2O |
+1,4 |
|
IO4 +2H+ +2e = IO3 + H2O |
+1,65 |
Элемент |
Электрохимическая полуреакция |
Е0, B |
I |
H5IO6 +7H+ + 8e = I + 6H2O |
+1,24 |
H5IO6 + H2O + 8e = I + 7OH |
+0,37 |
|
K |
K+ + e = K |
-2,924 |
La |
La3+ + 3e = La |
-2,522 |
Li |
Li+ + e = Li |
-3,045 |
Mg |
Mg2+ + 2e = Mg |
-2,37 |
Mn |
Mn2+ +2e = Mn |
-1,192 |
MnO4 + e = MnO42 |
+0,558 |
|
MnO4 + 2H2O +3e = MnO2 + 4OH |
+0,57 |
|
MnO4 + 8H+ +5e = Mn2+ +4H2O |
+1,531 |
|
MnO2 + 4H+ +2e = Mn2+ + 2H2O |
+1,239 |
|
Mo |
Mo 3+ + 3e = Mo |
-0,2 |
H2MoO4 + 6H+ + 6e = Mo + 4H2O |
0,0 |
|
H2MoO4 + 6H+ + 3e = Mo 3+ + 4H2O |
+0,20 |
|
H2MoO4 + 2H+ + e = MoO2+ + 2H2O |
+0,4 |
|
MoO2+ + 4H+ + 2e = Mo3+ + 2H2O |
0,00 |
|
MoO22+ +e = MoO2+ |
+0,48 |
|
N |
N2 + 2H2O + 4H+ +2e = 2(NH2OH∙H+) |
-1,871 |
N2 + 4H2O +2e = 2NH2OH + 2OH |
-3,04 |
|
N2 + 5H+ +4e = N2H4∙H+ |
-0,23 |
|
N2(г) + 4H2O +4e = N2H4(р) + 4OH |
-1,119 |
|
N2 + 8H+ +6e = 2NH4+ |
+0,26 |
|
N2 + 8H2O +6e = 2NH3∙H2O + 6OH |
-0,74 |
|
N2H4∙H+ + 3H++2e = 2NH4+ |
+1,27 |
|
N2H4(р) + 4H2O +2e = 2NH3∙H2O + 2OH |
+0,1 |
|
NH2OH∙H+ +2H+ +2e = NH4+ + H2O |
+1,35 |
|
HNO2(р) +H+ + e = NO(г) + H2O |
+0,99 |
Элемент |
Электрохимическая полуреакция |
Е0, B |
N |
NO2 + H2O + e = NO(г) + 2OH |
-0,453 |
2HNO2 + 4H+ +4e = N2O(г) + 3H2O |
+1,29 |
|
2HNO2 + 6H+ +6e = N2(г) + 4H2O |
+1,44 |
|
2NO2 + 4H2O +6e = N2(г) + 8OH |
+0,41 |
|
NO2 + 6H2O + 6e = NH3∙H2O + 7OH |
-0,15 |
|
HNO2 + 7H+ +6e = NH4+ + 2H2O |
+0,86 |
|
NO3 + 3H+ + 2e = HNO2(р) + H2O |
+0,94 |
|
NO3 + H2O + 2e = NO2 + 2OH |
+0,010 |
|
NO3 + 2H+ + e = NO2(г) + H2O |
+0,772 |
|
NO3 + H2O + e = NO2(г) + 2OH |
-0,86 |
|
NO3 + 4H+ + 3e = NO(г) + 2H2O |
+0,955 |
|
2NO3 + 5H2O + 8e = N2O(г) + 10 (OH) |
+1,116 |
|
2NO3 + 12H+ + 10e = N2(г) + 6H2O |
+1,244 |
|
NO3 + 10H+ + 8e = NH4+ + 3H2O |
+0,880 |
|
NO3 + 7H2O +8e = NH3∙H2O + 9OH |
-0,120 |
|
Na |
Na+ + e = Na |
-2,711 |
Ni |
Ni2+ + 2e = Ni |
-0,234 |
Np |
Np3+ + 3e = Np |
-1,856 |
Np4+ + e = Np3+ |
+0,155 |
|
NpO2+ + e + 4H+ = Np4+ + 2H2O |
+0,739 |
|
NpO22+ + e = NpO2+ |
+1,130 |
|
NpO22+ + 2e + 4H+ = Np4+ + 2H2O |
+0,938 |
|
О |
O2(г) + 4H+ +4e = 2H2O |
+1,229 |
O2(г) + 2H2O + 4e = 4OH (среда нейтральная) |
+0,815 |
|
O2(г) + 2H2O + 4e = 4OH |
+0,401 |
|
O2(г) + 2H+ + 2e = H2O2(р) |
+0,682 |
Элемент |
Электрохимическая полуреакция |
Е0, B |
O |
O2(г) + 2H2O + 2е = H2O2(р) + 2OH ( или O2 + H2O +2e = HO2 +OH) |
-0,076 |
H2O2(р) +2H+ + 2e = 2H2O |
+1,764 |
|
H2O2(р) +2e = 2OH |
+ 0,878 |
|
(или HO2 + H2O + 2e = 3OH) |
|
|
S2O8 2 +2e = 2SO42 |
+2,0 |
|
P |
H3PO4 + 2H+ + 2e = H3PO3 + H2O |
-0,276 |
Pb |
Pb2+ + 2e = Pb |
-0,126 |
Pb4+ + 2e = Pb2+ |
+1,69 |
|
PbO2 + 2e = Pb2+ + 2H2O |
+1,455 |
|
PbO2 + 4H+ + SO42 + 2e = PbSO4 + 2H2O |
+1,685 |
|
Pr |
Pr 4+ + e = Pr 3+ |
+1,60 |
Pt |
Pt2+ + 2e = Pt |
+0,963 |
Pu |
Pu3+ + 3e = Pu |
-2,031 |
Pu4+ + e = Pu3+ |
+0,967 |
|
PuO2+ + 4H+ + e = Pu4++ 2H2O |
+1,156 |
|
PuO22+ + e = PuO2+ |
+0,928 |
|
PuO22+ + 2e + 4H+ = Pu4+ + 2H2O |
+1,04 |
|
S |
S +2e = S2 |
-0,476 |
S + 2H+ +2e = H2S(р) |
+0,144 |
|
SO2(р) +4H+ + 4e = S + 2H2O |
+0,45 |
|
H2SO3 + 4H+ + 4e = S + 3H2O |
+0,45 |
|
SO32 + 3H2O + 4e = S + 6OH |
-0,66 |
|
SO42 + 4H+ + 2e = H2SO3 + H2O |
+0,17 |
|
SO42 + H2O + 2e = SO32 + 2OH |
-0,932 |
|
SO42 + 4H+ + 2e = SO2(г) + 2H2O |
+0,159 |
|
SO42 + 8H+ + 6e = S + 4H2O |
+0,36 |
Элемент |
Электрохимическая полуреакция |
Е0, B |
S |
SO42 + 10H+ + 8e = H2S(г) + 4H2O |
+0,31 |
SO42 + 4H2O + 8e = S2 + 8OH |
-0,68 |
|
2SO42 + 5H2O + 8e = S2O32 + 10 (OH) |
-0,76 |
|
S4O62 +2e = 2S2O32 |
+0,09 |
|
S2O82 +2e = 2SO42 |
+2,0 |
|
Se |
Se + 2H+ + 2e = H2Se(г) |
-0,36 |
Sm |
Sm3+ + e = Sm2+ |
-1,72 |
Sn |
Sn2+ + 2e = Sn |
-0,141 |
Sn4+ + 2e = Sn2+ |
+0,154 |
|
Sn(OH)62 + 2e = HSnO2 + 3OH + H2O |
-0,93 |
|
Te |
Te + 2H+ + 2e = H2Te(р) |
-0,7 |
Th |
Th4+ + 4e = Th |
-1,875 |
Ti |
Ti2+ + 2e = Ti |
-1,63 |
TiO2+ + 2H+ + e = Ti3+ + H2O |
+0,1 |
|
Tl |
Tl3+ + 2e = Tl+ |
+1,28 |
U |
U3+ + 3e = U |
-1,80 |
U4+ + 4e = U |
-1,50 |
|
U4+ + e = U3+ |
-0,631 |
|
UO2 + 2H2O + 4e = U + 4OH |
-2,39 |
|
UO2+ + 4H+ + e = U4+ + 2H2O |
+0,60 |
|
UO22+ + e = UO2+ |
+0,052 |
|
UO22+ + 2e = UO2 |
+0,45 |
|
UO22+ + 4H+ + 2e = U4+ + 2H2O |
+0,334 |
|
V |
V2+ + 2e = V |
-1,125 |
V3+ + e = V2+ |
-0,255 |
|
VO2+ + 2H+ + e = VO2+ + H2O |
+0,999 |
|
VO2+ + 4H+ + 2e = V3+ + 2H2O |
+0,668 |
Элемент |
Электрохимическая полуреакция |
Е0, B |
V |
VO2+ + 4H+ + 3e = V2+ + 2H2O |
+0,360 |
VO2+ + 4H+ +5e = V + 2H2O |
-0,25 |
|
VO2+ + 2H+ + e = V3+ + H2O |
+0,361 |
|
VO43 + 6H+ +2e = VO+ + 3H2O |
+1,26 |
|
HVO3 + 3H+ + e = VO2+ + 2H2O |
+1,1 |
|
Yb |
Yb 3+ + e = Yb 2+ |
-1,15 |
Zn |
Zn2+ + 2e = Zn |
-0,763 |
Zn(OH)42 + 2e = Zn + 4OH |
-1,255 |
