
- •Теоретичні основи теплотехніки методичні вказівки до самостійної роботи „Термодинаміка ідеальних газів”
- •Київ нухт 2007
- •Самостійна робота “ Термодинаміка ідеальних газів ”
- •Методичні вказівки до виконання та оформлення завдань
- •§1. Теплоємність ідеального газу
- •Задачі 1 – 10
- •§2.Термодинамічні процеси ідеального газу
- •§2.1. Ізохорний процес
- •Задачі 11 – 30
- •§2.2. Ізобарний процес
- •Задачі 31 – 50
- •§2.3. Ізотермічний процес
- •Задачі 51 – 70
- •§2.4. Адіабатний процес
- •Задачі 71 – 90
- •Контрольні завдання і запитання
- •Методичні вказівки до самостійної роботи „Термодинаміка ідеальних газів”
§1. Теплоємність ідеального газу
Якщо в результаті теплообміну тілу передається деяка кількість теплоти, то внутрішня енергія і температура тіла змінюються. Кількість теплоти Q, потрібна для нагрівання 1 кг речовини на 1 К називають питомою масовою теплоємністю речовини c, Дж/(кгК):
![]() (1)
(1)
В інших варіантах зручно використовувати питому молярну теплоємність речовини с , Дж/(кмольК):
![]() (2)
(2)
або
питому
об’ємну
теплоємність речовини
![]() ,
Дж/(м3К):
,
Дж/(м3К):
![]() (3)
(3)
де – молярна маса речовини.
За І законом термодинаміки зміна внутрішньої енергії тіла залежить не лише від отриманої кількості теплоти, а і від роботи, яку виконує тіло, тобто від характеру процесу. Така неоднозначність визначення теплоємності характерна лише для газоподібних речовин. При нагріванні рідин і твердих тіл їх об’єм практично не змінюється, і робота розширення дорівнює нулю. Тому вся кількість теплоти, отримана тілом, іде на зміну його внутрішньої енергії. На відміну від рідин і твердих тіл, газ у процесі теплообміну може значно змінювати свій об’єм і виконувати роботу. Внаслідок цього теплоємність газоподібної речовини залежить від характеру термодинамічного процесу. Розглядають два значення теплоємності газів: с – питому молярну теплоємність в ізохорному процесі (V = const) і сp – питому молярну теплоєм-ність в ізобарному процесі (p = const).
Співвідношення, яке відображає зв’язок між питомими молярними теплоємностями с та с p має такий вигляд (формула Майєра):
![]() ,
(4)
,
(4)
де R ─ універсальна газова стала, R=8324 Дж/(кмольК) .
Враховуючи співвідношення (2) та (3), формулу Майєра можна записати в іншому вигляді:
![]() ;
(5)
;
(5)
![]() .
(6)
.
(6)
Т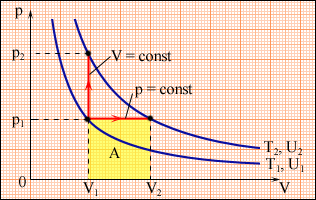 еплоємність
газу в процесі з постійним тиском завжди
більша теплоємності в процесі з постійним
об’ємом (рис.1). При p = const
газ додатково виконує роботу
L = p1(V2 – V1).
Тому
сp > с.
еплоємність
газу в процесі з постійним тиском завжди
більша теплоємності в процесі з постійним
об’ємом (рис.1). При p = const
газ додатково виконує роботу
L = p1(V2 – V1).
Тому
сp > с.
Рис.1. Ізобарний та ізохорний процеси нагрівання газу
Співвідношення теплоємностей у процесах з постійним тиском і постійним об’ємом називається показником адіабати, або коефіцієнтом Пуасона k:
![]() (7)
(7)
Між двома ізотермами з температурами T1 і T2 на діаграмі (p, V) можливі різні шляхи переходу. Оскільки у всіх цих варіантах зміна температури ΔT = T2 – T1 однакова, відповідно буде однаковою зміна внутрішньої енергії ΔU. Однак виконана при цьому робота L і отримана в результаті теплообміну кількість теплоти Q будуть різними для різних шляхів переходу. Це означає, що газ має нескінченну кількість теплоємностей, а теплоємності сp і с – це лише поодинокі варіанти.
При наближених розрахунках вважають, що теплоємність ідеального газу в інтервалі температур 0–150 С залежить не від температури газу, а лише від атомності газу – (кількості ступенів вільності), табл.2.
Таблиця 2
Гази |
Питома молярна теплоємність у процесі |
k |
|
ізохорному с , кДж/(кмольК) |
ізобарному с p , кДж/(кмольК) |
||
Одноатомні |
12,56 |
20,93 |
1,67 |
Двохатомні |
20,93 |
29,31 |
1,4 |
Три- та багатоатомні |
29,31 |
37,68 |
1,29 |
