
- •105066, Москва, Старая Басманная ул., 21/4
- •Допущено редакционно-издательским советом мгуиэ
- •Домашнее задание № 1. «Химическая кинетика» Элементы теории
- •Содержание домашнего задания №1
- •Вопросы для самоконтроля
- •Домашнее задание № 2. «Химическая термодинамика» Элементы теории
- •Содержание домашнего задания №2
- •Вопросы для самоконтроля
- •Домашнее задание № 3 - «Физико-химические расчеты по термодинамике фазовых равновесий
- •Часть I. Однокомпонентные системы. Расчет теплоты испарения вещества и определение его температуры кипения по данным о давлении насыщенного пара при различных температурах. Элементы теории
- •Содержание части 1 домашнего задания №3
- •Часть 2. Двухкомпонентные системы. Определение состава жидкопаровой смеси, температур начала и конца кипения жидкой смеси данного состава. Содержание части 2домашнего задания №3
- •Элементы теории
- •Вопросы для самоконтроля
- •Библиографический список
- •Содержание
![]()
ДОМАШНИЕ ЗАДАНИЯ
ПО ФИЗИЧЕСКОЙ ХИМИИ
Федеральное агентство по образованию
Московский государственный университет
инженерной экологии
Домашние задания
ПО ФИЗИЧЕСКОЙ ХИМИИ
Методические указания
Под редакцией проф. А.С. Лилеева
Москва
2011
Учебное издание
Составители:
Мишустин Александр Иванович,
Белоусова Кира Филипповна
Домашние задания
по физической химии
под редакцией проф. А.С.Лилеева
Подписано.в печать
Формат бум. 60 x 84 1/16.
Объем усл. п. л. . Уч.-изд. л.. Тираж 100 экз. Зак.
МГУИЭ, издательский центр,
105066, Москва, Старая Басманная ул., 21/4
УДК 541.1
ББК 24.5
М
Рецензенты:
Допущено редакционно-издательским советом мгуиэ
Мишустин А.И., Белоусова К.Ф.
М Домашние задания по физической химии: Методические указания /Сост.: А.И. Мишустин, К.Ф.Белоусова; под ред. А.С. Лилеева. - М.: МГУИЭ, 20. — с.
Методические указания предназначены студентам, обучающимся по всем специальностям МГУЭИ, при изучении дисциплины «Физическая химия».
УДК 544
ББК 24.5
© А.И. Мишустин, К.Ф. Белоусова, 20
© МГУИЭ, 20
Домашние задания по физической химии предусмотрены программой по этой дисциплине. С соответствующими разделами теории можно ознакомиться в учебнике [1]. Назначение данных методических указаний – помочь студентам разобраться в наиболее трудных и важных вопросах теории и методах расчета, относящихся к контрольным домашним заданиям.
Каждое домашнее задание содержит определенный перечень вопросов. Это в основном вопросы, для ответа на которые нужно выполнить расчеты. Есть и теоретические вопросы, требующие письменного ответа. Студент выполняет свой вариант задания, выданный ему преподавателем.
При выполнении расчета нужно указать какая формула используется, какие цифры в нее подставлены, каков конечный результат, какова размерность найденной величины. При использовании сложных формул следует указывать все промежуточные цифры расчета. Графики выполняются на миллиметровой бумаге (формат А4). На осях графика должна быть указана отложенная величина, единицы ее измерения, наносятся также масштабные единицы (но не координаты точек). Масштаб следует выбирать таким, чтобы 1 см был кратен 1, 2 или 5 единицам значений или этим же значениям, умноженным на 10 ±x , где x – целое число.
Домашнее задание следует оформлять на листах формата А4. Первый лист – титульный, на нем указывается название вуза, номер и вариант домашнего задания; фамилия студента и преподавателя, год. На втором листе должны быть расположены таблицы (по предлагаемой форме) с исходными, конечными, справочными данными. Третий и последующий листы должны содержать расчеты и ответы на теоретические вопросы. Листы следует пронумеровать и скрепить скрепкой (не степлером) или поместить в файл. При исправлении ошибок, замеченных преподавателем, нужно аккуратно зачеркнуть (не замазать) неправильный ответ и написать правильный, используя, при необходимости, новый лист бумаги.
В расчетах, если не оговорено другое, используется система единиц СИ.
Домашнее задание № 1. «Химическая кинетика» Элементы теории
Химические реакции, протекающие в одну стадию, называются простыми. Такие реакции различают по молекулярности
Молекулярность реакции определяется числом частиц, принимающих участие в элементарном акте химического взаимодействия.
Молекулярность может быть равна 1, 2 или 3, соответственно, различают моно- би- и тримолекулярные реакции. Для простых реакций молекулярность совпадает с порядком реакции, а порядки по компонентам совпадают с наименьшими целочисленными стехиометрическими коэффициентами в левой части химического уравнения. Фактически, если известна молекулярность реакции, то понятен и ее истинный механизм, для установления которого проводят серьезные исследования.
Рассмотрим кинетику простых реакций 1, 2 и 3-го порядков.
Реакции первого порядка: A L+ M
Порядок реакции (n) равен 1. Пусть концентрация вещества А (СА) равна С, тогда скорость реакции (w=-dС/dt) в соответствии с законом действующих масс равна
-dС/dt = kС.
Латинская буква d здесь и далее обозначает знак дифференциала, то есть бесконечно малого изменения величины. Разделим переменные: -dС/С=kdt, проинтегрируем:-lnС = kt + const, определим константу интегрирования, учитывая, что в начальный момент времени: t = 0, С = С0, отсюда const = -lnС0. В итоге получаем: lnС – lnС0 =- kt,
ln(С/С0) = - kt, С = С0 e-kt . (1.1, 1.2)
Уравнения (1.1) и (1.2) называются кинетическими уравнениями реакции первого порядка в логарифмической (1.1) и экспоненциальной (1.2) форме.
Важной кинетической характеристикой процесса является время полупревращения (1/2), то есть время, в течение которого прореагировала половина взятого вещества.
Определим эту величину для реакции первого порядка: С = 1/2С0, ln(С0/С) = ln2/k1/2,
1/2 = ln2/k = 0,69/k. (1.3)
Время полупревращения в этом случае не зависит от начальной концентрации исходного вещества.
Размерность константы скорости для реакций первого порядка: [k] = [с]-1.
Реакции второго порядка: А + В L.
Порядок реакции равен 2. Пусть СA = СB = С. Тогда -dС/dt = kС2, -dС/С2 = kdt. После интегрирования и с учетом начальных условий (t = 0, С = С0) получаем:
1/С – 1/С0= kt. (1.4)
Время полупревращения для реакций второго порядка обратно пропорционально начальной концентрации:
1/2 = 1/(kС0). (1.5)
Размерность константы скорости: [k] = [л/(моль с)].
Реакции третьего порядка: А + В + D L.
Величина n равна 3. Пусть СA = СB = СD = С, тогда -dС/dt = kС3, -dС/С3 = kdt. После интегрирования, учитывая начальные условия (t = 0, С = С0), получаем:
1/С2 – 1/С02= 2kt. (1.6)
Время полупревращения для реакций третьего порядка обратно пропорционально квадрату начальной концентрации:
1/2 = 3/(2kС02). (1.7)
Размерность константы скорости: [k] = [л2/(моль2 с)].
В представленных кинетических уравнениях под символом «С» понимают текущую, то есть наблюдаемую в данный момент времени молярную концентрацию соответствующих исходных веществ (С = Cт.). Существует также понятие прореагировавшей концентрации (Cпр), характеризующее ту часть концентрации данного исходного вещества, которая превратилась в конечный продукт. Прореагировавшая концентрация связана с текущей и исходной (C0) соотношением:
С0 = Cт + Cпр (1.8).
В расчетах по уравнениям (1.1-1.7) нужно знать величину константы скорости реакции (k). Эту характеристику можно найти с помощью уравнения Аррениуса, если известны предэкспоненциальный множитель (k0), энергия активации (Е) и температура (Т):
k = k0e-E/RT (1.9)
Значение константы скорости можно также определить графическим способом. Так, уравнения (1.1), (1.4) и (1.6) представляют собой прямолинейную зависимость соответствующих функций концентраций от времени: при n = 1 линейно от времени зависит lnC, при n = 2 – 1/С, при n = 3 – 1/С2 (рис. 1, 2, 3). На этой закономерности основан графический метод определения порядка реакции, позволяющий также определить и значение k.
Пусть n = 1 или 2. Тангенс угла наклона (α) соответствующей прямой к оси Х (ось времени) равен константе скорости (рис 1.1, 1.2) - tgα = k. При n = 3 удвоенная константа скорости равна тангенсу угла (α) наклона прямой (рис. 1.3) - 2 tgα = k. Не представляет затруднений нахождение времени полупревращения из этих графиков.

ln(C0/2)
Рис. 1.1
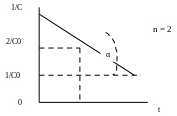
1/2
½
Рис. 1.2

t
Рис. 1.3
В присутствии катализатора скорость химической реакции возрастает, что связано с изменением механизма реакции, приводящего к снижению энергии активации процесса. При катализе катализатор и реагирующее вещество образуют промежуточное соединение, которое в результате дальнейших преобразований превращается в конечный продукт, высвобождая катализатор. Энергетические затраты таких процессов ниже, чем в отсутствии катализатора. Каталитические реакции являются сложными, так как протекают в несколько стадий. Скорость процесса определяется скоростью самой медленной стадии катализа.
Величиной, определяющей ускорение реакции в при катализе, является соотношение констант скоростей реакций в присутствии (kк) и отсутствии (k) катализатора: kк/ k. Это значение можно рассчитать, если известна величина снижения энергии активации ∆Е. В расчетах будем полагать, что рассматриваемая реакция является односторонней, то есть необратимо протекает слева направо в соответствии с уравнением реакции.
Пусть ЕК = (Е - Е) – энергия активации прямой реакции в присутствии катализатора, Е – то же, но без катализатора. Тогда константа скорости прямой реакции в присутствии катализатора - kK = k0 exp[-(E - E)/RT], без катализатора - k1 = k0 exp(-E/RT).
Ускорение при катализе равно:
kK/ k = exp (E)/RT). (1.10)
