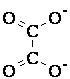- •Http://www.Chem-astu.Ru/chair/study/genchem/index.Html 1 химическая термодинамика и термохимия
- •1.1 Первое начало термодинамики. Закон гесса
- •1.2 Направленность химических процессов
- •Http://www.Chem-astu.Ru/chair/study/genchem/index.Html 2 химическая кинетика и химическое равновесие
- •2.1 Кинетика химических реакций
- •2.2 Скорость реакции в гетерогенных системах
- •2.3 Химическое равновесие
- •Http://www.Chem-astu.Ru/chair/study/genchem/index.Html 4 растворы
- •4.1 Концентрация растворов. Растворимость веществ
- •4.2 Процессы, сопровождающие растворение
- •4.3 Растворы электролитов
- •4.3.1 Электролитическая диссоциация
- •4.3.3 Смещение ионных равновесий
- •4.3.4 Гидролиз солей
- •Http://www.Chem-astu.Ru/chair/study/genchem/index.Html 5 комплексные соединения
- •5.1 Строение комплексных соединений
Http://www.Chem-astu.Ru/chair/study/genchem/index.Html 5 комплексные соединения
5.1 Строение комплексных соединений
Ионы некоторых элементов способны присоединять к себе другие ионы или нейтральные молекулы (например, NH3), образуя более сложные комплексные ионы. При их связывании с ионами противоположного знака получаются различные комплексные соединения. Наиболее полно свойства и строение комплексных соединений объясняет координационная теория, предложенная в 1893 г. А. Вернером.
Основные положения координационной теории. В молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем (центральным ионом). Вокруг него в непосредственной близости расположено (координировано) некоторое число противоположно заряженных ионов или нейтральных молекул, называемых лигандами и образующих внутреннюю координационную сферу. Остальные ионы находятся на более далеком расстоянии от центрального иона и составляют внешнюю координационную сферу.
Количество лигандов, окружающих центральный ион, называется координационным числом.
Внутренняя сфера комплекса в значительной степени сохраняет стабильность в растворе (ее границы в формуле показывают квадратными скобками). Ионы внешней сферы в растворе легко отщепляются.
При взаимодействии солей PtCl4 и KСl образуется комплексное соединение:
PtCl4 + 2 KCl K2[PtCl6] (или PtCl42KCl)
Здесь внутренняя сфера состоит из комплексообразователя Pt4+, лигандов Cl–, а внешняя сфера – из ионов K+. Координационное число (КЧ) равно 6. Диссоциация * такой соли происходит по уравнению:
K2[PtCl6] 2 K+ + [PtCl6]2–
Для установления принадлежности ионов к внешней или внутренней сфере часто пользуются реакциями ионного обмена. Например, при взаимодействии 1 моля PtCl44NH3 c AgNO3 осаждаются 2 моля AgCl:
PtCl44NH3 + 2 AgNO3 PtCl2(NO3)24NH3 + 2 AgCl
Следовательно, два иона Cl– принадлежат к внешней, а два других – к внутренней сфере комплекса, и формула соли имеет вид: [PtCl2(NH3)4]Cl2.
Анализируя координационные числа многих комплексных соединений, А. Вернер пришел к выводу, что степень окисления * центрального атома является основным фактором, влияющим на координационное число. Наиболее характерные координационные числа приведены в таблице:
Степень окисления центрального атома |
+1 |
+2 |
+3 |
+4 |
КЧ |
2 |
4 или 6 |
6 или 4 |
6 или 8 |
Например, координационное число 6 встречается в комплексных соединениях Pt4+, Cr3+, Co3+, Fe3+, координационное число 4 – в комплексах Cu2+, Zn2+, Pd2+, Pt2+, координационное число 2 – в комплексах Ag+, Cu+.
Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда, в частности, его дентатностью. Лиганды, занимающие во внутренней сфере одно место, называются монодентатными. Существуют лиганды, занимающие во внутренней сфере два или несколько мест. Такие лиганды называются бидентатными или полидентатными. Например:
|
бидентатный лиганд (оксалат-ион C2O42–) |
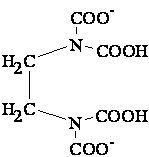
|
четырех- или шестидентатный лиганд (двухзарядный анион этилендиаминтетрауксусной кислоты) |