
- •Міністерство освіти і науки України
- •Практична робота № 1
- •Діагностика та індексація горизонтів
- •Практична робота № 3-4
- •Теоретична частина
- •Забарвлення грунтів
- •Хід роботи
- •Структура грунту
- •Хід роботи
- •Гранулометричний склад грунту
- •Класифікація механічних елементів ґрунту за їх величиною
- •Класифікація ґрунтів за гранулометричним складом
- •Органолептичні ознаки гранулометричного складу ґрунту
- •Органолептичні ознаки гранулометричного складу ґрунту
- •Хід роботи
- •Діагностика гранулометричного складу сухим методом
- •Діагностика гранулометричного складу грунту мокрим методом
- •Стан грунту
- •Хід роботи
- •Новоутворення
- •Біологічні новоутворення:
- •Хід роботи
- •Скипання
- •Лабораторна робота №1
- •1. У зважений алюмінієвий бюкс поміщають відважені на аналітичних вагах 10 г повітряно-сухого грунту, просіяного через сито з отвором 1мм.
- •Теоретичні відомості
- •А) Визначення капілярної вологоємності (кв) і швидкості капілярного підняття
- •Б) Визначення водопроникності ґрунту
- •В) Визначення повної вологоємності ґрунту (пв)
- •Г) Визначення найменшої вологоємності ґрунту (нв)
- •Д) Визначення максимальної водовіддачі ґрунту (мвв)
- •Контрольні запитання
- •Теоретичні відомості
- •Іі. Якісне виявлення вмісту карбонатів
- •Контрольні запитання
- •0,4Н розчин k2g2o7 у розведеній (1:1) н2so4;
- •0,2Н розчин солі Мора;
- •0,2% Розчину карбонату натрію;
- •1. З підготовленого для визначення гумусу грунту беруть наважку на аналітичній або електронній вазі. Величина її залежить від вмісту гумусу в грунті, і чим його більше, тим менша наважка:
- •3. Вливають у колбу з грунтом з бюретки точно 10мл 0,4н розчину k2Cr2o7, розчиненого в розведеній (1:1) сірчаній кислоті. Вміст обережно перемішують круговими рухами колби.
- •Гумус у різних типах грунтів неоднаковий і його характер визначається рядом умов і факторів:
- •Головні складові частини гумусу мають різну розчинність, тому їх можна розділити, екстрагуючи відповідними реактивами. Використовуючи послідовно водну та лужну витяжки, можна виділити:
- •А) Вивчення властивостей фульвокислот
- •Лабораторна робота №7
- •Теоретичні відомості
- •Хід роботи
- •1.Одержання колоїдів гумусу
- •2.Вивчення здатності колоїдів до дифузії
- •3.Визначення знаку заряду ґрунтових колоїдів
- •4.Електролітична коаґуляція ґрунтових колоїдів (на прикладі колоїдів гумусу)
- •5.Вивчення взаємної коагуляції ґрунтових колоїдів
- •Теоретичні відомості
- •Хід роботи
- •Визначення механічної поглинальної здатності грунту.
- •2. Визначення фізичної поглинальної здатності
- •3.Визначення хімічної поглинальної здатності
- •4. Визначення фізико-хімічної поглинальної здатності
- •Лабораторна робота № 9
- •Теоретичні відомості
- •Хід роботи
- •1. Насичення ґрунту різними катіонами:
- •Вивчення фільтраційних властивостей ґрунту, насичених різними катіонами:
- •3. Визначення характеру поверхні ґрунту.
- •Визначення реакції середовища ґрунту:
- •Лабораторна робота №10
- •Теоретичні відомості
- •Хід роботи
- •Теоретичні відомості
- •А. Ваговий метод визначення вмісту карбонатів у ґрунті Хід роботи
- •Лабораторна робота №12
Лабораторна робота №12
Тема: Визначення загального азоту в грунті.
Мета роботи: Навчитися визначати загальний азот в грунті методом К’єльдаля, правильно користуватися перегінним апаратом і робити відгін аміаку.
Обладнання і реактиви: Перегінний апарат з колбою К’єльдаля; конічна колба на 100 мл; мірний циліндр на 10 і 100 мл; наважка грунту; клаптик глянцевого паперу; промивалка з дистильованою водою.
Реактиви: 0,1 розчин H2SO4; 0,05н розчин KOH;
Концентрована (H2SO4, питома вага 1,84);
40% розчин KOH;
Мідний купорос CuSO4 5H2O в кристалах хімічно чистий;
Фенолфталеїн.
Теоретичні відомості
Найбільш поширеним методом визначення загального азоту в грунті є метод К’єльдаля.
Цей метод оснований на «мокрому» спалюванні або окисленні органічних речовин грунту концентрованою H2SO4 і переході азоту у форму мінеральних сполук (сульфат амонію).
Схематично, цей процес виглядає так.
Концентрована H2SO4 забирає з органічних речовин воду і обвуглює їх, тобто вуглеводи віддавши воду, утворюють вуглець.
Сірчана кислота при нагріванні частково розкладається на воду, сірчастий газ і кисень. Атомарний кисень у момент виділення окислює вуглець до вуглекислого газу, а водень у воду.
2H2SO4 – 2H2O + 2SO2 + O2
C + O2 = CO2
2H2 + O2 + 2H2O
Сірчаний газ відновлює азот до аміаку, а утворений аміак реагує з сірчаною кислотою і утворює сульфат амонію.
CH2NH2COOH + 3H2SO4 – NH3 + 2CO2 + 3SO2 + 4H2O
2NH3 + H2SO4 = (NH4)2SO4
Для прискорення процесу окислення органічних речовин застосовують каталізатори (мідний купорос, сульфат кальцію та інші).
При взаємодії сульфату амонію з лугом ( КОН ) відбувається виділення аміаку, який разом з парою води вбирається титрованим 0,1 н розчином H2SO4.
(NH4)2SO4 + KOH = 2NH3 + 2H2O + K2SO4
2NH3 + H2SO4 = (NH4)2SO4
Відтитрувавши надлишок кислоти лугом, визначають кількість аміачного азоту зв’язаного кислотою, а потім і вміст загального азоту в грунті.
Тепер широко застосовують визначення загального азоту з малих наважок грунту. Для аналізу беруть невеликі наважки грунту 0,2-1,0 г і після «мокрого» спалювання весь вміст піддають перегонці, тобто роблять відгін аміаку.
ХІД РОБОТИ
На клаптику глянцевого паперу, за допомогою електронної ваги, зважуємо 1,0 г розтертого у фарфоровій ступці і просіяного крізь сито(з отв.
0,25мм) повітряно-сухого грунту. Зважений грунт акуратно пересипають в термостійку конічну колбу не 100мл.
Паралельно беруть наважку (3-5г) цього ж грунту для визначення гігроскопічної вологи. Процентний вміст гігроскопічної вологи в грунті необхідний для визначення коефіцієнта гігроскопічності. ( Кгігр.=100/100-А); за допомогою якого вкінці досліду роблять перерахунок процентного вмісту загального азоту на абсолютно сухий грунт.
В конічну колбу з наважкою (1,0) грунту, доливають 10-15мл концентрованої сірчаної кислоти (з питомою вагою 1,84) і додають 0,5г мідного купоросу (CuSO4 5H2O).
Вміст обережно перемішують круговими рухами колби. Далі, за допомогою електроплитки, поставивши колбу на азбестову сітку, починаємо поволі її нагрівати. При цьому, в горло колбочки вставляємо зворотній холодильник.
Через деякий час (5-10хв) нагрівання збільшують, доводячи розчин до кипіння, і кип’ятять до повного знебарвлення розчину. При цьому, слідкують за процесом нагрівання і не допускають бурного кипіння. Знебарвлення розчину при нагрівання вказує на кінець мокрого спалювання, при цьому на дні колбочки мінеральний залишок матиме білуватий колір.
Після спалювання вміст колби охолоджують і переливають у колбу К’єльдаля для відгонки аміаку. У колбу К’єльдаля заздалегідь наливають невелику кількість дистильованої води. Лити дистильовану воду у концентровану сірчану кислоту не допускається, оскільки від сильного нагрівання утворені пари води можуть вибризкувати кислоту з колби і зробити опіки.
Колбочку в якій вели реакцію мокрого спалювання споліскують 2-4 рази дистильованою водою, обов’язково змиваючи й осад, що утворився на дні під час реакції. Перелиті речовини разом з долитою дистильованою водою повинні займати не більше половини об’єму перегінної колби (колби К’єльдаля). До розчину додають 3-4кр. Фенолфталеїну. Прилад для відгонки аміаку складають так, як показано на рис. 1.
Для уловлювання аміаку при відгонці в конічну колбу, місткістю 100-250мл, наливають з бюретки 20-40мл 0,1 н розчину сірчаної кислоти і додають туди 3-4кр. метилоранжу. Конічну колбочку із титрованим розчином сірчаної кислоти підставляють під холодильник приладу так, щоб вихідна трубка холодильника була занурена в кислоту.
У мірний циліндр наливають 50-65мл 40% розчину їдкого натру. Колбу для відгонки аміаку злегка нахиляють і по стінках в неї наливають луг так, щоб він не сильно перемішався з розчином.
Колбу швидко закривають пробкою, в яку встановлений краплевловлювач і добре збовтують вміст. Рідина до якої було добавлено фенолфталеїну, зразу забарвиться в малиновий колір. Коли цього не спостерігають, треба додати ще трохи лугу.
Колбу обережно нагрівають на електричній плитці через азбестову сітку. Доводять до кипіння і проводять перегонку доти, поки об’єм рідини в колбі зменшиться наполовину.
Треба уважно стежити, щоб кипіння було рівномірним, бо інакше рідину може засосати у колбу, і вся робота пропаде на марно. Щоб визначити, коли закінчилась відгонка, виймають кінець трубки холодильника, споліскують дистильованою водою, щоб змити кислоту і беруть краплю дистиляту не універсальний лакмусовий папірець. Якщо папірець посиніє, то відгонка ще не закінчена і її продовжують.
Після закінчення відгонки кінець холодильника виймають з розчину сірчаної кислоти, добре промивши його дистильованою водою. Промивні води зливають у колбу з кислотою. Надмір сірчаної кислоти відтитровують 0,1 н розчином NaOH до зміни забарвлення індикатора з рожевого на жовте.
При обчисленні беруть до уваги те, що 1мл 0,1 н розчину сірчаної кислоти зв’язує аміак, в якому міститься 0,0014г азоту.
ОБРОБКА РЕЗУЛЬТАТІВ
Вміст загального азоту в повітряно-сухому обчислюють за формулою:
(а-в) 0,0014 100
Nзаг.(%)= m
Де:
а – кількість мілілітрів 0,1н розчину H2SO4 у приймачі;
в – кількість мілілітрів 0,1н розчину NaOH яке пішло на титрування 0,1 н розчину H2SO4, що залишився не зв’язаним з аміаком;
m – наважка повітряно-сухого грунту.
Для перерахунку вмісту загального азоту на абсолютно сухий грунт, потрібно одержаний результат аналізу перемножити на коефіцієнт гігроскопічності.
__100__
Кгігр. =100 - 5,4 = 1,02
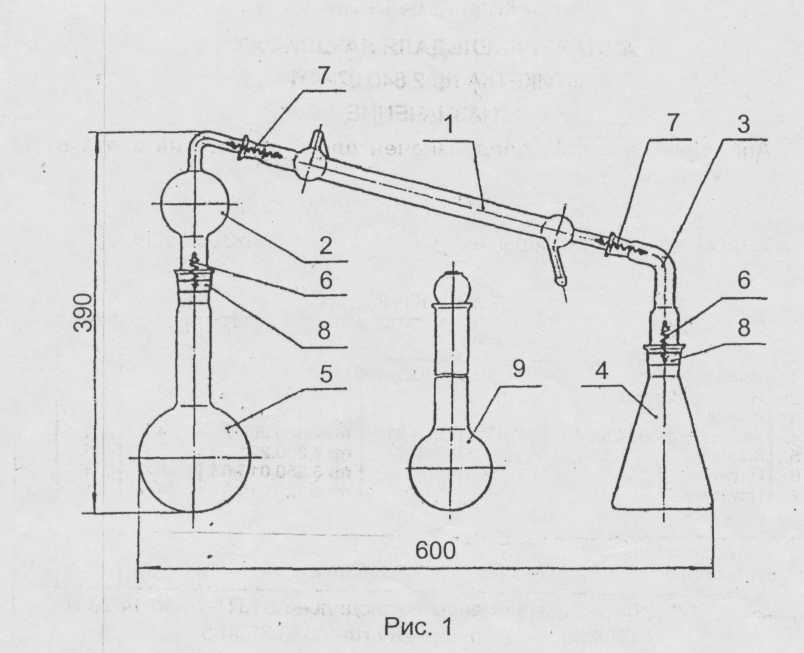
1 – холодильник, 2 – насадка Кьельдаля, 3 – алонж, 4 – колба коничекская,
5—колба, 6 – пружина (І=30мм), 7 – пружина (І=40мм), 8 – хомутик, 9 – колба Кьельдаля.
КОНТРОЛЬНІ ЗАПИТАННЯ
1)Які хімічні реакції лежать в основі визначення вмісту загального азоту в грунті?
2)Опишіть послідовність операцій по визначенню вмісту загального азоту в грунті.
3)Як перерахувати вміст загального азоту на абсолютно сухий грунт?
4)Яку роль відіграє азот в грунті?
