
- •Оглавление
- •Глава 1 Химическая термодинамика. 5
- •Глава 2 Первое начало термодинамики 8
- •Глава 3 Второе начало термодинамики. 15
- •Предисловие
- •Глава 1 Химическая термодинамика. Предмет и основные понятия термодинамики
- •Основные понятия термодинамики
- •Виды процессов
- •Глава 2 Первое начало термодинамики
- •2.1 Первое начало термодинамики как закон сохранения энергии
- •2.2 Первое начало термодинамики для химических реакций
- •2.3 Закон Гесса и следствия из него
- •2.4. Медико-биологическое значение первого начала термодинамики
- •1 Начало термодинамики
- •В химических реакциях
- •Практическое использование
- •Глава 3 Второе начало термодинамики.
- •3.1. Самопроизвольные процессы
- •3.2. Энтропия
- •3.3. Критерии самопроизвольных процессов в различных системах
- •3.4. Энергия Гиббса (изобарно-изотермический потенциал)
- •3.5. Принцип энергетического сопряжения
- •2 Начало термодинамики
- •Тестовые задания для самоконтроля
- •Расчетные задачи
- •Ключ к тесту
- •Термодинамические константы веществ
- •Литература
3.2. Энтропия
Энтропия (от греч en – «в» и tropia – «превращение», т.е. превращение в системе) обозначается символом S, Дж/моль∙К
Энтропия – термодинамическая функция, характеризующая неупорядоченность расположения частиц в системе в результате их теплового движения, это мера беспорядка в системе.
Энтропия является характеристикой макросистем, состоящих из большого числа микрочастиц. Её физический смысл был раскрыт Людвигом Больцманом в 70-е годы Х1Х века.
Н апример,
пусть в замкнутом сосуде помещены 4
молекулы двухатомного газа при
постоянных условиях. Молекулы будут
принимать в пространстве различные
положения, двигаться в разные стороны
с различной скоростью.
апример,
пусть в замкнутом сосуде помещены 4
молекулы двухатомного газа при
постоянных условиях. Молекулы будут
принимать в пространстве различные
положения, двигаться в разные стороны
с различной скоростью.
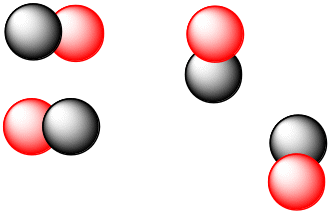
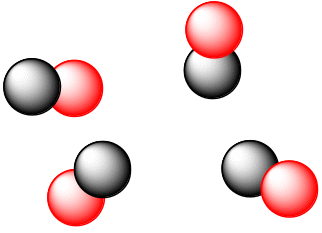
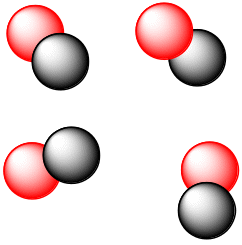
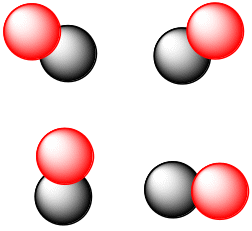
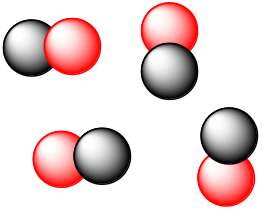
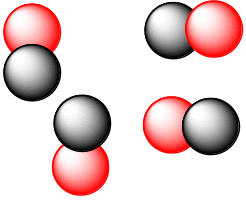
Приведённые рисунки отражают некоторые возможные варианты расположения молекул в сосуде. При этом макросостояние системы будет оставаться неизменным и характеризоваться разными микросостояниями, где молекулы отличаются пространственным расположением, скоростью передвижения и т.д. Совокупность этих микросостояний стали называть «неупорядоченностью» или «беспорядком» в системе и характеризовать величиной энтропии.
Число таких микросостояний Больцман назвал термодинамической вероятностью (W). Поскольку вероятность – достаточно большая величина, поэтому более удобно выражать ее через натуральный логарифм, отнесенный к 1 частице вещества (атом, молекула).
 S
= k•lnW
(7)
S
= k•lnW
(7)
k – постоянная Больцмана
Следовательно, энтропия – функция состояния системы, характеризующая неупорядоченность расположения её частей. Чем больше неупорядоченность, тем значение энтропии выше. Эта формула была приведена вместо эпитафии на памятнике Больцману ввиду её огромной значимости для науки.
Факторы, влияющие на значение энтропии вещества
1. Агрегатное состояние. Самое низкое значение энтропии характерно для твердого состояния, в котором порядок расположения частиц наибольший. При переходе из твердого состояния в жидкое значительно увеличивается неупорядоченность и соответственно энтропия вещества. Наибольшее значение энтропии достигается в газообразном состоянии
Н2О (лёд) Н2О (ж) Н2О (пар)
S°298 Дж/моль∙К 39 70 189
Также растет энтропия при переходе вещества из кристаллического в аморфное состояние. Например, S°298 алмаза 2,34 Дж/моль∙К, а S°298 графита 5,7 Дж/моль∙К.
2.Увеличение числа атомов в молекуле и усложнение молекулы приводит к увеличению энтропии. Например, S°298 (О) = 161, S°298(О2) = 205,
S°298(О3) = 238,8 Дж/моль∙К.
3. С увеличением температуры хаотичность движения частиц, а следовательно, и энтропия системы, возрастает.
4. Как правило, при повышении давления энтропия газов уменьшается.
5. Энтропия возрастает в реакциях, в ходе которых образуются газообразные и жидкие вещества из твёрдых, увеличивается число молекул. Если же в ходе реакции образуется сложное вещество, содержащее большее число атомов, то это приводит к упорядочению системы и, следовательно, к уменьшению энтропии. Поэтому можно оценить знак изменения энтропии в реакции, не прибегая к расчётам, как например, в реакции получения кислорода при разложении KClO3
 2KClO3
(ТВ)
2KCl
(ТВ)
+ 3O2
(Г) ΔS
> 0
2KClO3
(ТВ)
2KCl
(ТВ)
+ 3O2
(Г) ΔS
> 0
Чтобы значения энтропии веществ были сопоставимы, их относят к стандартным условиям: Т = 298К (25°С), Р = 101325 Па и v(в-ва) = 1 моль. Энтропия вещества в этих условиях обозначается S°298 и называется абсолютной или стандартной энтропией. Обратите внимание, что в обозначении стандартной энтропии отсутствует знак Δ, в отличие от стандартной энтальпии образования вещества (ΔН°298). Объясняется это тем, что для изменения энтальпии вещества не существует точки начала её отсчета и приходится пользоваться только лишь изменениями энтальпии. Для энтропии такая точка начала отсчёта существует – это точка абсолютного нуля.
Энтропия идеального кристалла при температуре абсолютного нуля
(0 К) равна нулю. (1911, Макс Планк).
Приведённая формулировка является третьим началом термодинамики
Чтобы рассчитать изменение энтропии в химической реакции, можно воспользоваться следствием из закона Гесса, поскольку энтропия, как и энтальпия, является функцией состояния системы и не зависит от пути процесса.
Δ S°р-ии
= Σ i∙S°продуктов
– Σ i∙S°исх.
в-ва
(8)
S°р-ии
= Σ i∙S°продуктов
– Σ i∙S°исх.
в-ва
(8)
Пример 4 Рассчитать изменение энтропии реакции образования озона из кислорода
Решение Напишем уравнение реакции. Выпишем из таблицы под формулами веществ значения их стандартных энтропий.
3О2 (Г) 2О3 (Г)
S°298, Дж/моль∙K: 205 238,8
Подставим S°298 в уравнение (8) и рассчитаем энтропию реакции.
ΔS°р-ии = 2∙S°(O3) – 3∙S° (O2)
ΔS°р-ии = 2∙238,8 – 3∙205 = 477,6 – 615 = -137,4 Дж /К
