
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
Лабораторная работа № 2.
ВОДОПОДГОТОВКА.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ РАСТВОРЕННОГО ЖЕЛЕЗА В ВОДЕ.
Цель работы: определить содержание железа в сточной или природной воде фотоколориметрическим методом.
Общие сведения.
Железо (Ferrum) – принадлежит к 8 группе химических элементов периодической системы Д.И. Менделеева, атомная масса 55,847, атомный номер 26, плотность 7,874 г/см3, серебристо – белый блестящий пластичный металл, температура плавления 1535 oС. Железо достаточно распространено в земле (4 место) находится на 2 месте после алюминия; процентное содержание 4,65 %.
Главными источниками попадания соединений железа в поверхностные воды являются процессы химического выветривания горных пород, сопровождающиеся их механическим разрушением и растворением. В процессе взаимодействия с содержащимися в природных водах минеральными и органическими веществами образуется сложный комплекс соединений железа, находящихся в воде в растворенном, коллоидном и взвешенном состоянии. Значительные количества железа поступают с подземным стоком и со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности и с сельскохозяйственными стоками. В питьевой воде железо может содержаться также из-за плохого состояния водопроводов и применения коагулянтов на основе солей железа.
Содержание железа в поверхностных водах суши составляет десятые доли миллиграмма, вблизи болот – единицы миллиграммов. Наибольшие концентрации железа (до нескольких десятков и сотен миллиграммов в 1 дм3) наблюдается в подземных водах с низкими значениями pH. Являясь биологически активным элементом, железо в определенной степени влияет на интенсивность развития фитопланктона и качественный состав микрофлоры в водоеме. Концентрация железа подвержена сезонным колебаниям. Обычно в водоемах с высокой биологической продуктивностью в период летней и зимней стагнации заметно увеличение концентрации ионов железа в придонных слоях воды. Предельно допустимая концентрация общего железа в воде водоемов 0.5 мг/л.
Содержание железа в воде выше 1-2 мг Fe3+ в 1 дм3 значительно ухудшает органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования в технических целях. По органолептическим показателям воды содержание железа в питьевой воде не должно превышать 0.3 мг/л (а по нормам ЕС даже 0.2 мг/л). Лишь в отдельных случаях при использовании подземных вод без установок по обезжелезиванию по согласованию с органами санитарно-эпидемиологической службы содержание железа в воде, поступающей в водопроводную сеть, допускается до 1 мг/л.
В поверхностных пресных водах железо содержится в очень не больших количествах, и, как правило, в трехвалентной форме. Повышенное содержание железа наблюдается в болотистых водах, до нескольких миллиграммов на литр, в таких водах повышенное содержание гумусовых веществ, которые соединены с трехвалентным железом. При высоких значениях pH железо в воде находится в коллоидной форме оксида железа Fe(OH)3. В подземных водах с низкими значениями pH и при минимальном содержании растворенного кислорода железо присутствует в растворенной двухвалентной форме. Трехвалентное железо при определенных условиях также может присутствовать в воде в растворенном виде как в форме неорганических солей (например, сульфатов), так и в составе растворимых органических комплексов.
При содержании в воде железа в концентрациях выше 0.3 мг/л вода после непродолжительного контакта с воздухом окисляется кислородом и становится желтовато – бурого цвета. Такая вода вызывает появление ржавых подтеков на сантехнике, отложения в котельном и бойлерном оборудовании. При концентрациях выше 1 мг/л вода мутная окрашивается в желто-бурый цвет при не длительном контакте с воздухом. Такая вода не допустима для использования, как в питьевых, так и в технических целях.
Железо человек получает в основном с пищей, из воды – максимально 10%. Также возможно попадание железа из воздуха, при этом вероятно возникновение профессиональных заболеваний. ВОЗ не дает рекомендуемой величины потребления железа по показаниям здоровья. В больших количествах железо, как и любое другое химическое вещество, способно вызвать в организме человека нарушения и даже патологии.
Виды железа, содержащегося в воде.
Как правило, в воде встречается несколько видов железа (таблица 1).
Двухвалентное железо (Fe+2) – в этой форме железо находится в растворенном состоянии. Иногда при определенных значениях pH гидроксид железа Fe(OH)2, выпадает в осадок.
Трехвалентное железо (Fe+3) - Хлорид (FeCl3) и сульфат (Fe2(SO4)3) – в растворимой форме, гидроксид железа Fe(OH)3 – в нерастворимом виде (существуют исключения при низком уровне pH).
Органическое железо – существует в различных комплексах, растворимых или в коллоидной форме. Органическое железо трудно удалить из воды. Органическое железо бывает следующих видов:
Растворимое органическое железо. Способно связывать и удерживать кальций и другие металлы. Некоторые органические молекулы связывают железо в сложные растворимые комплексы – хелаты. Пример, таких органических соединений: порфириновая группа гемоглобина крови (удерживает железо), хлорофилл (удерживает магний), гуминовая кислота.
Бактериальное железо. Существуют бактерии, использующие растворенное железо для жизни, они получают энергию, преобразуя двухвалентное железо в трехвалентное.
Коллоидное железо. Коллоиды –частицы размером менее 1 микрона, которые не растворяются в воде, но трудно фильтруются из-за малого размера. К коллоидным частицам также относятся крупные органические молекулы (танины, лигнины). Коллоидные частицы обладают высоким поверхностным зарядом, поэтому они отталкивают друг друга и не укрупняются, образуя в воде суспензии, находящиеся во взвешенном состоянии, вода становится мутной.
Таблица 1 – Виды железа, содержащиеся в воде.
Тип железа |
Вода из-под крана |
Вода после отстаивания |
Двухвалентное |
Чистая |
Красно-бурый осадок |
Трехвалентное |
Окрашена |
Красно-бурый осадок |
Коллоидное |
Желто-бурая |
Не образует осадка, Не фильтруется |
Растворенное органическое |
Желто-бурая |
|
Бактериальное |
Радужная пленка, желеобразные образования в водопроводной системе. |
|
Процесс удаления из воды железа называется обезжелезиванием. Очистка воды от железа – одна из самых сложных задач в водоподготовке. Одного универсального экономически оправданного метода очистки, который можно было бы применить во всех случаях для любой воды, не существует. Основные методы обезжелезивания:
Окисление (реагентное, каталитическое). В результате окисления загрязнения осаждаются (с помощью коагулянтов или без них), потом фильтруются с помощью специальных систем очистки воды.
Ионный обмен
Мембранные методы (осмос, обратный осмос, нанофильтрация)
Дистилляция
Поскольку железо образует устойчивые окрашенные соединения, для его определения можно использовать фотоколориметрические методы.
Фотоколориметрия. Теоретические основы метода. Закон Бугера – Ламберта - Бера
В основе оптических методов анализа лежит эффект избирательного поглощения света определенной длины волны веществом. Если вещество облучается видимым светом, этот раздел оптических методов анализа называется фотоколориметрией.
При прохождении потока излучения через частично поглощающую среду интенсивность прошедшего потока I согласно закону Бугера – Ламберта - Бера равна
![]() (1)
(1)
где I0 – интенсивность падающего потока;
ελ – молярный коэффициент поглощения при данной длине волны;
l – толщина поглощающего слоя (кюветы);
с – концентрация поглощающего вещества, моль/дм3.
Или в логарифмической форме:
![]() (2)
(2)
Величину lg(I0/I) в (2), характеризующую поглощающую способность вещества в растворе, называют оптической плотностью. В аналитической практике, стремясь подчеркнуть сущность процесса, лежащего в основе фотометрического определения, а именно поглощение квантов электромагнитного излучения оптического диапазона аналитической формой, эту величину называют поглощением, или светопоглощением и обозначают буквой А (absorption) либо D (density).
Закон Бугера – Ламберта - Бера: оптическая плотность раствора прямо пропорциональна концентрации вещества и толщине поглощающего слоя. Серию аналитических определений выполняют при постоянной толщине поглощающего слоя, тогда оптическая плотность линейно зависит от концентрации (рисунок 1).
Коэффициент линейной регрессии зависимости А = f(С) представляет собой молярный коэффициент поглощения ελ = tg a.
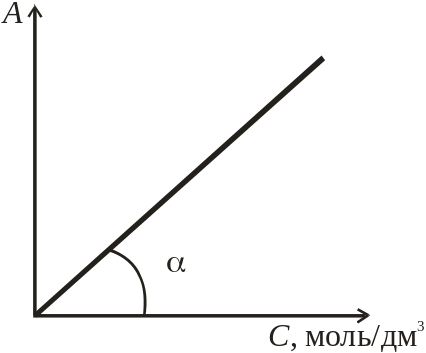
Рисунок 1. – зависимость оптической раствора плотности от концентрации.
Обратите внимание, что эта прямая линия проходит через начало координат. Для раствора поглощающего вещества при постоянных концентрациях и толщине поглощающего слоя оптическая плотность зависит от длины волны, поэтому измерения проводят при длине волны, соответствующей максимальному поглощению.
Приборами для фотоколориметрии служат фотоэлектроколориметры (ФЭК), характеризующиеся простотой оптической и электрической схем. Большинство фотометров имеет набор из 10-15 светофильтров и представляет собой прибор, в которых пучок света от источника излучения (лампа накаливания, редко ртутная лампа) проходит через светофильтр и проходит через кювету с исследуемым раствором или раствором сравнения (рисунок 2).

1 |
2 |
3 |
4 |
5 |
6 |
7 |
1 – источник света, 2 – щель, 3 – монохроматор (светофильтр), 4 – измерительная ячейка (анализируемый образец, образец сравнения), 5 – детектор, 6 – усилитель, 7 – регистрирующее устройство (графическое, визуальное, цифровое)
Рисунок 2 – Блок-схема фотоэлектроколориметра (упрощенная)
Количественное определение вещества по светопоглощению основано на применении закона Бугера - Ламберта - Бера. Концентрацию можно определить, пользуясь методом градуировочного графика А = f(C), методом сравнения или методом добавок. Погрешности определения составляют около 5%.
Для перевода вещества в окрашенную форму используются химические реакции. Обязательное требование к реакциям, используемым в количественном анализе – они должны протекать избирательно, быстро и полностью воспроизводимо. Окраска образующейся аналитической формы должна быть устойчивой во времени и к действию света, а поглощение раствора, несущее информацию о концентрации поглощающего вещества, должно подчиняться физическим законам, связывающим поглощение и концентрацию, конкретно – закону Бугера – Ламберта – Бера.
