
- •Процессы на катоде
- •Процессы на аноде
- •Законы электролиза
- •1. Извлечение металлов
- •2. Очистка металлов (электрохимическое рафинирование)
- •3. Нанесение гальванических покрытий.
- •4. Анодирование.
- •Практическая часть. Получение никелевого покрытия электрохимическим методом.
- •1. Подготовка поверхности железного катода.
- •2. Никелирование.
- •Вопросы для защиты
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
Лабораторная работа № 6.
ПОЛУЧЕНИЕ МЕТАЛЛОВ ЭЛЕКТРОЛИТИЧЕСКИМ МЕТОДОМ
Цель работы. Покрыть стальную пластинку слоем никеля.
Общие сведения
Для получения веществ и различных защитных и декоративных покрытий широко применяется электролиз растворов и расплавов. Во многих случаях это почти единственный метод выделения некоторых металлов, например алюминия, натрия, калия, ниобия, тантала из их соединений.
Электролиз позволяет:
Получить металл или неметалл в числом виде;
Выделить металл или неметалл из смеси веществ сложного химического состава.
Получить металлы в виде порошка, чешуек и т. д.
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита. Во время электролиза положительно заряженные ионы перемещаются к катоду, который соединяется с отрицательным полюсом внешнего источника постоянного тока, а отрицательно заряженные ионы перемещаются к аноду, который соединяется с положительным полюсом источника постоянного тока. На поверхности катода идет процесс восстановления, на аноде – окисление (рисунок 1).
При электролизе водных растворов электролитов полярные молекулы воды притягиваются и к катоду, и к аноду, и также могут участвовать в процессах на электродах.
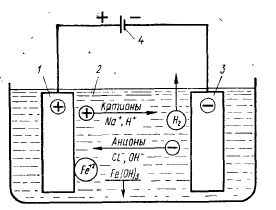
электрод-анод; 2 – электролит; 3 – электрод-катод; 4 – источник питания
Рисунок 1 – схема электролиза
Процессы на катоде
Последовательность восстановления ионов на катоде при электролизе растворов зависит от значений стандартных электродных потенциалов. Чем больше величина электродного потенциала элемента, тем легче его восстановление.
Ряд напряжений металлов:
“-” Li, Cs, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H2, Cu, Ag, Hg, Pt, Au “+”.
Потенциалы
металлов и водорода зависят от их
концентрации в электролите. Поэтому по
значениям стандартного потенциала
судить о восстановлении ионов Н+
не всегда можно. В нейтральном растворе
концентрация ионов водорода равна10-7
моль/л и по формуле Нернста: ![]()
Следовательно водород может выделяться из нейтральных растворов только при потенциале меньше –0,41В, а металлы на катоде будут выделяться лишь те, потенциал которых положительнее потенциала –0,41В.
На практике из водородных растворов выделяется немало металлов (Zn, Fe, Cr и др.), значение электродных потенциалов которых менее –0,41В. Это объясняется перенапряжением водорода, т.е. на поверхности большинства металлов водород выделяется с затруднениями. Величина перенапряжения водорода зависит от свойств металла, плотности тока и температуры электролита. Перенапряжение – это разница потенциалов между практическим потенциалом выделением водорода и теоретическим.
При обобщенном процессе на катоде, в зависимости от нахождения металла в ряду стандартных электродных потенциалов, выделяются три случая:
1) ионы металлов, электродный потенциал которых менее –1.18 В (от Li до Mn). Восстанавливаются ионы водорода.
2 Н+ + 2е- = Н2 РН < 7
2 Н2О + 2е- = Н2 + 2ОН- РН >= 7
2) ионы металлов, электродный потенциал которых от –1.18 В до 0.00 В (от Mn до Н) В этом случае восстанавливаются как ионы металлов, так и ионы водорода одновременно:
Men+ + ne- = Me0
2H+ + 2e- = H2 PH<7
2H2O + 2e- = H2 + 2OH- PH>=7
3) ионы металлов, электродный потенциал которых больше 0.00 В (от H до Au). В этом случае восстанавливаются только ионы металлов
Меn+ + ne- = Me0
Процессы на аноде
Для электролиза используют растворимые (активные) и нерастворимые (инертные) аноды. Во время электролиза растворимые аноды растворяются и ионы металла – анода переходят в раствор. Обычно растворимые аноды изготавливаются из того металла, соль которого подвергается электролизу.
Нерастворимые аноды в окислительно-восстановительных реакциях не участвуют. Обычно это аноды из графита, золота, платины. На их поверхности окисляются анионы с более отрицательными потенциалами. Это ионы не содержащие кислорода, такие как J- , Br- , Cl- , S2- и др. (исключение F-).
Кислородсодержащие кислотные остатки на аноде в водных растворах не окисляются. Вместо них окисляются молекулы воды:
2H2O - 4e- = O2 +4H+ (PH<=7)
4OH - 4e- = 2H2O + O2 (PH>7)
На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. Анионы S2–, I–, Br–, Cl– окисляются легко. Если раствор содержит анионы кислородcодержащих кислот SO42–, NO3–, CO32–, PO43–, то на аноде окисляются молекулы воды до кислорода. Если анод растворимый, то при электролизе он сам подвергается окислению, т. е. посылает электроны во внешнюю цепь. В результате смещается равновесие между электродом и раствором, и анод растворяется.
