
- •Российский государственный педагогический университет имени а.И. Герцена
- •Основы химического языка
- •Предисловие
- •Оглавление
- •Химический элемент, химическое соединение
- •Химический элемент – символы и названия.
- •Классификация химических элементов.
- •Классификация химических соединений по составу.
- •Систематические и традиционные названия простых веществ.
- •Степень окисления элементов в химических соединениях.
- •Систематические и специальные названия одноэлементных ионов.
- •Систематические и специальные названия бинарных соединений.
- •Функциональная классификация сложных неорганических соединений
- •Оксиды.
- •Гидроксиды – основные (основания), амфотерные, кислотные (оксокислоты).
- •Пероксокислоты.
- •Бескислородные кислоты.
- •Галогенангидриды.
- •Основные положения координационной теории.
- •Номенклатура комплексных соединений.
- •1. Лабораторная работа «Основные классы неорганических соединений». Оксиды
- •Гидроксиды
- •Кислоты
- •Металлокомплексные соединения
- •Количественные характеристики химических элементов и соединений.
- •16 Г ch4 занимают объем 22,4 л
- •22,4 Л ch4 содержат 6,02∙1023 молекул
- •1 Моль h2s занимает объем 22,4 л
- •32 Г o2 занимают объем 22,4 л
- •13.1. Определение простейших и молекулярных формул соединений.
- •Индивидуальное домашнее задание № 1
Основные положения координационной теории.
О сновы теории координационных соединений были заложены в 1893 г. А. Вернером2. В состав комплексного соединения входит координационный центр – центральный атом или ион, называемый комплексообразователем, и непосредственно взаимодействующие с ним (координирующиеся вокруг него) другие структурные элементы (атомы, ионы, молекулы) – лиганды3. Одно из наиболее общих определений4 гласит - «координационными называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома (акцептора электронов), окруженного лигандами (донорами электронов)”.
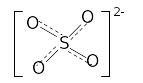
Совокупность центрального атома (иона) комплексообразователя и лигандов составляет внутреннюю координационную сферу комплекса, которая и представляет собой собственно комплексную (координационную) частицу, существующую при определенных условиях как единое целое. В зависимости от соотношения зарядов координационного центра и лигандов комплексная частица может быть как нейтральной, так и положительно или отрицательно заряженной. Компенсация избыточного отрицательного или положительного заряда комплексной частицы происходит в результате ее электростатического взаимодействия с противоположно заряженными с катионами или анионами, которые образуют внешнюю сферу комплекса. Внутреннюю сферу комплекса при записи химической формулы, как правило, отделяют от внешней квадратными скобками: K4[Fe(CN)6], [Co(NH3)5Cl]Cl2, Na2[SO4], [NH4]Cl. Следует отметить, что в формулах часто встречающихся солей, кислот квадратные скобки часто опускаются. Однако с точки зрения координационной теории в этих соединениях также можно выделить внутрисферную и внешнесферную составляющие. Например, в сульфате натрия внутреннюю сферу образуют атом серы (гипотетический ион S6+) и непосредственно координированные к нему четыре эквивалентных атома кислорода (оксидных O2—иона), каждый из которых образует по одной -связи с серой и участвует в образовании двух делокализованных по всей внутренней сфере -связей. Суммарный отрицательный заряд комплекса [SO4]2- компенсируется двумя катионами Na+, связанными с комплексным сульфат-ионом преимущественно ионной связью.
 Принципиальным
отличием внутрисферных лигандов и
внешнесферных частиц комплекса
является с одной стороны отсутствие
непосредственного взаимодействия
внешнесферных частиц с координационным
центром, а с другой – различный
характер химической связи:
преимущественно ионный
между внешнесферными частицами
и комплексной частицей и ионно-ковалентный
(донорно-акцепторный)
характер взаимодействия между
лигандами и координационным центром
во внутренней сфере комплекса.
Это приводит к различной эффективности
процессов электролитической диссоциации
комплексных соединений в водных
растворах. Диссоциация комплексных
соединений на внутреннюю и внешнюю
сферу, называемая первичной
диссоциацией,
протекает практически нацело по
типу сильных электролитов, а вторичная
диссоциация – образование
в объеме раствора гидратированных
компонентов внутренней сферы
комплекса по типу слабых электролитов:
Принципиальным
отличием внутрисферных лигандов и
внешнесферных частиц комплекса
является с одной стороны отсутствие
непосредственного взаимодействия
внешнесферных частиц с координационным
центром, а с другой – различный
характер химической связи:
преимущественно ионный
между внешнесферными частицами
и комплексной частицей и ионно-ковалентный
(донорно-акцепторный)
характер взаимодействия между
лигандами и координационным центром
во внутренней сфере комплекса.
Это приводит к различной эффективности
процессов электролитической диссоциации
комплексных соединений в водных
растворах. Диссоциация комплексных
соединений на внутреннюю и внешнюю
сферу, называемая первичной
диссоциацией,
протекает практически нацело по
типу сильных электролитов, а вторичная
диссоциация – образование
в объеме раствора гидратированных
компонентов внутренней сферы
комплекса по типу слабых электролитов:
K4[Fe(CN)6] [Fe(CN)6]4- + 4K+
[Fe(CN)6]4- Fe2+ + 6CN-
Это служит одним из экспериментальных приемов установления состава внутренней и внешней сферы комплексных соединений. Например, при проведении реакции взаимодействия комплекса [Co(NH3)5Cl]Cl2 с нитратом серебра в результате обменной реакции: [Co(NH3)5Cl]Cl2 + 2AgNO3 = 2AgCl + [Co(NH3)5Cl]NO3 осаждается только два хлоридных иона, что указывает на присутствие третьего иона хлора в составе внутренней сферы комплекса.
 Количественный
состав внутренней сферы комплекса
определяется величиной координационного
числа
центрального атома (иона) – числом
координированных лигандов.
Так, в K[Ag(CN)2],
Na2[CO3],
[NH4]Cl,
Ni(CO)4,
PF5,
[Co(H2O)6]Cl3
- координационные числа Ag+,
C4+,
N3-,
Ni,
P5+,
Co3+
составляют: 2, 3, 4, 5 и 6. Количество
связей, которые образует один лиганд с
комплексообразователем, называется
дентатностью
лиганда.
Каждый из лигандов в рассмотренных выше
комплексах занимает одно координационное
место. Такие лиганды называются
монодентатными.
В тоже время, один лиганд может занимать
несколько координационных мест
во внутренней сфере комплекса в
результате образования нескольких
донорно-акцепторных связей с
координационным центром. Например,
в отличие от молекулы аммиака, способной
образовывать только одну
донорно-акцепторную связь с
участием неподеленной пары азота,
этилендиамин NH2-CH2-CH2-NH2
(En)
характеризуется наличием двух донорных
атомов азота и может образовывать
две связи с центральным ионом
комплексообразователем:
Количественный
состав внутренней сферы комплекса
определяется величиной координационного
числа
центрального атома (иона) – числом
координированных лигандов.
Так, в K[Ag(CN)2],
Na2[CO3],
[NH4]Cl,
Ni(CO)4,
PF5,
[Co(H2O)6]Cl3
- координационные числа Ag+,
C4+,
N3-,
Ni,
P5+,
Co3+
составляют: 2, 3, 4, 5 и 6. Количество
связей, которые образует один лиганд с
комплексообразователем, называется
дентатностью
лиганда.
Каждый из лигандов в рассмотренных выше
комплексах занимает одно координационное
место. Такие лиганды называются
монодентатными.
В тоже время, один лиганд может занимать
несколько координационных мест
во внутренней сфере комплекса в
результате образования нескольких
донорно-акцепторных связей с
координационным центром. Например,
в отличие от молекулы аммиака, способной
образовывать только одну
донорно-акцепторную связь с
участием неподеленной пары азота,
этилендиамин NH2-CH2-CH2-NH2
(En)
характеризуется наличием двух донорных
атомов азота и может образовывать
две связи с центральным ионом
комплексообразователем:

В результате этого каждая молекула этилендиамина занимает два координационных места во внутренней сфере комплекса. Такие лиганды, занимающие в координационной сфере центрального атома (иона) несколько координационных мест, называются полидентатными (би-, три-, тетра-, пента-, гексадентатными) лигандами. Наряду с органическими диаминами, бидентатными лигандами могут выступать и другие соединения с двумя донорными атомами:

В настоящее время известны комплексы с разнообразными полидентатными лигандами, некоторые из которых представлены в табл. I-7. Полидентатные лиганды, строение которых приводит к образованию циклов при их комплексообразовании, называются хелатными5 лигандами, а соответствующие комплексы на их основе хелатными комплексами.
Таблица 9. Полидентатные хелатные лиганды.
|
Дентатность |
Графическая формула |
(DMG) |
2 |
|
Триаминопропан |
3 |
|
Триаминотриэтиламин |
4 |
|
Этилендиаминтетраацетат-ион (ЭДТА) |
6 |
|

Полидентатные лиганды своими разными донорными атомами часто образуют с координационным металлическим центром два типа связей – донорно-акцепторные и ковалентные. Это характерно, в частности, для аминокислот и других органических соединений, содержащих одновременно атом азота и гидроксидную группу. В этом случае бидентатный лиганд образует с центральным атомом одну ковалентную связь за счет неспаренного электрона атома кислорода, остающегося после отщепления атома водорода от гидроксидной группы, а другую донорно-акцепторную связь за счет неподеленной электронной пары атома азота. Примером такого взаимодействия может служить комплекс никеля (II) c двумя молекулами диметилглиоксима, в каждой из которых происходит отщепление атома водорода только от одной гидроксидной группы. Такого рода комплексные соединения называются внутрикомплексными. Они обладают высокой устойчивостью и часто характерной яркой окраской – например, NiDMG имеет ярко-красную окраску, что определяет широкое использование внутрикомплексных соединений в аналитической практике для определения многих металлов.

 Комплексные
соединения, содержа-щие только один
координационный центр, называются
моноядерными,
а несколько – полиядерными
комплексами.
Наряду с полиядерными комплексами,
объединение металлических
центров в которых обеспечивается
мостиковыми лигандами, существует
большой круг полиядерных комплексов,
характеризующихся
образованием прочных химических
связей непосредственно между
металлическими центрами. Такие
комплексные соединения называются
кластерными
комплексами.
Комплексные
соединения, содержа-щие только один
координационный центр, называются
моноядерными,
а несколько – полиядерными
комплексами.
Наряду с полиядерными комплексами,
объединение металлических
центров в которых обеспечивается
мостиковыми лигандами, существует
большой круг полиядерных комплексов,
характеризующихся
образованием прочных химических
связей непосредственно между
металлическими центрами. Такие
комплексные соединения называются
кластерными
комплексами.
В зависимости от заряда комплексы подразделяются на катионные ([Co(NH3)6]3+, [Сu(H2O)4]2+), нейтральные (Ni(CO)4, [Pt(NH3)2Cl2]), анионные ([FeCl6]3-, [Hg(CN)4]2-) и катионно-анионные ([Cr(NH3)6][Cr(CN)6], [CuEn2][Ag(CN)2]2), тогда как по природе лигандов – на смешанно-лигандные комплексы ([Cu(NH3)(H2O)Cl(NO2]) и комплексы с однородным лигандным окружением центрального атома.
Среди наиболее часто встречающихся в химической практике комплексов с однородным лигандным окружением можно выделить:
-аммиачные и аминные, содержащие во внутренней сфере молекулы аммиака и органических аминов: [Cu(NH3)4](NO3)2, [Ni(En)2]Br2;
-аква-, гидроксо- и оксокомплексы, в качестве лигандов у которых выступают молекулы воды и продукты их кислотной диссоциации – гидроксидные ОН- и оксидные О2--ионы:
[Zn(H2O)4]2+ [Zn(OH)4]2- + 4H+
[Zn(OH)4]2- [ZnO2]2- + 2H2O;
-ацидокомплексы, содержащие во внутренней сфере разнообразные кислотные остатки: [NiCl4]2-, [HgBr4]2-, [TiF6]2-, [Co(NO2)6]3-, [Pd(CN)4]2-, [Fe(NCS)6]2-.
Изомерия в комплексных соединениях. Сложное многокомпонентное строение комплексных соединений приводит к существованию различных изомерных соединений с одинаковой простейшей эмпирической формулой, но разным строением и свойствами. Среди характерных для комплексов типов изомерии можно отметить:
координационную изомерию - различное распределение лигандов между двумя комплексообразователями в катионно-анионных комплексах:
[Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6];
координационную полимерию – комплексные соединения одного эмпирического состава, но разной молекулярной массы:
[Pt(NH3)4][PtCl4] и [Pt(NH3)4][Pt(NH3)Cl3]2;
ионизационную изомерию (ионизационную метамерию) – комплексы с различным распределением лигандов между внутренней и внешней сферой:
[Co(NH3)5SO4]Cl и [Co(NH3)5Cl]SO4;
гидратную изомерию, которая является частным случаем ионизационной изомерии и связана с различным распределением молекул воды между внутренней и внешней сферой: [Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2H2O, [Cr(H2O)4Cl2]Cl2H2O, [Cr(H2O)3Cl3]3H2O;
связевую изомерию – координация амбидентатных лигандов к координационному центру различными донорными атомами:
Na2[Pt(NO2)6] и Na2[Pt(NO2)5(ONO)];
изомерию лигандов (конформационную изомерию) – наличие в составе комплексов изомеров многоатомных лигандов. Например, органический диамин общей формулы C3H6(NH2)2 может существовать в виде 1,2-диаминопропана (pn) и 1,3-диаминопропана (tn). Это приводит к образованию на их основе изомерных комплексов:
[Cu(pn)2]Cl2 и [Cu(tn)2]Cl2;
геометрическую изомерию – различное пространственное расположение лигандов во внутренней сфере комплексов. Наиболее часто встречающимся типом этой изомерии является цис-транс изомерия в комплексах с октаэдрическим и плоскоквадратным строением:

оптическую изомерию – существование комплексов в двух зеркально-симметричных пространственных формах, называемых энантиомерами, которые обладают различной оптической активностью – вращают плоскость поляризации света в противоположных направлениях:

У пражнения:
Определите координационный центр, его заряд и координационное число, а также лиганды и их заряд в следующих соединениях: SF6, SO2Cl2, [SO4]2-, [CrO4]2-, [ZnO2]2-, [Mn(H2O)6]2+, [NiCl4]2- Ni(CO)4, [Ni(CN)4]2-, [Co(NH3)6]3+, [Al(OH)6]3-.
Чем отличается характер химической связи во внутренней и внешней сфере координационного соединения? Определите внутреннюю и внешнюю сферу и их заряды в следующих соединениях: Na2SO4, K2Cr2O7, Ba2[Fe(CN)6], Rb[B(OH)4], H3PO4, [UO2]Cl2, [Co(NH3)5Cl]Cl2, NH4NO3, [Cr(H2O)6][Cr(CN)6].
Что такое дентатность лиганда? Определите дентатность лигандов в следующих комплексных соединениях кобальта (III): Na[Co(NH3)4(CO3)2], [Co(NH3)4CO3]ClO4, Na[CoEn2(CO3)2], Na[Co(ЭДТА)], Na[Co(ЭДТА)Сl2].
Какие комплексы называются: моноядерными, полиядерными, хелатными, внутрикомплексными? Приведите примеры.
*
 Какой из гетероциклических дииминов
– 2,2’-бипиридил (2,2’-bpy)
или 4,4’-бипиридил (4,4’-bpy)
может выступать в качестве
мостикового лиганда и в
качестве хелатирующего
лиганда?
Какой из гетероциклических дииминов
– 2,2’-бипиридил (2,2’-bpy)
или 4,4’-бипиридил (4,4’-bpy)
может выступать в качестве
мостикового лиганда и в
качестве хелатирующего
лиганда?К какому типу комплексов (моно- или полиядерных; катионных, анионных, нейтральных или катионно-анионных; смешанно-лигандных или аква-, гидроксо-, оксо-, ацидокомплексов, аммиакатов, аминатов) относятся следующие соединения: NaPF6, SO3, Na2S2O7, H2CrO4, UO2(NO3)2, K4[Fe(CN)6], (K2[ZnO2], Ba[Al(OH)4]2, NH4Cl, [Mn(H2O)6]SO4, [Cr(H2O)3Cl3], Li2[NiCl4], Ni(CO)4, Na2[Ni(CN)4], [Co(NH3)4CO3]2(SO4), [Pt(NH3)4][PdCl4].
Приведите по 2 примера различных типов изомерных комплексов: геометрических, связевых, гидратных, ионизационных, координационных.

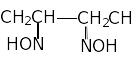 Название
Название Диметилглиоксим
Диметилглиоксим