
- •Практикум по общей химической технологии
- •1.1. Теоретические сведения
- •1.2. Методика проведения работы
- •1.2.1. Определение карбонатной жёсткости воды
- •1.2.2. Определение общей и некарбонатной жёсткости воды трилоном б
- •1.4. Умягчение воды ионообменным методом
- •1.5. Порядок оформления работы
- •Вопросы для допуска к работе
- •Рекомендуемая литература
- •Работа №2. Дегидратация этилового спирта
- •2.1. Теоретические сведения
- •2.2. Описание установки и методика проведения работы
- •2.3. Методика проведения эксперимента
- •Работа № 3. Полукоксование твёрдого топлива
- •3.1. Теоретические сведения
- •3.1.1. Влияние температуры
- •3.1.2. Влияние фракционного состава исходного топлива
- •3.1.3. Влияние состава исходного сырья
- •3.2. Методика выполнения работы
- •3.2.1.Определение влажности топлива
- •3.2.2. Определение зольности топлива
- •3.3. Запись результатов
- •Рекомендуемая литература
- •Работа № 4. Обжиг серного колчедана
- •4.1 Теоретические сведения
- •4.2. Методическая часть
- •4.2.1. Описание установки
- •4.2.2. Подготовка установки к работе
- •4.2.3. Ход выполнения работы
- •4.3. Обработка экспериментальных данных
- •4.3.1. Форма записи результатов работы
- •4.3.2 Проведение расчётов
- •4.3.3. Компьютерная обработка данных
- •4.3.4. Определение стадии, лимитирующей скорость процесса
- •5.1.2. Проточный реактор идеального смешения
- •5.3. Обработка результатов эксперимента
- •5.3.1. Форма записи экспериментальных данных
- •5.3.2. Расчёт работы реактора
- •6.1.2. Выполнение работы
- •6.2. Обработка результатов эксперимента
- •6.2.1. Форма записи экспериментальных результатов
- •6.2.2. Расчёт работы реактора
- •Рекомендуемая литература к работе 5 и 6
- •Содержание
-
Министерство образования Российской Федерации
Тверской государственный технический университет
Кафедра технологии полимерных материалов
Практикум по общей химической технологии
По курсу «Общая химическая технология»
Тверь 2004
УДК 66.01 (075.8)
ББК 35
Практикум предназначен для выполнения лабораторных работ по курсу общей химической технологии и основам промышленной экологии и включает теоретические предпосылки, описание установок, методики проведения работ. Приводятся методы расчётов по результатам выполненной работы и обработки экспериментальных данных.
Практикум предназначен для студентов специальностей: 2505 - Химическая технология высокомолекулярных соединений, 70100 - Биотехнология, 1705 - Машины и аппараты химических производств.
Рассмотрен и рекомендован к изданию на заседании кафедры технологии полимерных материалов (протокол №4 от 20 апреля 2004г.).
Рецензент: профессор-консультант ГУП ВНИИСВ доктор технических наук В.Б. Кваша.
Составители: А.М.Комаров, Е.И.Лагусева
РАБОТА №1. ПРОМЫШЛЕННАЯ ВОДОПОДГОТОВКА
Цель работы: ознакомление с методами подготовки и сравнение эффективности известково-содового и ионообменного методов умягчения воды.
1.1. Теоретические сведения
Умягчением воды называют процесс, приводящий к понижению её жёсткости. Общая жесткость воды определяется наличием в её составе растворимых солей кальция и магния (карбонаты, бикарбонаты, сульфаты, хлориды и др.). Различают карбонатную (временную) и некарбонатную (постоянную) жёсткость воды. Первая обусловлена присутствием в воде бикарбонатов кальция и (или) магния и может быть полностью устранена кипячением:
Ca(HCO3)2 = CaCO3 + CO2 + H2O , (1.1)
Mg(HCO3)2 = MgCO3Mg(OH)2 + 3CO2 + H2O , (1.2)
MgCO3 + H2O = Mg(OH)2 + CO2 . (1.3)
Некарбонатная или постоянная жёсткость связана с присутствием в воде кальциевых и магниевых солей сильных кислот (хлоридов, сульфатов, нитратов).
Общая жесткость – сумма временной и постоянной жесткостей. Жёсткость выражается в миллиграмм-эквивалентах растворимых солей кальция и магния в литре воды. По общей жёсткости воду различают мягкую (менее 2), среднюю (от 2 до 10), жёсткую (более 10 мг-экв/дм3). Для хозяйственно-питьевого водоснабжения допускается жёсткость воды не более 7 мг-экв/дм3 (ГОСТ 2974-74).
Для технических целей требования к воде определяются спецификой технологического процесса.
Для использования воды в производстве, её подвергают соответствующей подготовке, зависящей от наличия в ней примесей и требований производства. Вода, содержащая соли кальция и магния, не может быть использована для питания паровых котлов из-за образования плотных слоёв накипи. Она не пригодна также и для охлаждения.
Активная реакция воды - степень её кислотности или щелочности - характеризуется концентрацией водородных ионов и определяется при помощи индикаторов. Реакция природных вод близка к нейтральной (рН=6,8-7,3). Реакция оборотных вод зависит от характера производства (рН6,5 - кислая, рН7,3 - щелочная).
Для умягчения воды применяют термические, реагентные, ионообменные и комбинированные методы.
Термические методы основаны на нагревании воды, её дистилляции или вымораживании.
Реагентные методы основаны на связывании растворимых в воде ионов Ca2+ и Mg2+ в труднорастворимые соединения с помощью различных реагентов, таких как гашёная известь, кальцинированная сода, трёхзамещённый фосфат натрия и др.
Наибольшее распространение получил известково-содовый метод, сущность которого заключается в образовании нерастворимых соединений при обработке воды гашёной известью:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O , (1.4)
Mg(HCO3)2 + 2Ca(OH)2 = Mg(OH)2 + 2CaCO3 + 2H2O , (1.5)
MgSO4 + Ca(OH)2 = Mg(OH)2 + CaSO4. (1.6)
или кальцинированной содой:
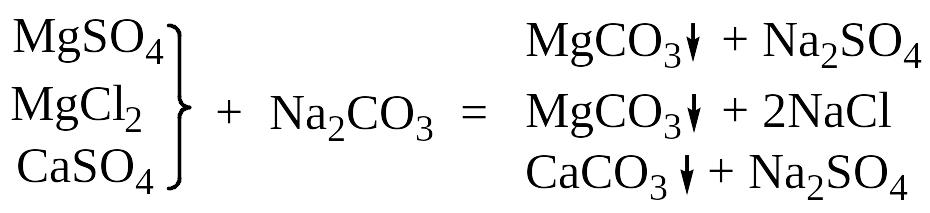
(1.7)
(1.8)
(1.9)
Полного устранения жёсткости этим методом добиться невозможно из-за некоторой растворимости CaCO3 и MgСО3. Более глубокое умягчение воды достигается при применении фосфатного метода или метода ионного обмена:
3Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4)2 + 6NaHCO3 , (1.10)
MgCl2 + 2Na3PO4 = Mg3(PO4)2 + 6NaCl , (1.11)
Сущность метода ионного обмена состоит в том, что твёрдое тело –ионит поглощает из раствора электролита положительные или отрицательные ионы в обмен на эквивалентное количество других одноимённо заряженных ионов. В соответствии со знаком заряда обменивающихся ионов различают катиониты и аниониты.
В основе катионного процесса умягчения лежат реакции обмена ионов натрия или водорода на ионы Ca2+ и Mg2+. Обмен ионов натрия называется Na-катионированием, а ионов водорода H-катионированием:
2![]() R/Na+
+ Mg2+
R2/Mg2+
+ 2Na+
, (1.12)
R/Na+
+ Mg2+
R2/Mg2+
+ 2Na+
, (1.12)
2![]() R/H+
+ Ca2+
R2/Ca2+
+ 2H+ , (1.13)
R/H+
+ Ca2+
R2/Ca2+
+ 2H+ , (1.13)
2 R/H+ + Mg2+ R2/Mg2+ + 2H+ , (1.14)
R /H+ + Na+ R/Na+ + H+ . (1.15)
Регенерацию Na-катионитов после достижения предела обменной ёмкости осуществляют путём промывки раствором NaCl, а Н-катионитов - растворами минеральных кислот (H2SO4 , HCl):
R /Mg2+ + nNa + 2R/Na + + Mg 2+ + (n-2) Na + (1.16)
R /Mg2+ + nH + 2R/H+ + Mg 2++ (n-2) H + (1.17)
При фильтровании воды через слой анионита происходит сорбция анионов:
R /OH + Cl R/Cl + OH , (1.18)
2
R/OH
+ SO![]() R2/SO
+ 2OH
. (1.19)
R2/SO
+ 2OH
. (1.19)
Регенерация анионитовых фильтров осуществляется обычно 4%-ным раствором NaOH:
R /Cl + nOH R/OH + Cl + (n-1) ОН (1.20)
R /SO + nOH 2 R/OH + SO + (n-2) ОН (1.21)
Ионообменный метод позволяет получить в зависимости от удельного расхода ионита любую заданную остаточную жёсткость.
