
Уровни структурной организации белковой молекулы
Белки имеют сложную пространственную структуру. Исследователи выделили 4 уровня организации.
Первичная структура – понятие, обозначающее последовательность аминокислотных остатков в белке. Например,



 S
S
S
S
Глу-Глун-Цис-Цис-Ала-Сер-Вал-Цис-Сер-Лей
(фрагмент одной из цепей молекулы инсулина)
Пептидная связь – основной вид связи, определяющий первичную структуру, она является ковалентной связью. Возможно и присутствие дисульфидных связей между двумя остатками цистеина в одной полипетидной цепи с образованием цистина.
Последовательность аминокислот в белке уникальна и детерминируется генами. Даже небольшие изменения первичной структуры могут серьезно изменять свойства белка. Первичная структура белков обеспечивает формирование последующих уровней структурной организации и определяет видовую специфичность белка.
Расшифрована первичная структура ряда ферментов: рибонуклеазы (129 аминокислот), карбоксипептидазы (309 аминокислот), некоторых гормонов. В последние годы внимание исследователей привлекают пептиды, состоящие из небольшого числа аминокислот и обладающие высокой биологической активностью. Гормон окситоцин (9 аминокислот) стимулирует сокращение гладкой мускулатуры (матки, молочной железы, кишечника). Гормон вазопрессин (9) – антидиуретический гормон, повышает кровяное давление, увеличивает реабсорбцию воды в почках. Недостаток его приводит к развитию несахарного диабета, при котором выделяется больше 10 л мочи в сутки, сильно разбавленной. Гормон инсулин контролирует содержание глюкозы в крови.
Определенный интерес представляет группа пептидов – энкефалины, которые вырабатываются в клетках ЦНС в ответ на болевые раздражения и ослабляют чувство боли. Так же обнаружены пептиды целенаправленного действия сна, жажды и т.д.
Вторичная структура – упорядоченная и компактная упаковка полипептидной цепи в пространстве. Она бывает в виде спирали и складчатой структуры. Образование вторичной структуры обеспечивается водородной связью, нековалентной. α-спиральную конфигурацию поддерживают, в основном, водородные связи внутри полипептидной цепи, β-структура полипептидной цепи имеет зигзагообразную структуру, полипептидные цепи уложены параллельно друг другу в виде складчатого слоя. В β-конфигурации отсутствуют внутрицепочечные водородные связи, а имеются межцепочечные водородные связи между пептидными группами соседних полипептидных цепей. Вторичная структура способствует компактизации полипептидной цепи, укладывая ее в α-спираль или β-структуру, тем самым определяя такие свойства как прочность, нерастворимость.
Вторичная структура детерминирована размером, формой и полярностью боковых радикалов аминокислот полипептидных цепей. Вторичная структура характерна для альбуминов, глобулинов, кератина волос, коллагена сухожилий.
Третичная структура – расположена в пространстве всей полипетидной цепи, содержащей α-спирали, β-структуры. Большая часть белков на уровне этой структуры принимает глобулярную форму. Основу составляют ионные связи, электростатические, в некоторых белках – ковалентные дисульфидные связи, которые стабилизируют третичную структуру. Третичная структура обеспечивает выполнение белком его основных функций. Глобулярные белки – альбумины и глобулины, обнаружены в крови и многих органах, фибриллярные – основа мышечных тканей. Характер третичной организации устанавливают с помощью рентгеноструктурного анализа.
Третичную структуру принято называть «нативной конформацией», т.е. нативные свойства белков (естественное состояние) определяются третичной структурой. При разрыве связей, стабилизирующих третичную структуру, белок теряет частично или в полной мере биологические и функциональные свойства.
Четвертичная структура – возникает в результате объединения нескольких субъединиц с третичной структурой в одну большую молекулу. Связь между субъединицами нековалентная, хотя в ряде белков субъединицы соединены ковалентными дисульфидными мостиками. Четвертичная структура обеспечивает кооперативный эффект, например молекула гемоглобина состоит из 4 субъединиц (степень α-спирализации составляет 80%, т.е. наибольшую), каждая из которых способна присоединять молекулу кислорода. При этом связывание кислорода одной субъединицей изменяет конформацию других субъединиц таким образом, что присоединение кислорода к ним облегчается – это совместный (кооперативный) эффект.
Фермент ЛДГ – 4 субъединицы: 2Н и 2М. их разные комбинации позволяют создать 5 ферментов, катализирующих одинаковую реакцию в разных органах и тканях: НННН, НННМ, ННММ, НМММ, ММММ. Такие белки называются – изопротеины или изоферменты. Изоферменты имеют различную локализацию в тканях. Это имеет важное значение для диагностики различных заболеваний.
Высшие уровни структуры молекулы белка обусловлены в основном особенностями первичной структуры, но в значительной мере зависят также и от условий среды, в которой находится белок (рН, tº).
ТИПЫ СВЯЗЕЙ МЕЖДУ АМИНОКИСЛОТАМИ В МОЛЕКУЛЕ БЕЛКА
2 группы:
1. КОВАЛЕНТНЫЕ СВЯЗИ - обычные прочные химические связи.
а) пептидная связь
б) дисульфидная связь
2. НЕКОВАЛЕНТНЫЕ (СЛАБЫЕ) ТИПЫ СВЯЗЕЙ - физико-химические взаимодействия родственных структур. В десятки раз слабее обычной химической связи. Очень чувствительны к физико-химическим условиям среды. Они неспецифичны, то есть соединяются друг с другом не строго определенные химические группировки, а самые разнообразные химические группы, но отвечающие определенным требованиям.
а) Водородная связь
б) Ионная связь
в) Гидрофобное взаимодействие
Аминокислоты могут объединяться в длинные цепи, образуя между собой пептидные связи. Две аминокислоты при этом образуют дипептид и т.д. Пептиды содержащие до 10 аминокислот называют олигопептидами, а до 50 – полипептидами, а если больше, чем 50 аминокислот, то уже – белками.
Пептидные связи образуются при взаимодействии α-аминогруппы одной аминокислоты с α-карбоксильной группой другой аминокислоты.
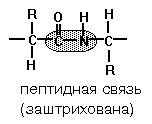
Пептидная связь – амидная ковалентная связь, соединяющая аминокислотные остатки в цепочку.
Сама пептидная связь является частично двойной в силу лактим-лактамной таутомерии. Поэтому вокруг нее невозможно вращение, а сама она по прочности в полтора раза превосходит обычную ковалентную связь.
Пептидная связь довольно прочная, её можно разорвать, например, путем нагревания раствора белка в присутствии кислоты или щелочи, которые активируют гидролиз этой связи.
Гидролиз пептидной связи в клетках ускоряется при помощи специальных ферментов.
Белок как биологически значимая структура может представлять собой как один полипептид, так и несколько полипептидов, образующих в результате нековалентных взаимодействий единый комплекс. К ковалентным связям в молекуле белка помимо пептидной, относится также ДИСУЛЬФИДНАЯ СВЯЗЬ. Цистеин - аминокислота, которая в радикале имеет SH-группу, за счет которой и образуются дисульфидные связи.
