

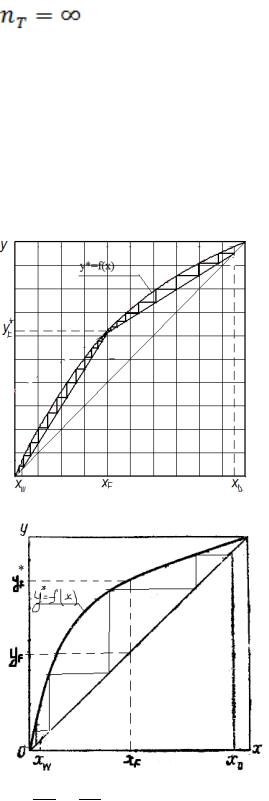
абсорбента l при этом будет бесконечно большим (так как Хк = Хн).
P
Если же линия рабочих концентраций ВА3 касается линии равновесия, то удельный расход абсорбента минимален (l = lmin), а движущая сила в точке касания равна нулю, поскольку в этой точке рабочая концентрация равна равновесной.
В первом случае размеры абсорбционного аппарата будут наименьшими при бесконечно большом расходе абсорбента, во втором – расход абсорбента наименьший при бесконечно больших размерах аппарата. Таким образом, оба случая являются предельными и практически неосуществимы.
В реальном абсорбционном аппарате равновесие между фазами не достигается и всегда
PXk < Xk*, где PXk* – концентрация поглощаемого газа в жидкости, находящейся в равновесии с
поступающим газом. Отсюда следует, что значение l всегда должно быть больше минимального значения lmin отвечающего предельному положению рабочей линии (линия BA3 на рисунке 3).
удельный расход абсорбента (в кмоль/кмоль инертного газа): 1l = |
L |
= |
Yn − Yk (9) |
|
G |
|
Xk − Xn |
Значение lmin можно определить по уравнению (9) при замене PXk на PXk*:
L |
|
= |
Yn − Yk |
(11) |
||
Plmin = (G ) |
|
X |
X |
|
||
|
min |
|
k* − |
|
n |
|
Необходимо отметить, что увеличение удельного расхода l абсорбента
одновременно со снижением высоты аппарата приводит к определенному увеличению его диаметра. Это объясняется тем, что с увеличением l возрастает также расход поглотителя L, а при этом, как показано ниже, снижаются допустимые скорости газа в аппарате, по которым находят его диаметр. Вот почему в тех
случаях, когда удельный расход абсорбента не задан технологическими условиями, т. е. когда не задана конечная концентрация Хк абсорбента, следует выбирать такое соотношение между

размерами абсорбционного аппарата и удельным расходом l абсорбента, при котором величина l и размеры аппарата будут оптимальными.
Оптимальный удельный расход поглотителя Plmin может быть найден только с помощью технико-экономического расчета.
Количество тепла, выделяющегося при абсорбции для данного сечения аппарата, может быть найдено как
P |
. |
Температура абсорбента повышается на величину |
|
P |
, |
где q – дифференциальная теплота растворения газа; с – теплоемкость раствора. Тогда изменение температуры абсорбента по длине (высоте) абсорбера может быть вычислено по формуле
P
11.В каком случае эффективность разделения смесей выше: при простой перегонке или при перегонке с дефлегмацией? Ответ проиллюстрируйте на диаграмме фазового равновесия.
Простая перегонка дает возможность только частично разделить смесь летучих веществ и на практике простая перегонка используется только в лабораторных условиях. Для более полного разделения применяют перегонку с дефлегмацией. Суть ее состоит в том, что выходящий из куба пар предварительно частично конденсируется в специальном теплообменнике – дефлегматоре 5 и полученный при этом конденсат (флегма) возвращается в куб , а оставшаяся часть несконденсированного пара поступает в холодильник , где конденсируется, образуя дистиллят.
При частичной конденсации пара оставшаяся часть пара обогащается водой, концентрация спирта (Y`) в оставшейся части пара больше, чем его концентрация в исходном паре (Y). Например, при концентрации спирта в исходном паре Y= 42 % мас. при частичной конденсации пара образуется L = 0,5 кг флегмы с концентрацией около 17 % мас. и D = 0,5 дистиллята с концентрацией около 67 % мас., в то время как при простой перегонке концентрация спирта в дистилляте будет 42 % мас.
Таким образом, перегонка с дефлегмацией обеспечивает более глубокое разделение летучих смесей по сравнению с простой перегонкой, но все равно не позволяет получать чистые компоненты.
При перегонке с дефлегмацией отношение количества флегмы L (при температуре кипения) к количеству дистиллята D именуется флегмовым числом (или числом флегмы) R = L/D. Чем больше R, тем выше концентрация спирта в дистилляте, но при этом будет больше и расход энергии на перегонку. Флегмовое число выбирают по технико-экономическим соображениям в пределах 0<R<¥. При R=0, происходит простая перегонка – возврата флегмы нет, при R=¥ вся флегма конденсируется в дефлегматоре и возвращается в перегонный куб – разделение отсутствует.
Считается, что флегмовое число не должно быть менее 3.
Перегонка с дефлегмацией используется в коньячном производстве при получении коньячных и плодовых спиртов с концентрацией 65-75 % об. из виноматериалов с содержанием спирта 9-11% об.

К простой перегонке относится дистилляция.
Дистилляцией называют перегонку смеси с полной конденсацией полученных паров. Дистилляция может проводиться в установках непрерывного и периодического действия. Простую перегонку можно проводить при атмосферном давлении или под вакуумом (для снижения температуры перегонки).
Для получения нужных фракций (или разгонного состава дистиллята) применяют фракционную, или дробную, перегонку (рис. 3.8, а).
Исходную смесь загружают в куб 1, имеющий змеевик для нагревания и кипячения этой смеси. Образующиеся пары конденсируются в теплообменнике – конденсаторе 2, дистиллят в нем же охлаждается до заданной температуры и поступает в один из сборников 3. После окончания процесса перегонки остаток сливают из куба 1 и вновь загружают в него исходную смесь.
Рис. 3.8. Схема установок для простой перегоноки (а) и перегонки с дефлегмацией (б): 1 – кубы – кипятильники; 2 – конденсаторы – холодильники; 3 – сборники; 4 – дефлегматор
При простой перегонке образующийся пар отводится из аппарата и в каждый данный момент времени находится в равновесии с оставшейся жидкостью (что принимается при анализе этого процесса). Для составления материального баланса простой перегонки полагаем, что количество жидкости в некоторый момент времени равно L, а ее состав x (по НК) и Py*(в паре над жидкостью). Тогда состав пара над жидкостью можно выразить как функцию состава жидкости Py* = f (x). За бесконечно малый промежуток времени количество жидкости и состав ее изменяются и составляют соответственно PL − dL и Px − d x . Количество образующегося за этот промежуток времени пара равно уменьшению количества жидкости dL, а его состав Py* является равновесным с P . Содержание НК в жидкости к началу
рассматриваемого промежутка времени составляет Lx, а к концу – P |
. |
Количество НК, перешедшего в пар за это время – PdLy*. Таким образом, уравнение |
|
материального баланса по НК за это время |
|
P |
. (3.6) |

Величиной dLdx как бесконечно малой величиной второго порядка можно пренебречь. Тогда уравнение (3.6) после соответствующих преобразований принимает следующий вид:
P |
|
Проинтегрировав это уравнение в пределах от P до P |
и от L = F (т.е. начальное |
количество разделяемой смеси) до L = W (конечное количество этой смеси), получим
P |
|
(3.7) |
В уравнении (3.7) функция P |
выражается кривой равновесия, которая является |
|
специфической для каждой системы жидкости – пар. Поэтому уравнение (3.7) обычно |
||
решают графически – построением зависимости P |
. С помощью |
|
диаграммы y – x для ряда значений x в интервале от P до P |
находят равные величины |
|
P и с учетом масштаба диаграммы (рис. 3.9) определяют значение интеграла в уравнении
(3.7).
Количество получаемого дистиллята P = F – W. Количество получаемого кубового остатка W
определяют из уравнения (3.7) и рис. 3.9, зная массу исходной смеси F, ее состав xF и
заданный состав кубового остатка xW.
Рис. 3.9. К определению количества кубового остатка при простой перегонке

Средний состав получаемого дистиллята xср определяют из уравнения материального баланса по НК:
P |
, |
откуда |
|
P |
|
При расчете простой перегонки обычно определяют количество и средний состав дистиллята, состав кубового остатка. Степень разделения компонентов в условиях простой перегонки может быть повышена применением дефлегмации (см. рис. 3.8, б).
В этом случае пары из куба 1 поступают в дефлегматор 4, где они частично конденсируются. При этом конденсируются преимущественно ВК, а пары обогащаются НК. Полученный в дефлегматоре конденсат, или флегма, возвращается в перегонный аппарат (куб) и подвергается многократному испарению.
На рис. 3.10 представлена схема двухступенчатой дистилляционной установки непрерывного действия [1].
Бинарная взаимно растворимая смесь поступает в подогреватель 1 с параметрами, соответствующими точке А, и подогревается до состояния кипения, соответствующего точке В. В дистилляционном аппарате 2 получаются пары смеси, соответствующие точке С. Далее
пары с концентрацией x2 поступают в конденсатор 3. Конденсация паров бинарной смеси
протекает при  , но с понижением ее температуры от t1 до t2. После этого дистиллят поступает во вторую ступень дистилляционной установки, аппарат 4; во второй
, но с понижением ее температуры от t1 до t2. После этого дистиллят поступает во вторую ступень дистилляционной установки, аппарат 4; во второй
ступени получаются пары с более высокой концентрацией (P > P ). Из аппарата второй ступени пары поступают в дефлегматор 5.

Рис. 3.10. Схема двухступенчатой дистилляционной установки с дефлегмацией и сепарацией паров во второй ступени и ее процесс на t, x-диаграмме
В дефлегматоре происходит частичная конденсация паров (линия ЕF), и получается влажный пар, соответствующий точке F. Влажный пар является смесью сухого пара с концентрацией, соответствующей точке L, и жидкости с концентрацией, соответствующей точке K. Затем влажный пар поступает в сепаратор 6, в сепараторе от пара отделяется жидкость. Жидкость с
концентрацией x4 < x3 поступает в дистилляционный бак 8, а пары с концентрацией x5 > x3 направляются в конденсатор 7, где превращаются в дистиллят M, и из него поступают в бак готового продукта 9.
В случае, когда дистилляция происходит в установке периодического действия, содержание летучего компонента в дистилляционном кубе 2 (рис. 3.10) постепенно уменьшается, причем дальнейшая перегонка как в кипящей жидкости, так и в получаемых из нее парах идет при переменной увеличивающейся температуре. Содержание низкокипящего компонента в жидкости в начале кипения и в последующие моменты времени определяется на кривой
кипения точками P |
и т.д.; соответственно содержание этого компонента в парах |
определяется точками P |
и т.д. на линии конденсации. |
Содержание летучего компонента в парах, все время уменьшаясь, становится равным его первоначальному содержанию в кипящей жидкости, а затем становится еще меньше (точка
P), с этого момента дальнейшая перегонка смеси становится нецелесообразной.
12. Опишите влияние величины флегмового числа на основные размеры колонн и на энергозатраты при ректификации смесей.
Флегмовое число R может изменяться в широких пределах: 
а) 
В этом случае при 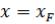 ,
, 
Движущая сила процесса:  -
-  =0, поэтому для разделения смеси здесь потребуется бесконечно высокая колонна, но min-ый диаметр, т.к. плотность орошения в колонне минимальная. Дистиллята будет отбираться max-ое количество, но четкость разделения смеси-наихудшая. Расходы теплоносителей (греющего пара в кипятильнике) и охлаждающей воды в дефлегматореминимальны.
=0, поэтому для разделения смеси здесь потребуется бесконечно высокая колонна, но min-ый диаметр, т.к. плотность орошения в колонне минимальная. Дистиллята будет отбираться max-ое количество, но четкость разделения смеси-наихудшая. Расходы теплоносителей (греющего пара в кипятильнике) и охлаждающей воды в дефлегматореминимальны.
Строим рабочую диаграмму “состав-состав”:
б) R= ∞
R = GR = GR = ∞
GD 0
В этом случае дистиллят не отбирается, т.е. производительность колонны min-на. Колонна работает в режиме самообслуживания (сама на себя). Движущая сила процесса:

yF = y* − yF = yFmax,т.е. она максимальна (при x=xF). В этом случае число тарелок, а
F
значит и высота колонны min-на. Диаметр колонны максимален, как и расходы теплоносителей. Четкость разделения смесинаилучшая. Таким образом, четкость разделения смеси, диаметр колонны и расходы теплоносителей (пары кипятильников и воды в дефлегматоре) пропорциальны флегмовому числу R. А высота колонны и производительность действующей колонны от R зависят обратно.
Поскольку проведение ректификации связанно с испарением жидкости и соответствующими затратами тепла, на основании изложенного можно сформулировать одно из важнейших правил ректификации: с уменьшением флегмового числа и, следовательно, затрат тепла на проведение процесса уменьшается движущая сила, и наоборот.
Оптимальное (рабочее) флегмовое число можно найти, исходя из минимального объема колонны.
Количество пара, проходящего через ректификационную колонну, равно VP= GP(R+1)/ (3600pG), где VP- объемная скорость пара в колонне, м3/с; pG- плотность смеси ,кг/м3; GP- количество дистиллята, кг/ч
Сечение колонны при заданной скорости пара и GPявляется величиной, пропорциональной (R+1), а высота аппарата пропорциональна числу единиц переноса. Следовательно, произведение mx(R+1)пропорционально рабочему объему аппарата.
13.Охарактеризуйте основные промышленные адсорбенты, указав преимущественные области их применения.
В качестве адсорбентов применяются пористые твердые вещества с большой удельной поверхностью, обычно относимой к единице массы вещества. Адсорбенты имеют различные по диаметру капиллярные каналы— поры, которые условно могут быть разделены на
макропоры (более 2×10-4 мм), переходные поры (6×10-6-2×10-4 мм), микропоры (2×10-6-6×10-6 мм). Характер процесса адсорбции определяется размером пор.
Удельная поверхность макропор относительно очень мала, поэтому на их стенках адсорбируется ничтожное .количество вещества. Макропоры играют роль лишь транспортных каналов для адсорбируемых молекул.
На поверхности переходных пор, размеры которых обычно значительно превышают размеры адсорбируемых молекул, в процессе адсорбции образуются слои поглощенного вещества. Возможно образование слоев толщиной в одну молекулу (мономолекулярная адсорбция) и в несколько молекул (полимолекулярная адсорбция).
Размеры микропор приближаются к размерам адсорбируемых молекул и адсорбция в микропорах приводит к заполнению их объема. Вследствие этого предположение об образовании слоев поглощенного вещества на поверхности микропор не имеет физического смысла. Обычно микропоры пересекаются макро- и переходными порами, что сокращает путь, проходимый адсорбируемыми молекулами, и приводит к ускорению адсорбции.
Вбольших порах диаметром более 2·10-4 мм и малых порах, сравнимых с диаметром молекул поглощаемого вещества, явление капиллярной конденсации отсутствует.
Адсорбенты характеризуются своей поглотительной, или адсорбционной, способностью, определяемой концентрацией адсорбтива в единице массы или объема адсорбента. Поглотительная способность адсорбента по отношению к данному веществу зависит от температуры и давления, при которых производится адсорбция, и от концентрации поглощаемого вещества. Максимально возможная при данных условиях поглотительная способность адсорбента условно называется его равновесной активностью.
Впромышленности в качестве поглотителей применяют главным образом активные угли и минеральные адсорбенты (силикагель, цеолиты и др.) а также синтетические ионообменные смолы (иониты).
Активные угли. Высокопористые активные угли получают путем сухой перегонки различных углеродсодержащих веществ (дерева, костей и др.) и активирования полученных углей для повышения их пористости. Активирование осуществляют прокаливанием угля при температурах ≤ 900 °С, а также другими способами, например удалением из пор угля смол и некоторых других продуктов сухой перегонки путем их экстрагирования органическими растворителями, окислением кислородом воздуха и др. Для повышения активности углей в них часто перед обугливанием вводят активирующие добавки (растворы хлористого цинка, кислот, щелочей и др.).
Удельная поверхность активных углей колеблется от 600 до 1700 м2/г. Размер гранул некоторых стандартных марок активных углей для адсорбции газов и паров составляет 1-5 мм (уголь БАУ) и 1.5-2.7 мм (уголь СКТ). Насыпная плотность углей этих марок равна 260 и 420 г/л соответственно. Применение углей того или иного вида зависит от разновидности процесса адсорбции, в котором они используются (поглощение газов, рекуперацияx( летучих
растворителей и т.д.).
Рекуперация-восстановление вещества, израсходованного в каком-нибудь технологическом процессе.
Активные угли лучше поглощают пары органических веществ, чем воды, однако с повышением содержания влаги в активных углях их способность поглощать пары органических веществ снижается. Они применяются обычно для рекуперации летучих растворителей. Недостатком активных углей является их горючесть.
Силикагели. Эти адсорбенты представляют собой продукты обезвоживания геля кремневой кислоты, получаемые путем обработки раствора силиката натрия (растворимого стекла) минеральными кислотами или кислыми растворами их солей. Удельная поверхность
силикагелей изменяется от 400 до 770 м2/г. Размер гранул колеблется от 0,2 до 7 мм, насыпная плотность составляет 400-800 г/л.
Силикагели применяются главным образом для осушки газов. Поглотительная способность силикагелей по отношению к парам органических веществ сильно снижается в присутствии влаги. Достоинством силикагелей является их негорючесть и большая механическая прочность, чем у активных углей.
Цеолиты. Эти адсорбенты представляют собой природные или синтетические минералы, которые являются водными алюмосиликатами катионов элементов первой и второй групп периодической системы Д.И. Менделеева. В качестве промышленных адсорбентов применяются главным образом искусственные (синтетические) цеолиты. Относительно недавно были получены цеолиты, обладающие весьма однородной структурой пор, размеры которых соизмеримы с размерами адсорбируемых молекул. Эти цеолиты проявляют молекулярно-ситовое действие, которое заключается в их способности не поглощать молекулы, диаметр которых больше диаметра пор. Молекулярно-ситовыми свойствами обладают также некоторые природные цеолиты, например натролит. Молекулярно-ситовое действие цеолитов часто используют в промышленной практике для разделения некоторых веществ, например нормальных и изопарафиновых углеводородов.
Цеолиты отличаются высокой поглотительной способностью по отношению к воде и являются высокоэффективными адсорбентами для осушки и очистки газов и жидкостей, в частности для глубокой осушки газов, содержащих небольшие количества влаги. Размер гранул цеолитов составляет от 2 до 5 мм.
Иониты. Эти адсорбенты представляют собой как природные, так и синтетические неорганические и органические вещества. К природным ионитам относятся цеолиты, глинистые минералы, ископаемые угли и др. Синтетическими ионитами являются плавленые цеолиты и молекулярные сита (цеолиты с правильной кристаллической структурой), ионообменные смолы, активированные минералы и органические вещества и др.
Иониты практически нерастворимы в воде, а также в обычных растворителях и обладают подвижными ионами, способными обмениваться на эквивалентное количество ионов (с зарядом того же знака) из раствора электролита, с которым поглотитель контактирует. Иониты, содержащие кислые активные группы и обменивающиеся с раствором электролита подвижными анионами, называются анионитами, а иониты, содержащие основные активные группы и обменивающиеся подвижными катионами, — катионитами. Существуют также амфотерные иониты, способные к катионному и анионному обмену одновременно. Типичные реакции ионного обмена:
1. Реакция анионного обмена
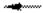
 2RC1 + Na2SO4 R2SО4 + 2NaCl
2RC1 + Na2SO4 R2SО4 + 2NaCl
где R — молекула ионита, связанная с подвижным ионом. 2. Реакция катионного обмена
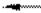
 2NaR + СаСl2 CaR2 + 2NaCl
2NaR + СаСl2 CaR2 + 2NaCl
причем в обоих уравнениях выделены формулы веществ, составляющих твердую фазу. Механизм ионного обмена обусловлен структурой и свойствами ионита. Так, например, иониты с кристаллической решеткой содержат в ее углах ионы, удерживаемые электростатическими силами; под действием этих сил и происходит в основном ионный обмен. Свойства многих ионитов связаны с их способностью к набуханию в водных растворах; набухание обычно сопровождается весьма значительным повышением давления. Ионообменные смолы обладают большой обменной емкостью, избирательностью к отдельным ионам, химической стойкостью и механической прочностью. Поэтому сейчас они
