
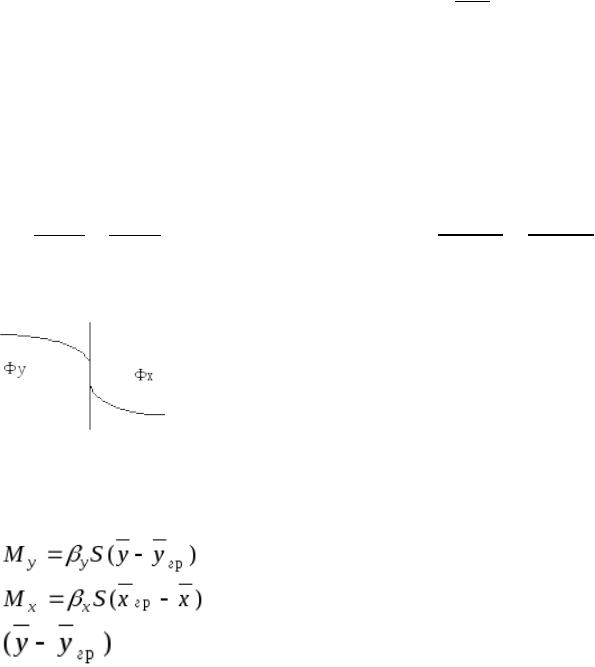
P x = x − x*, которая будет иметь другую численную величину. Основное уравнение массопередачи в данном случае: PM = KxF xcp,
PKx - коэффициент массопередачи, отнесенный ко 2 фазе. Он имеет другое численное значение, но тот же физический смысл. Следовательно, можно записать (поскольку слева
одно и тоже значение М): PKyF ycp = KxF xcp , отсюда PKx = Ky |
ycp . |
|
xcp |
Чаще всего в массообменных аппаратах поверхность соприкасающихся фаз практически неопределима (например: жидкость с газовыми пузырями). Поэтому основное уравнение массопередачи (ОУМП) применяют в виде
PM = KvyV ycp , PM = KxvV xcp , где V-рабочий объём аппарата; PKvy , PKvx- объёмные коэффициенты массопередачи.
Объёмные коэффициенты массопередачи – представляют собой количество вещества переданного из одной фазы в другую в единице рабочего объёма аппарата в единицу времени при движущей силе=1.
Из основного уравнения массопередачи определяется поверхность массопередачи
PF = |
M |
= Kx |
M |
или объём рабочей зоны аппарата (V = K |
M |
= K |
M |
Ky ycp |
xcp |
y |
x . |
||||
|
|
|
|
|
vy cp |
|
vx cp |
Массоотдача- процесс переноса распределяемого компонента внутри одной фазы от ядра потока к поверхности раздела или наоборот.
P
Если обозначить через Фy (газовую фазу), через Фхжидкую фазу, то распределяемый компонент в фазе Фy будет перемещаться из ядра потока к поверхности раздела фаз и определяющее количество (М) вещества, переносимого в единицу времени в каждой из фаз:
в фазе Фy;
в фазе Фx.
и  -движущая сила процесса массоотдачи соответственно в
-движущая сила процесса массоотдачи соответственно в
фазах Фy и Фх.
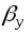 и
и 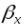 -коэффициенты массоотдачи. Они показывают какое количество вещества переходит от поверхности раздела фаз в ядро фазы (или в обратном направлении) через единицу поверхности в единицу времени при движущей силе равной единице. Коэффициент массоотдачи (β) является не физической константой, а кинетическим коэффициентом зависящим от: плотности, вязкости, скорости, длины и диаметра аппарата. Таким образом величина (β) является функцией многих переменных, что осложняет расчет и опытное определение коэффициентов массоотдачи.
-коэффициенты массоотдачи. Они показывают какое количество вещества переходит от поверхности раздела фаз в ядро фазы (или в обратном направлении) через единицу поверхности в единицу времени при движущей силе равной единице. Коэффициент массоотдачи (β) является не физической константой, а кинетическим коэффициентом зависящим от: плотности, вязкости, скорости, длины и диаметра аппарата. Таким образом величина (β) является функцией многих переменных, что осложняет расчет и опытное определение коэффициентов массоотдачи.

Взаимосвязь коэффициентов массопередачи 1Ky и 1Kx с коэффициентами массоотдачи 1βx и 1βy устанавливается уравнениями:
P1 |
= |
1 + m |
|
|
Ky |
|
βy |
βx |
|
P1 |
= |
1 |
+ |
1 |
Kx |
|
mβy |
|
βx |
где m – коэффициент распределения вещества по фазам.
2.Что называют «обратным перемешиванием» и как оно влияет на эффективность массообменного процесса в системе «газ (пар) - жидкость»?
Посмотри еще раз https://www.belstu.by/Portals/0/userfiles/72/LK/LK-3-01.pdf
. В аппарате наблюдается перемешивание потока фазы не только поперек направления движения, но и вдоль оси его движения (так называемое обратное перемешивание). Это перемешивание обусловлено турбулентной диффузией, захватом и увлечением некоторой части одной фазы другой фазой (унос брызг жидкости газом и т.д.). В противоточных аппаратах, например, предназначенных для взаимодействия жидкости и газа, прореагировавшая жидкость за счет уноса газом забрасывается в зону с не прореагировавшей жидкостью. При смешении уменьшается (увеличивается) рабочая концентрация распределяемого компонента в жидкости при том же значении равновесной концентрации. Это вызывает снижение движущей силы как на локальном уровне, так и средней в целом по аппарату. Выравнивание концентраций в объеме фазы кроме того идет и за счет молекулярной диффузии.
В режиме идеального вытеснения движущая сила максимальна. В режиме идеального смешения концентрация мгновенно выравнивается во всем объеме аппарата, и движущая сила при этом минимальна. В реальных аппаратах имеет место промежуточный между идеальным вытеснением и смешением режим.
Обратное перемешивание фаз, уменьшая движущую силу, снижает эффективность аппаратов. Главную роль в продольном перемешивании играет унос фаз, преобладая над турбулентной и молекулярной диффузией. Для достижения заданных параметров размеры реальных аппаратов по сравнению с аппаратами идеального вытеснения должны быть увеличены.
Обратное перемешивание, уменьшаешь среднюю движущую силу, тем самым, снижает эффективность массообмена, характеризуемую количеством вещества, переходящего в единицу времени из фазы в фаза(см ур ниже). Это снижение эквивалентно уменьшению число единиц переноса в аппарате.
PM = KyF ysr
PM = KxF xsr
3. В каком случае значения коэффициентов массопередачи, выраженные через концентрации разных фаз, численно одинаковы? Ответ обоснуйте.
PKy = 1 |
1 |
PKx = 1 |
1 |
+ m |
+ 1 |
||
βy |
βx |
mβy |
βx |
P Тангенс угла наклона линии равновесия. Коэффициенты масса отдачи и массы передачи выражены в кмоль/(м2 * с).
Знаменатели этих уравнений представляет собой общее диффузионная сопротивление равное сумме диффузных сопротивлений газовой и жидкой фаз.

m 1
Когда основной диффузионный сопротивления сосредоточена в газовой фазе, то-есть Pβx βy
PKy ≈ βy |
1 |
|
1 |
Когда основной диффузионный сопротивления сосредоточена в жидкой фазе, то-есть P |
|
||
m βy |
|
βx |
|
PKx ≈ βx
4.Как определить лимитирующую стадию массообменного процесса? Укажите способы воздействия на её скорость для систем «газ (пар) - жидкость».
Лимитирующая стадия при массопередаче – стадия, которая определяет общую скорость процесса. Если коэффициент bх велик, то 1/bу>> m / bх и K y » bу, то есть лимитирующей стадией процесса является диффузионное сопротивление в фазе Ф у . Если велики значения bу и m, то 1/bх >> 1/( m bу ) и K х » bх , то есть лимитирующей стадией в данном случае является диффузионное сопротивление в фазе Ф х .
5.Что такое "диффузионное сопротивление массопереносу"? Как используется понятие лимитирующего сопротивления при экспериментальном определении коэффициентов массоотдачи?
Диффузионное сопротивление – величина, обратная коэффициенту массопередачи: R = 1/ К х,у .
1

6.Что называют "теоретической ступенью разделения" и что "единицей переноса массы"?
Вкаком случае число теоретических ступеней равно общему числу единиц переноса в массообменном аппарате (ответ обоснуйте)?
Теоретическая ступень разделения(тарелка) - это такая ступень, которая соответсвует некоторому гипотермическрму участку аппарата, на котором жидкость полностью перемешивается, а концентрация удаляющихся фаз(напр жид и газ) является равновесным Общее число единиц переноса (ЧЕП) – изменение рабочей концентрации распределяемого между фазами вещества, приходящееся на единицу движущей силы: (у н –
у к )/ у ср = n оу и (х к – х н )/ х ср = n ох .
1 хгр и угр - концентрация жидкости и пара на границе раздела фаз
1

В приделах одной тарелки число единица переноса массы достаточно точно определяется по уравнению(16). Для теоретической тарелке это число равно числу единиц переноса массы для такого же элементарного участка противоточной колонны (см. Рис. 3), У которой концентрация пара на выходе равна концентрации, равновесной с жидкостью, вытекающие из этого элемента(см. p на рис 1). Соответствующие такому участку изменений концентраций получила название ступени изменений концентраций
1
7.Что такое «кинетическая кривая»? Как её строят и как применяют для расчёта аппаратов со ступенчатым контактом фаз?
Кинетическая кривая - зависимость изменения концентрации исходного вещества или продукта (или связанного с ними свойства системы) во времени в результате протекания химического процесса.
Определение числа тарелок с помощью кинетической кривой. Упрощение по сравнению с предыдущим способом заключается в следующем: эффективности по Мэрфри рассчитываются не для каждой тарелки, а лишь для нескольких сечений колонны; аналитическое решение уравнений (12.215)-(12.220) заменяется графическим.
|
|
|
yP1* = m x1 |
|
|
(12.215) |
|
yP2 = y1 − Ey,1(y1 − y1*) |
(12.216) |
||||||
xP |
2 |
= |
G y − G y |
+ x |
(12.217) |
||
|
|
L 2 |
L n |
|
k |
|
|
|
|
|
yPl* = m xl |
|
|
(12.218) |
|
yPl+1 = yl − Ey,l(yl − yl*) |
(12.219) |
||||||
xP |
|
= |
G y |
− G y |
+ x . |
(12.220) |
|
l+1 |
|
L l+1 |
L |
n |
k |
|
|
Где PEy,l эффективности тарелки по Мэрфри (к.п.д. тарелки) , характеризующее степень достижения равновесия между уходящими с тарелки фазами
Алгоритм действий следующий:
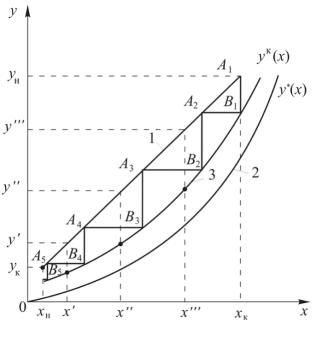
а) на ху диаграмме строятся рабочая и равновесная линии (рис. 12.10);
б) для нескольких сечений аппарата (нескольких рабочих концентраций x’, y’, x’’, y’’, x’’’,y’’'… рассчитываются эффективности тарелки по Мэрфри PE′y!, E′′y!, E′′y
в) находятся величины yP = y |
k′! k′′! k′′ |
|
|
|
|
|||
, y |
, y |
′! |
′! |
′! |
′! |
|
||
|
yP |
k′! |
(12.221) |
|||||
|
|
= y |
− Ey (y |
− y* (x )) |
||||
P
Рис. 12.10. Определение числа тарелок с помощью кинетической кривой: 1 – рабочая линия; 2 – равновесная линия; 3 – кинетическая кривая
г) на ху диаграмме наносятся точки с координатами x1′,!yk′,!x′′!,!yk′′!, x′′!′!,!yk′′... и соединяются линией, называемой кинетической кривой. Если все Ey< 1, то кинетическая кривая располагается между рабочей и равновесной линиями; если все Ey = 1, то кинетическая кривая, как следует из (12.221), совпадает с равновесной линией;
д) из точки А1 с координатами x1 = xк, y1 = yн проводится линия, параллельная оси y, до пересечения с кинетической кривой. Находится ордината точки В1(x1, y2), т.е. графическим способом решается уравнение (12.216). Из точки В1 проводится прямая, параллельная оси x, до пересечения с рабочей линией; находится абсцисса точки А2(x2, y2), т.е. графически решается уравнение (12.217); е) процедура пункта д) повторяется для точки А2, затем А3 и т.д. до тех пор, пока для
ординаты точки PBl не выполнится условие Pyl+1 ≤ yk . На этом построения заканчиваются, необходимое число тарелок в колонне N = l .
Таким образом, аналитическое решение уравнений (12.215) (12.220), составляющих алгоритм потарелочного расчета, заменяется графическим вписыванием и определением количества прямоугольных ступеней между рабочей линией и кинетической кривой в заданном интервале изменения рабочих концентраций.
8.Охарактеризуйте гидродинамические режимы работы насадочных массообменных колонн. Как определяется оптимальный диаметр таких колонн?
Насадочные колонны могут работать либо в пленочном режиме либо в режиме близком к захлебыванию -режиме повисания жидкости .Наиболее интенсивно насадочные колонны работают в режиме подвисания. Контакт газа и жидкости в насадочной колонне , во время которого происходит обмен веществом и теплом между фазами, происходит , в основном, на смоченной поверхности насадки .Поверхность контакта фаз в насадочной колонне , через которую осуществляется массопередача , называют «активной поверхностью насадки».Она
может быть как меньше так и больше геометрической поверхности насадки , и величина ее зависит от расхода газа и жидкости .При малом расходе жидкости ее может не хватить для смачивания всей поверхности насадки, поэтому расход жидкости («величина орошения»)должен обеспечивать полную смачиваемость всей поверхности насадки. При небольших расходах газа и жидкости трение между ними незначительно и количество удерживаемой жидкости не зависит от скорости газа. Контакт газа и жидкости происходит только на поверхности пленки жидкости , стекающей по насадке. Это пленочный режим. С увеличением скорости газа возрастает трение между газом и жидкостью и, вследствие этого происходит торможение жидкости: скорость стекания уменьшается , а толщина пленки увеличивается .Возрастание количества жидкости в слое насадки ведет к уменьшению сечения для прохода газа , срыву пленки жидкости и возникновению явления барботажа. Это приводит к увеличению поверхности контакта фаз , которая становится больше геометрической поверхности насадки .-Режим подвисания. Дальнейшее увеличение скорости газа приводит к возрастанию количества жидкости в насадке до того момента , когда сила трения газа о жидкость уравновесит силу тяжести жидкости , находящейся в слое насадки. Этот момент характеризуется полным затоплением насадки и называется « точкой захлебывания » .Работа промышленных насадочных колонн в точке захлебывания сопровождается значительными колебаниями гидравлического сопротивления вследствие неустойчивости течения газа и жидкости .Таким образом скорость газа в точке захлебывания является предельной скоростью и поэтому рабочая скорость газа в насадочных колоннах должна быть меньше скорости в точке захлебывания.
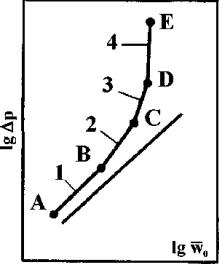
Рис.3. Гидродинамические режимы и переходные точки в насадочных колоннах при орошении насадки:
1 - пленочный режим; 2 - промежуточный режим; 3 - режим турбулизации двухфазной системы; 4 - режим эмульгирования; А - начальная точка исследования; В - точка торможения; С - точка подвисания; D - точка инверсии фаз; Е - точка захлебывания
Для определения диаметра колонны используют формулу:
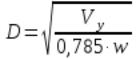 , (2.1.3)
, (2.1.3)
где  – объёмный расход пара при рабочих условиях в колонне,
– объёмный расход пара при рабочих условиях в колонне, .
.

9.Какие факторы и как влияют на равновесие между газом и жидким поглотителем при абсорбции? Опишите способы регенерации адсорбентов.
P
Абсорбцией называют процесс избирательного поглощения компонентов из газовых или парогазовых смесей жидкими поглотителями – абсорбентами.
Принцип абсорбции основывается на различной растворимости компонентов газовых и парогазовых смесей в жидкостях при одних и тех же условиях. Поэтому выбор абсорбентов осуществляют в зависимости от растворимости в них поглощаемых компонентов, которая определяется:
·физическими и химическими свойствами газовой и жидкой фаз;
·температурой и давлением осуществления процесса;
·содержанием газа в смеси.
При выборе абсорбента необходимо учитывать такие его свойства, как селективность (избирательность) по отношению к поглощаемому компоненту, токсичность, пожароопасность, стоимость, доступность и др.
Различают физическую абсорбцию и химическую абсорбцию (хемосорбцию). При физической абсорбции поглощаемый компонент образует с абсорбентом только физические связи. Процесс этот в большинстве случаев является обратимым. На этом свойстве основано выделение поглощенного компонента из раствора – десорбция. Если поглощаемый компонент вступает в реакцию с абсорбентом и образует химическое соединение, то процесс называют хемосорбцией.
Процесс абсорбции обычно является экзотермическим, т. е. сопровождается выделением теплоты.
Абсорбция широко используется в промышленности для разделения углеводородных газов на нефтеперерабатывающих установках, получения соляной и серной кислот, аммиачной воды, очистки газовых выбросов от вредных примесей, выделения ценных компонентов из газов крекинга или пиролиза метана, из газов коксовых печей и т. д.
Равновесие в процессах абсорбции определяется правилом фаз Гиббса, представляющим обобщение условий гетерогенного равновесия:
C = К - Ф + 2.
Поскольку процесс абсорбции осуществляется в двухфазной (газ – жидкость) и трехкомпонентной (один распределяемый и два распределяющих компонента) системе, число степеней свободы – три.
Таким образом, равновесие в системе газ (пар) – жидкость может характеризоваться тремя параметрами, например температурой, давлением и составом одной из фаз.
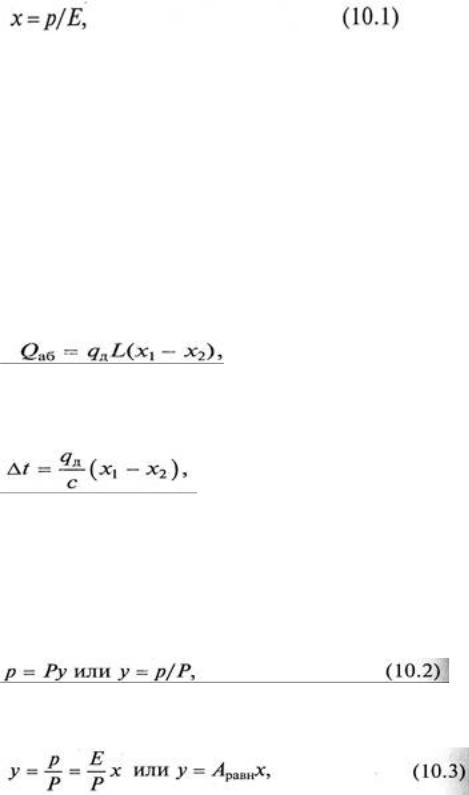
Равновесие в системе газ – жидкость определяется законом растворимости Генри, согласно которому при данной температуре мольная доля газа в растворе (растворимость) пропорциональна парциальному давлению газа над раствором:
где р – парциальное давление газа над раствором; х – мольная концентрация газа в растворе; Е – коэффициент пропорциональности (коэффициент Генри).
Закон Генри распространяется в первую очередь на слаборастворимые газы, а также на растворы с низкими концентрациями хорошо растворимых газов при отсутствии химической реакции.
Коэффициент Е имеет размерность давления, совпадающую с размерностью р, и зависит от природы растворяющегося вещества и температуры. Установлено, что с увеличением температуры растворимость газа в жидкости уменьшается. Когда в равновесии с жидкостью находится смесь газов, закону Генри может следовать каждый из компонентов смеси в отдельности.
Поскольку тепловой эффект, сопровождающий процесс абсорбции, отрицательно сказывается на положении линии равновесия, он должен обязательно учитываться при расчетах. Количество теплоты, выделяющейся при абсорбции, может быть определено по зависимости
где qд - дифференциальная теплота растворения в пределах изменения концентрации х1 – х2; L – количество абсорбента.
Если абсорбция ведется без отвода теплоты, то можно допустить, что вся выделяющаяся теплота идет на нагревание жидкости, и температура последней повышается на величину
где с – теплоемкость раствора.
Для понижения температуры исходную газовую смесь и абсорбент охлаждают, отводя теплоту, выделяющуюся в процессе абсорбции, с помощью встроенных (внутренних) или наружных теплообменников.
Парциальное давление растворяемого газа в газовой фазе, соответствующее равновесию, может быть определено по закону Дальтона, согласно которому парциальное давление компонента в газовой смеси равно общему давлению, умноженному на мольную долю этого компонента в смеси, т. е.
где Р – общее давление газовой смеси; у – мольная концентрация распределяемого в смеси газа.
Сопоставляя уравнения (10.2) и (10.1), найдем
где Аравн = Е/Р – константа фазового равновесия, применимая для областей действия законов Генри и Дальтона.
Пусть Раб – давление паров чистого абсорбента в условиях абсорбции; раб – парциальное давление паров абсорбента в растворе; Р – общее давление; х – мольная доля абсорбируемого
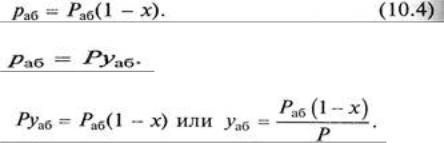
газа в растворе; у – мольная доля распределяемого газа в газовой фазе; уаб – мольная доля абсорбента в газовой фазе.
Согласно закону Рауля парциальное давление компонента в растворе равно давлению пара чистого компонента, умноженному на его мольную долю в растворе:
По закону Дальтона (10.2) парциальное давление абсорбента в газовой фазе равно
При равновесии
Анализ факторов, влияющих на равновесие в системах газ (пар) – жидкость, позволил установить, что к параметрам, улучшающим условия абсорбции, относятся повышенное давление и пониженная температура, а к факторам, способствующим десорбции, - пониженное давление, повышенная температура и введение в абсорбент добавок, уменьшающих растворимость газов в жидкостях.
Способы регенрации-14 вопрос
10.Проанализируйте влияние расхода абсорбента на размеры аппарата и на энергозатраты при реализации процесса.
Между удельным расходом абсорбента и размерами аппарата существует определенная связь. Через точку В с координатами Хн и Yк (рисунок 3) проведем, рабочие линии ВА, ВА1, ВА2, ВА3, отвечающие различным концентрациям абсорбента или разным удельным его расходам. При этом точки А, А1, А2, А3 будут лежать на одной горизонтальной прямой в соответствии
сзаданной начальной концентрацией Yн газа в смеси.
Вслучае растворов небольшой концентрации для любого значения Х и выбранной величины l движущая сила процесса выражается разность ординат Y– Y*, изображенных вертикальными отрезками, соединяющими соответствующие точки рабочей линии и линии равновесия Y* = f (X). Для всего аппарата можно принять среднее значение ∆Yср, величина которого, например для рабочей линии BA1 изображена на рисунке отрезком ∆Yср1. Величина ∆Yср будет тем больше, чем круче наклон рабочих линий и, следовательно, чем больше удельный расход абсорбента. Если рабочая линия ВА совпадает с вертикалью, то движущая сила процесса имеет максимальное значение, однако удельный расход
