
колды экз
.pdf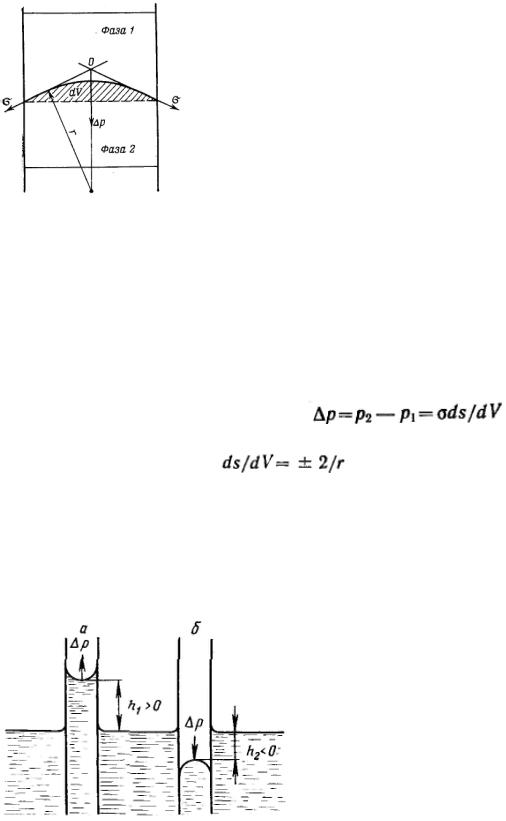
Рассмотрим результат влияния кривизны поверхности раздела между двумя несмешивающимися жидкостями на внутреннее давление в фазах.
Кривизна вызывает изменение площади и положения межфазной поверхности, что можно выразить приращением поверхностной энергии σds. Кроме того, изменяются объемы фаз V1 и V2 на dV1 и dV2. При условии постоянства объема всей системы dV1 = - dV2. Изменение объемов вызывает соответствующие изменения энергий фаз 1 и 2 на p1dV1 и p2dV2 (где p1 и р2 — давления внутри фаз). Соотношение между поверхностной энергией и «объемной» можно записать с помощью обобщенного уравнения первого и второго начал термодинамики
относительно энергии Гельмгольца F при T=const: 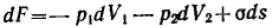
При равновесии между фазами |
F = 0, тогда |
Это уравнение называется уравнением Лапласа. |
|
Для сферической поверхности |
и уравнение принимает вид |
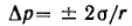 .
.
Капиллярные явления наблюдаются в содержащих жидкость узких сосудах (капилляры, капиллярно-пористые тела), у которых расстояние между стенками соизмеримо с радиусом кривизны поверхности жидкости. Кривизна возникает в результате взаимодействия жидкости со стенками сосуда (адгезия, смачивание). Специфика поведения жидкости в капиллярных сосудах зависит от того, смачивает или не смачивает
Рассмотрим положение уровней жидкости в двух капиллярах, один из которых имеет лиофильную поверхность и поэтому стенки его смачиваются, у другого внутренняя поверхность лиофобизирована и не смачивается. В первом капилляре поверхность жидкости имеет отрицательную кривизну, поэтому дополнительное давление Лапласа стремится растянуть жидкость (давление направлено к центру кривизны) и поднимает ее в капилляре. Кривизна поверхности жидкости во втором капилляре положительна, дополнительное давление направлено внутрь жидкости, в результате жидкость в капилляре опускается

(отрицательное капиллярное поднятие). При равновесии лапласовское давление равно гидростатическому давлению столба жидкости высотойh:
Чтобы высоту капиллярного поднятия связать с характеристикой смачивания, радиус мениска необходимо выразить через угол смачивания θ и радиус капилляра r0. На рисунке показан мениск жидкости в капилляре. Видно, что r0 = r·соsθ, тогда высоту капиллярного поднятия можно представить в виде формулы Жюрена:
Нередко приходится наблюдать, как жидкость не может вытечь из капилляра под действием силы тяжести. Это объясняется проявлением действия капиллярного потенциала, направленного против силы тяжести, так как на нижнем конце капилляра жидкость образует мениск с положительной кривизной. Если часть капилляра, находящаяся над жидкостью, меньше высоты поднятия жидкости, жидкость из него не вытекает, так как кривизна мениска жидкости вверху капилляра становится положительной (положительный радиус кривизны), отвечающей гидростатическому давлению столба жидкости, равному размеру (высоте) капилляра, т. е. устанавливается равновесие.

6.Влияние дисперсности на термодинамическую реакционную способность. Вывод уравнения капиллярной конденсации Кельвина. Влияние дисперсности на растворимость, константу равновесия химической реакции и температуру фазового перехода.
Термодинамическая реакционная способность характеризует способность вещества переходить в какое-либо иное состояние, например переходить в другую фазу, вступать в химическую реакцию. Она указывает на удаленность данного состояния вешества или системы компонентов от равновесного состояния при определенных условиях. Термодинамическая реакционная способность определяется химическим сродством, которое можно выразить изменением энергии Гиббса или разностью химических потенциалов. Реакционная способность зависит от степени дисперсности вещества, изменение которой может приводить к сдвигу фазового или химического равновесия.
Соответствующее приращение энергии Гиббса dGд (благодаря изменению дисперсности) можно представить в виде объединенного уравнения первого и второго начал термодинамики:
Для индивидуального вещества V=Vм и при Т=const имеем:
Подставляя в это уравнение соотношение Лапласа, получим: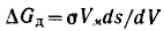
для сферической кривизны: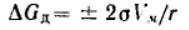 Если рассматривается переход вещества из конденсированной фазы в газообразную, то
Если рассматривается переход вещества из конденсированной фазы в газообразную, то
энергию Гиббса можно выразить через давление пара, приняв его за идеальный. Дополнительное изменение энергии Гиббса, связанное с изменением дисперсности,
составляет:
Подставляя данное выражение, получим:
Полученное соотношение называется уравнением Кельвина (уравнение капиллярной конденсации).(pд-равновесное давление адсорбата, ps-насыщ давление пара адсорбата) Для неэлектролитов его можно записать следующим образом:
Из этого уравнения видно, что с увеличением дисперсности растворимость растет, или химический потенциал частиц дисперсной системы больше, чем у крупной частицы, на величину 2σV/r.
Степень дисперсности может влиять также на равновесие химической реакции:
Сувеличением дисперсности повышается активность компонентов, а в соответствии с этим изменяется константа химического равновесия в ту или другую сторону, в зависимости от степени дисперсности исходных веществ и продуктов реакции.
Сизменением дисперсности веществ изменяется температура фазового перехода. Количественная взаимосвязь между температурой фазового перехода и дисперсностью вытекает из термодинамических соотношений.
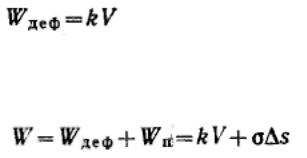
Для фазового перехода: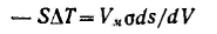 ,
,
Для сферических частиц: 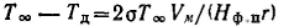
Видно, что с уменьшением размера частиц г температуры плавления и испарения вещества уменьшаются (Hф.п.>0).
7.Методы получения дисперсных систем: диспергирование и конденсация. Уравнение Ребиндера для работы диспергирования. Адсорбционное понижение прочности (эффект Ребиндера). Конденсация физическая и химическая. Энергия Гиббса образования зародыша новой фазы при гомогенной конденсации; роль пересыщения.
Диспергирование и конденсация — методы получения свободно-дисперсных систем: порошков, суспензий, золей, в том числе аэрозолей, эмульсий и т. д. Под диспергированием понимают дробление и измельчение вещества, под конденсацией — образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты.
Работа упругого и пластического деформирования пропорциональна объему тела:
Работа образования новой поверхности при диспергировании пропорциональна приращению
поверхности: 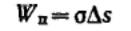
Полная работа, затрачиваемая на диспергирование, выражается уравнением Ребиндера:
Разрушение материалов может быть облегчено при использовании эффекта Ребиндера — адсорбционного понижения прочности твердых тел. Этот эффект заключается в уменьшении поверхностной энергии с помощью поверхностно-активных веществ, в результате чего облегчается деформирование и разрушение твердого тела.
Процесс конденсации предполагает образование новой фазы на уже имеющихся поверхностях (стенках сосуда, частицах посторонних веществ — ядрах конденсации) или на поверхности зародышей, возникающих самопроизвольно в результате флуктуации плотности и концентраций вещества в системе. В первом случае конденсация называется гетерогенной, во втором — гомогенной.
Чтобы сконденсированное вещество не возвращалось в первоначальную фазу и конденсация продолжалась, исходная система должна быть пересыщенной. В противном случае конденсация не может происходить, исчезают и зародыши конденсации (путем их испарения, растворения, плавления).
При гомогенной конденсации происходит самопроизвольное образование зародышей; энергия поверхности выступает в качестве потенциального барьера конденсации. Энергию Гиббса образования зародышей выражают (в соответствии с объединенным уравнением первого и второго начал термодинамики) в виде четырех составляющих: энтропийной, механической, поверхностной и химической.
Для жидких и газообразных фаз можно ограничиться двумя первыми составляющими энергии Гиббса образования зародышей.
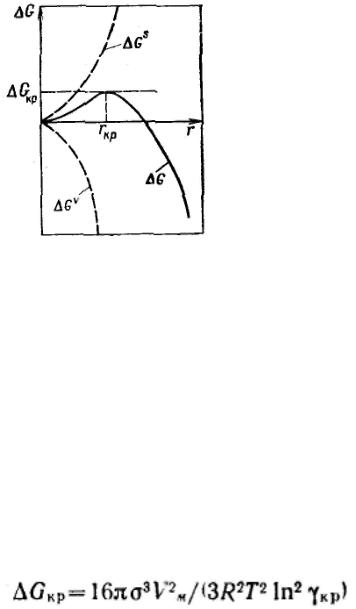
Если степень пересыщения меньше критической, то возникающие зародыши самопроизвольно испаряются (растворяются). Их размеры меньше критического, поэтому энергия Гиббса понижается с уменьшением размера зародыша. Пересыщенный раствор или пар в этих условиях иногда удобно представить как гетерогенно-дисперсную систему, в которой присутствует множество постоянно образующихся и исчезающих зародышей новой фазы. В критической точке неустойчивость равновесия проявляется в том, что существует равная вероятность возникновения и исчезновения зародышей конденсации.
Если степень пересыщения больше критической величины, то возникающие зародыши будут самопроизвольно расти.
Критическая энергия Гиббса образования зародышей конденсации соответствует
критической точке — максимуму функции G = f(r): 
Таким образом, энергия Гиббса образования зародышей при гомогенной конденсации равна одной трети поверхностной энергии зародыша. Если найти радиус зародыша в критической точке, приравняв к нулю первую производную от энергии Гиббса и подставить его в данное выражение, то получим:
Из этого соотношения следует, что энергия образования зародыша конденсации зависит от степени пересыщения, от нее же зависит и размер критического радиуса зародыша. Чем выше степень пересыщения, тем ниже энергия Гиббса образования зародышей и тем меньше размеры образующихся зародышей, способных к дальнейшему росту.
8.Классификация механизмов адсорбции. Природа адсорбционных сил и их особенности при физической адсорбции. Вывод уравнения для энергии дисперсионного взаимодействия атома адсорбата с адсорбентом. Изотерма, изостера, изопикна адсорбции.
Процессы адсорбции классифицируют в соответствии с типом взаимодействия адсорбата с адсорбентом. Физико-химическая классификация основывается на том положении, что перераспределение компонентов между объемной фазой и поверхностным слоем может происходить под действием физических сил или в результате химической реакции между адсорбатом и адсорбентом. Химическую реакцию в этом случае можно представить либо как химическое присоединение атомов (молекул), либо как ионообменное взаимодействие. Таким образом, согласно физико-химической классификации различают физическую
(молекулярную) адсорбцию, хемосорбцию (химическое присоединение атома, молекулы) и ионный обмен.
При физической адсорбции взаимодействие адсорбента и адсорбата осуществляется за счет сил Ван-дер-Ваальса и водородных связей. Эти адсорбционные силы обеспечивают притяжение атомов (молекул); на очень близком расстоянии проявляются короткодействующие силы отталкивания.
При химической адсорбции между адсорбатом и адсорбентом образуется химическая связь, и они теряют индивидуальность.
Для молекул с небольшими дипольными моментами основной вклад в энергию взаимодействия вносят дисперсионные силы. Характерно, что для всех трех составляющих сил Ван-дер-Ваальса выполняется один и тот же закон изменения энергии притяжения от
расстояния:  .
.
Так как общая энергия взаимодействия при адсорбции Uадс определяется суммой энергии взаимодействия адсорбированного атома со всеми атомами в объеме адсорбента, то
Величину dV можно определить через поверхность шарового сегмента:
Тогда 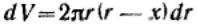 Подставляя, получим:
Подставляя, получим:
Проведем интегрирование в пределах расстояния от r = х до r = ∞ и окончательно получим:
Зависимость величины адсорбции от концентрации (или парциального давления) вещества при постоянной температуре называется изотермой адсорбции.
Зависимость величины адсорбции от температуры прв постоянной концентрации (или парциальном давлении) вещества называется изопикной (или изобарой) адсорбции. Зависимость концентрации (или парциального давления) вещества в объеме от температуры при постоянной величине адсорбции называется изостерой адсорбции.
9.Мономолекулярная адсорбция, форма изотермы адсорбции. Уравнение Генри. Основные положения теории Ленгмюра.
Закон Генри можно сформулировать следующим образом: при разбавлении системы (уменьшение давления) коэффициент распределения стремится к постоянному значению, равному константе распределении Генри. Относительно величины адсорбции А этот закон
запишется так: 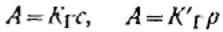
Эти уравнения представляют собой изотермы адсорбции вещества при малых концентрациях. В соответствии с ними закон Генри можно сформулировать так: величина адсорбции при малых давлениях газа (концентрациях вещества в растворе) прямо пропорциональна давлению (концентрации).
Отклонения от закона Генри, выражаемые изменениями коэффициентов активности в фазах, обычно не позволяют описать и прогнозировать ход изотерм с увеличением концентрации. (давления) адсорбата. Чтобы получить теоретическую изотерму адсорбции, описывающую более широкую область концентраций, необходимо использование представлений о механизме адсорбции и конкретных моделей.
Большую долю отклонений коэффициента активности адсорбата в поверхностном слое от единицы можно учесть, используя представление об адсорбции как о квазихимической реакции между адсорбатом и адсорбционными центрами поверхности адсорбента. В этом заключается основная идея адсорбционной теории Ленгмюра. Это положение уточняется следующими допущениями:
1)адсорбция локализована (молекулы не перемещаются по поверхности) на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбата; в результате образуется мономолекулярный слой;
2)адсорбционные центры энергетически эквивалентны — поверхность адсорбента эквипотенциальна;
3)адсорбированные молекулы не взаимодействуют друг с другом.
10.Теopия полимолекулярной адсорбции БЭТ: исходные положения, вывод уравнения изотермы и его анализ. Линейная форма уравнения БЭТ. Определение удельной поверхности адсорбентов, катализаторов и других пористых тел.
Уравнение Ленгмюра можно использовагь только при условии, что адсорбция вещества сопровождается образованием мономолекулярного слоя.
В большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию и влияние поверхностных сил может распространяться на второй, третий и последующие адсорбционные слои, в результате проходит полимолекулярная адсорбция.

Современная форма уравнения полимолекулярной адсорбции — основного уравнения обобщенной теории Ленгмюра — была предложена Брунауэром, Эмметом и Теллером.
В этой теории дополнительным допущением к тем, которые были положены в основу вывода уравнения изотермы Ленгмюра, является представление об образовании на поверхности адсорбента «последовательных комплексов» адсорбционных центров с одной, двумя, тремя и т. д. молекулами адсорбата. Тогда процесс адсорбции можно представить в виде последовательных квазихимических реакций:
Константы равновесия этих реакций соответственно равны
Обозначим:
Общее число активных центров на адсорбенте, или емкость монослоя, будет равна
После ряда вычислений с применением теории рядов, окончательно получим:
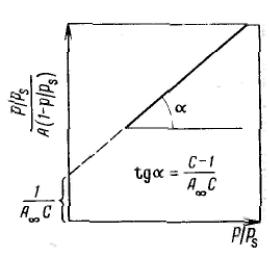
Данное соотношение является основным уравнением обобщенной теории Ленгмюра и называется уравнением полимолекулярной адсорбции БЭТ.
При обработке экспериментальных результатов уравнение БЭТ обычно используют в
линейной форме: 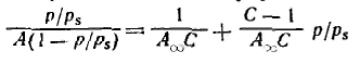 Оно позволяет графически определить оба постоянных параметра A∞ и С:
Оно позволяет графически определить оба постоянных параметра A∞ и С:
Экспериментальное определение A∞ позволяет рассчитать удельную поверхность адсорбента
(поверхность единицы массы адсорбента): 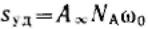 .
.
10.Количественные характеристики пористых материалов: пористость, удельная поверхность, размер пор. Пористые тела корпускулярной, кристаллической и губчатой структуры, методы их получения. Классификации пор по Дубинину и теория адсорбции.
Пористые тела — это твердые тела, внутри которых имеются поры, обусловливающие наличие внутренней межфазной поверхности. Поры могут быть заполнены газом или жидкостью.
Высокодисперсные пористые неорганические материалы, в частности, адсорбенты и катализаторы, получают в основном двумя методами. Один из них заключается в синтезе гидрозоля с последующей его коагуляцией для образования геля; гель высушивают. Частицы дисперсной фазы (корпускулы) в результате этих операций срастаются с образованием твердого каркаса. Так как частицы золя высокодисперсны, то получаемый пористый материал имеет большую удельную поверхность. Таким методом получают адсорбенты корпускулярной структуры.
Второй метод получения высокодисперсных пористых адсорбентов и катализаторов заключается в обработке крупнопористых материалов агрессивными газами или жидкостями. При такой обработке получаются пористые тела губчатой структуры.
Наибольшее распространение получила классификация пористых тел, предложенная M. M. Дубининым. По этой классификации за основу приняты размеры пор и механизм протекающих в них адсорбционных процессов. По классификации M. M. Дубинина пористые тела делятся на макропористые, переходнопористые, микропористые в зависимости от линейного размера, под которым понимают полуширину для щелевидной поры или радиус для сферической или цилиндрической поры.
Макропористые тела имеют поры радиусом больше 100,0 — 200,0 нм, удельная поверхность макропористых тел находится в пределах 0,5 — 2 м2/г. В связи с тем, что такие поры намного больше адсорбируемых молекул, то их стенки по сравнению с молекулами можно рассматривать как ровные поверхности, поэтому для макропористых тел применима обобщенная теория адсорбции Ленгмюра.
Переходнопористые тела (или капиллярно-пористые, или мезопористые) имеют размеры пор в пределах от 1,5 до 100,0 — 200,0 нм их удельная поверхность составляет от 10 до 500 м2/г. Ha стенках этих пор при малых давлениях происходит полимолекулярная адсорбция паров, которая с увеличением давления заканчивается капиллярной конденсацией.
Микропористые тела обладают порами, соизмеримыми с размерами адсорбируемых молекул. Радиусы пор лежать в пределах от 0,5 до 1,5 нм. Удельная поверхность таких тел 500 — 1000 м2/г и выше. Отличительной чертой микропор является настолько близкое расположение противоположных стенок, что их поля поверхностных сил перекрываются и они действуют во всем объеме микропор.
Одной из основных характеристик пористой структуры тела является пористость —
отношение объема пор Vп к общему объему тела Vобщ: 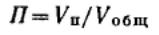
Если принять, что поры в пористых телах и порошках имеют правильную форму, то их размеры можно оценить, зная пористость и удельную поверхность:
Для определения пористости и удельной поверхности пористых тел широко используются адсорбционные методы.
11.Адсорбция на пористых адсорбентах. Теория капиллярной конденсации. Капиллярно-конденсационный гистерезис. Расчет и назначение интегральной и дифференциальной кривых распределения объема пор по размерам.
Удерживание газов и паров пористыми телами, т. е. их адсорбционная способность, зависят как от природы взаимодействующих тел, так и от структуры пористого тела. Если структурный фактор для макропористых адсорбентов имеет малое значение, то уже для переходнопористых тел его роль резко возрастает. Это обусловлено в первую очередь проявлением капиллярных сил. Чем меньше размер пор, тем сильнее капиллярное удерживание адсорбата. В противном случае (если поверхность не смачивается) наблюдается капиллярное выталкивание вещества из пор, адсорбция на несмачиваемых телах минимальна и возможна только на ровной поверхности и в крупных порах.
Адсорбция на переходнопористых телах происходит в основном по механизму капиллярной конденсации. Капиллярная конденсация начинает проявляться при определенной степени заполнения адсорбента или при определенном значении давления пара, характерном для данной системы.
