
колды экз
.pdf
где Z1, Z2 - заряды обменивающихся ионов М1 и М2.
Константа равновесия этой реакции называется константой ионного обмена.
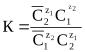 .
.
Все показатели с черточкой относятся к иониту, без черточки - к раствору. Возведя правую и левую части уравнения в степень 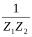 ,
,
получим -уравнение Никольского.
Для данного иона К’ отражает свойства обменивающихся ионов и характеризует их относительное сродство к иониту, т.е. селективность ионита по отношению к тому или иному иону. Если заряды обменивающихся ионов одинаково постоянны, то в уравнении это выражается коэффициентом разделения. Селективность зависит от многих факторов. Сетка матрицы сопротивляется набуханию, поэтому ионит предпочтительней поглощает менее гидратированный ион. Этот факт объясняет установленный для катионитов лиотропные ряды сорбируемости. Например, однозарядные катионы имеют ряд Li+ < Na+ < K+ < Rb+ < Cs+. Повышение жесткости матрицы достигается повышенным содержанием мостикообразователя и приводит к повышению селективности ионита по отношению к ионам большего размера в гидратированных состояниях. Если ионы имеют разные заряды, то действует правило электроселективности, в соответствии с которым из разбавленных растворов ионит предпочитает поглощать противоионы с меньшим зарядом.
Селективность зависит и от формы иона в растворе. Чем меньше их активность, тем хуже они сорбируются. Сорбируемость элементов высока, если они находятся в соответствующей ионной форме. Решающее влияние на селективность оказывает специфическое (химическое) сродство противоионов к иониту. Чем более прочную пару образует фиксированный ион (на матрице) с противоположным (чем больше химическое сродство), тем больше селективность электролита (ионита). Например, слабокислые катионы имеют специфическое сродство с Н+- ионами и поэтому сорбируют их сильнее, чем ионы щелочных металлов.
18.Вывод уравнения для скорости осаждения частиц в гравитационном поле. Условия соблюдения Стокса. Седиментационный анализ, расчет и назначение кривых распределения по размерам.
Характерным общим свойством суспензий, порошков, эмульсий и аэрозолей, особенно если они разбавлены, являетсц склонность к оседанию или всплыванию частиц дисперсной фазы. Оседание частиц дисперсной фазы называется седиментацаей, а всплывание частиц — обратной седиментацией.
На каждую частицу в системе действует сила тяжести (гравитационная сила) и подъемная сила Архимеда: 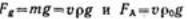 Эти силы постоянны и направлены в разные стороны, равнодействующая сила, вызывающая
Эти силы постоянны и направлены в разные стороны, равнодействующая сила, вызывающая
седиментацию, равна:  Так как седиментация протекает в определенной среде, то при ламинарном движении
Так как седиментация протекает в определенной среде, то при ламинарном движении
частицы возникает сопротивление — сила трения, пропорциональная скорости движения частнцы: 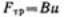
Таким образом, сила, действующая на частицу, во время движения, равна:

C ростом скорости при достаточно большом коэффициенте трения наступает момент, когда сила трения достигает силы, вызывающей седиментацию, и таким образом движущая сила F оказывается равной нулю.
Выражение для силы трения, возникающей при движении сферических частиц, можно представить в виде закона Стокса:  .
.
Подставляя ее в полученное уравнение и выражая объем частицы через ее радиус, получим:
1)Закон Стокса справедлив, если частицы дисперсной фазы осаждаются независимо друг от дpyra, что может быть только в разбавленных системах.
2)Обычно частицы в дисперсных системах и твердой дисперсной фазой имеют неправильную форму. При свободном оседании частица несферической формы ориентируется в направлении движения таким образом, чтобы создавалось максимальное сопротивление движению, что уменьшает скорость осаждения.
3)Закон Стокса может не соблюдаться и при турбулентном режиме осаждения частиц.
4)Закон Стокса предполагает наличие внутреннего трения, или вязкого трения, когда граница (поверхность) движения частицы относительно среды находится внутри дисперсионной среды, вязкость которой определяет коэффициент трения. Если межфазное взаимодействие мало, граница (поверхность) движения частицы относительно среды может совпадать с поверхностью раздела фаз и трение оказывается внешним. Это приводит к возникновению скольжения, ускоряющему движение частицы.
5)Применимость закона Стокса ограничивается также дисперсностью частиц. Большие частицы (>100 мкм) могут двигаться ускоренно, очень малые частицы — ультрамикрпгетерогенные (<0,1 мкм) осаждаются настолько медленно, что следить за такой седиментацией практически невозможно.
Принцип седиментационного метода анализа дисперсности состоит в измерении скорости осаждения частиц, обычно в жидкой среде. По скорости осаждения с помощью соответствующих уравнений рассчитывают размеры частиц. Метод позволяет определить распределение частиц по размерам и соответственно подсчитать их удельную поверхность.
При седиментационном анализе дисперсности полидисперсных систем определяют время осаждения частиц отдельных фракций, рассчитывают скорости их осаждения и соответствующие им размеры частиц. Для этого сначала измеряют зависимость массы осевшего осадка от времени, строят график этой зависимости, называемой кривой седиментации, по которому затем определяют все необходимые характеристики дисперсной системы.
Имеются графические и аналитические методы расчета кривой седиментации.

Реальная кривая седиментации полидисперсной системы обычно получается плавной и ей отвечает множество бесконечно малых участков, касательные в каждой точке этой кривой отражают седиментацию данной бесконечно малой фракции.
Результаты седиментациоиного анализа дисперсности полиднсперсных систем представляют также в виде кривых распределения частиц по размерам, характеризующих степень полиднсперсности системы.
Кривая распределения является наглядной и удобной характеристикой полидисперсности системы, по которой легко определить содержание различных фракций. Ее строят подобно кривой распределения пор по размерам. Обычно сначала получают интегральную кривую распределения, проводят ее выравнивание с учетом точности получаемых средних значений радиусов частиц фракций и затем по ней строят дифференциальную кривую распределения. Иногда дифференциальную кривую строят сразу. На оси абсцисс откладывают значения радиусов; на ось ординат наносят отношение приращения массовых долей к разности радиусов частиц соседних фракций x/ ri. Построив на графике отдельные прямоугольники для каждой фракции (гистограмму) и соединив плавной кривой середины их верхних сторон, получают дифференциальную кривую распределения частиц полидисперсной системы по размерам.
19.Природа броуновского движения, понятие и определение среднеквадратичного сдвига по выбранному ?. Взаимосвязь между среднеквалратичным сдвигом и коэффициентом диффузии (вывод закона Эйнштейна-Смолуховского). Экспериментальная проверка закона.
Основой доказательства теплового молекулярного движения в телах явилось обнаруженное английским ботаником Робертом Броуном в 1827 г. с помощью микроскопа непрерывное движете очень мелких частичек — спор папоротника (цветочной пыльцы), взвешенных в воде. Более крупные частицы находились в состоянии постоянного колебания около положения равновесия. Колебания и перемещения частиц ускорялись с уменьшением их размера и повышением температуры и не были связаны с какими-либо внешними механическими воздействиями.
Теоретически обоснованная интерпретация броуновского движения — участие частиц дисперсной фазы ультрамикрогетерогенных систем в тепловом движении — была дана независимо друг от друга Эйнштейнии (1905 г.) и Смолуховским (1906 г.).
Проведенными исследованиями была окончательно доказана природа броуновского движения. Молекулы среды (жидкости или газа) сталкиваются с частицей дисперсной фазы, в результате чего она получает огромное число ударов со всех сторон.

Эйнштейн и Смолуховский для количественного выражения броуновского движения частиц ввели представление о среднем сдвиге частицы. Если при наблюдении движения частицы золя под микроскопом через определенные равные промежутки времени отмечать ее местонахождение, то можно получить ее траекторию движения. Так как движение происходит в трехмерном пространстве, то квадрат среднего расстояния, проходимого
частицей за любой промежуток времени, равен .
.
Под микроскопам наблюдают проекцию смещения частицы на плоскость за какое-то время,
поэтому  .
.
При равновероятных отклонениях частицы ее направление будет находиться между направлениями x и у, т. е. под углом 45° к каждой координате. Отсюда или
или
 .
.
Из-за равновероятных отклонений среднеарифметическое значение сдвигов равно нулю. Поэтому используются среднеквадратичные расстояния, проходимые частицей:
Эйнштейн и Смолуховский, постулируя единство природы броуновского движения и теплового движения, установили количественную связь между средним сдвигом частицы (называемым иногда амплитудой смещения) и коэффициентом диффузии D.
Если броуновское движение является следствием теплового движения молекул среды, то можно говорить о тепловом движении частиц дисперсной фазы. Это означает, что дисперсная фаза, представляющая собой совокупность числа частиц, должна подчиняться тем же статистическим законам молекулярно-кинетической теории, приложимым к газам или растворам.
Для установления связи между средним сдвигом (смещением) частицы и коэффициентом диффузии представим себе трубку с поперечным сечениемS, наполненную золем, концентрация частиц которого уменьшается слева направо. В этом же направлении протекает и диффузия частиц золя (на рисуике отмечено стрелкой). Выделим по обе стороны от линии MN два малых участка 1 и 2, размеры которых в направлении диффузии равны — среднему квадратичному сдвигу за время τ. Обозначим частичную концентрацию золя в объемах этих участков соответственно через ν1 и ν2 (ν1>ν2). Хаотичность теплового движения приводит к равной вероятности переноса дисперсной фазы из обоих объемов вправо и влево от линии MN: половина частиц переместится вправо, а другая половина — влево. Количество
дисперсной фазы за время τ переместится из объема 1 вправо:  ,а из объема 2 влево
,а из объема 2 влево
(в обратном направлении):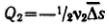 .
.
Так как |Q1| > |Q2| (ν1>ν2), то суммарное количество перенесенного вещества через плоскость MN вправо определится соотношением
 .
.

Градиент концентрации по расстоянию в направлении диффузии можно выразить так:
Подставляя, получим: 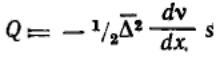 Сравнивая это соотношение с первым законом диффузии Фика:
Сравнивая это соотношение с первым законом диффузии Фика:
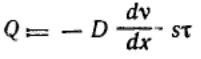 ,окончательно имеем:
,окончательно имеем:
Это уравнение выражает закон Эйнштейна — Смолуховского, в соответствии с которым квадрат среднего сдвига пропорционален коэффициенту диффузии н времени.
20.Седиментационно-диффузное равновесие. Вывод уравнения(гипсометрический закон Лапласа). Мера седиментационной устойчивости. Факторы, влияющие на седиментационную устойчивость дисперсных систем.
В золях через определенное, иногда очень длительное, время оседания частиц может наступить момент, когда диффузионный поток станет равным седиментационному iдиф = iсед, т.е. наступит диффузионно-седцментационное равновесие. Так как такое равновесие наступает при определенном градиенте концентраций, в системе должно установиться соответствующее распределение дисперсной фазы по высоте. Чтобы определить закон этого распределения, воспользуемся данным соотношением (iдиф = iсед), учтя, что
]
и заменив x на h (расстояние по высоте):
]
После разделения переменных получим:
]
Интегрируя в пределах от ν0 до νh и соответственно от h = 0 до h, найдем:
] или]
Это уравнение носит название гипсометрического закона (от лат. hypsos — высота). Если сравнить седиментацию при наличии диффузии и без нее, то обращает на себя внимание различие факторов, обеспечивающих устойчивость дисперсных систем к осаждению — седиментационную устойчивость. Эти факторы позволяют различать кинетическую седиментационную устойчивость (КСУ) и термодинамическую седиментационную устойчивость (ТСУ).
Мерой кинетической седиментационной устойчивости является величина, обратная константе седиментации:
]
Мерой ТСУ является гипсометрическая высота. Ее удобнее определить как высоту he, на протяжении которой концентрация дисперсной фазы изменяется в е раз.
]
Данная формула показывает, что гипсометрическая высота и соответственно термодинамическая седиментационная устойчивость тем больше, чем меньше размер частиц
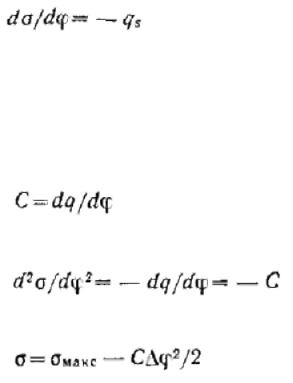
и разность между плотностями частиц и среды. Вязкость не влияет на ТСУ, в то (же время повышение температуры способствует устойчивости, так как усиливается тепловое движение. Кинетическая же седиментационная устойчивость с повышением температуры обычно снижается в связи с уменьшением вязкости среды
21.Механизмы образования двойного электрического слоя. Соотношения между электрическим потенциалом и поверхностным натяжением (вывод уравнений Липмана). Элеткокапилярные кривые и определение параметров ДЭС.
Различают три возможных механизма образования двойного электрического слоя:
1.Двойной электрический слой образуется в результате перехода ионов или электронов из одной фазы в другую (поверхностная ионизация). Например, с поверхности металла в газовую фазу переходят электроны, создавая электронное облако со стороны газовой фазы.
2.Образование двойного электрического слоя происходит в результате адсорбции. Двойной электрический слой может образоваться при избирательной адсорбции в межфазном слое ионов электролитов, не входящих в состав веществ, образующих фазы, т. е. в результате адсорбции примесей.
3.Если вещества, составляющие фазы системы, не способны обмениваться зарядами, то двойной электрический слой может образоваться благодаря ориентированию полярных молекул сопряженных фаз в результате их взаимодействия.
Из объединенных первого и второго начал термодинамики, а также полного дифференциала энергии Гиббса выводится первое уравнение Липпмана, связывающее электрический потенциал с поверхностным натяжением:
]
Если знаки потенциала и заряда совпадают, то поверхностное натяжение снижается с ростом потенциала. Если же их знаки противоположны, то увеличение потенциала ведет к росту поверхностного натяжения. Эти зависимости тем сильнее,чем больше абсолютное значение плотности заряда. При минимальной плотности заряда поверхностное натяжение слабо зависит от потенциала.
Дифференциальная емкость двойного электрического слоя, как н любого конденсатора, определяется соотношением:
]
После дифференцирования первого уравнения Липмана по φ и подстановки в него данного соотношения получим второе уравнение Липпмана:
]
Это уравнение показывает возможность определения емкости двойного электрического слоя, если известна зависимость σ от φ.
]
Это уравнение называют уравнением электрокапиллярной кривой. Из него следует, что поверхностное натяжение при условии постоянства емкости двойного электрического слоя изменяется в соответствии с уравнением параболы.

]
Вершина параболы отвечает максимальному поверхностному натяжению σмакс. Парабола симметрична, что по физическому смыслу означает равное сродство катионов и анионов, выступающих в роли противоионов, к поверхности, имеющей соответственно отрицательный и положительный потенциал. Уменьшение положительного потенциала, как и отрицательного, ведет к увеличению поверхностного натяжения. Однако в реальных системах емкость двойного электрического слоя несколько изменяется с изменением потенциала, и поэтому экспериментальные электрокапиллярные кривые обычно не являются симметричными.
Вершина параболы соответствует точке нулевого заряда. В этой точке поверхностное натяжение не зависит от потенциала, так как производная dσ/dφ равна нулю, т. е. поверхностный слой имеет нулевой заряд, что означает отсутствие двойного электрического слоя. Потенциал же поверхности в этой, точке не равен нулю.
22.Общие представления о теории строения ДЭС. Уравнение Пуассона-Больцмана для диффузной части ДЭС и его решение для случая слабозаряженных поверхностей. Уравнение Гуи-Чемпена.
Двойной электрический слой состоит из ионов одного знака, прочно связанных с дисперсной твердой фазой, и эквивалентного количества противоположно заряженных ионов, находящихся в жидкой дисперсной среде вблизи межфазной поверхности.
Дисперсионная среда представляется как непрерывная фаза, влияние которой на двойной электрический слой определяется лишь ее диэлектрической проницаемостью. Существует несколько теорий описания двойного электрического слоя.
Теория Гельмгольца. Двойной электрический слой представляется как бы плоским конденсатором, одна обкладка которого может быть связана с поверхностью твердого тела, а другая обкладка, несущая противоположный заряд, находится на очень малом расстоянии от первой.
Недостатком этой теории является то, что толщина двойного электрического слоя очень мала и приближается к молекулярным размерам. Скачок электрокинетического потенциала, по теории Гельмгольца является разной величиной по сравнению с обычным электрохимическим потенциалом, и поэтому это теорию отвергли, и она представляет только исторический интерес.
Теория Гуи. По этой теории противоионы в двойном электрическом слое не могут быть сосредоточены у поверхности и образовывать монослой, они рассеяны в жидкой фазе на расстоянии от границы раздела. Такая теория структуры двойного электрического слоя определяется электрическим полем у твердой фазы и тепловым движением ионов, вследствие чего противоионы стремятся рассеяться во всем объеме жидкой фазы.
Эта теория не объясняет различного действия разных по природе противоионов одинаковой валентности на двойной электрический слой. Согласно ей введение одинакового количества

противоионов одинаковой валентности сжимает слой и вызывает падение потенциала. Тогда исходя из таких соображений теория применима к достаточно разбавленным растворам коллоидов.
Теория Штерна. О. Штерн, разрабатывая свою теорию, исходил из двух предпосылок: он принял, что ионы имеют конечные, вполне определенные размеры, учел специфическое, неэлектрическое взаимодействие ионов с твердой фазой. По теории Штерна, первый слой противоионов притягивается к стенке под влиянием электростатических и адсорбционных сил. В результате чего часть противоионов удерживается поверхностью на очень близком расстоянии.
При введении электролита в систему слой будет сжиматься, все большее и большее число будет попадать в адсорбционный слой. При уменьшении концентрации увеличивается толщина слоя, т. к. при разбавлении системы потенциал должен возрастать, вместе с этим может наблюдаться десорбция, что приведет также к падению потенциала. При изменении температуры (повышении) потенциал должен расти вследствие возрастания интенсивности теплового движения противоионов и увеличения двойного электрического слоя, в случае понижения температуры наблюдается процесс, обратный первому.
pH-среда влияет на число положительных и отрицательных зарядов на поверхности. Природа дисперсионных сил влияет так: потенциал дисперсной фазы тем больше, чем больше полярность растворителя, поэтому наличие двойного электрического слоя на межфазной границе характерно для систем с полярными дисперсионными средами.
Чем больше полярность жидкости, характеризуемая ее диэлектрической проницаемостью и дипольным моментом молекулы, тем выше скорость электроосмотического переноса частиц. На двойной электрический слой влияют электроповерхностные силы, носящие неравновесный характер.
Деформация слоя может идти при действии гравитационного поля, механических вибраций, броуновского движения, конвективных потоков жидкой среды.
бщие представления о теориях строения ДЭС. Уравнение Пуассона-Больцмана для диффузной части ДЭС При контакте раствора электролита с твердой фазой возникает разность потенциалов:
поверхность приобретает заряд, а в растворе у поверхности образуется слой, обогащенный ионами противоположного знака, – двойной электрический слой (ДЭС).
ДЭС впервые рассмотрен Г. Л. Ф. Гельмгольцем в виде плоского конденсатора с расстоянием между двумя рядами разноименно заряженных ионов, близким к диаметру молекул. Позднее бала предложена иная модель Гуи-Чепмена: ДЭС имеет диффузное строение, а концентрация противоионов (потенциалобразующих ионов) в поле действия поверхностного потенциала распределяется исходя из теплового движения. Современная теория строения ДЭС рассматривает слой в виде двух частей: одна находится у межфазной поверхности и образует адсорбционный слой (слой Гельмгольца) толщиной δ соответствующий диаметру находящихся в нем гидратированных ионов, другая – в диффузной части толщиной К, зависящей от свойств и состава раствора и коллоидной системы. Значение потенциала в слое Гельмгольца при удалении от потенциалобразующих ионов снижается линейно от ω0 до потенциала диффузного слоя, а затем изменяется по экспоненте. Толщина К соответствует
расстоянию, на котором потенциал диффузного слоя снижается в е раз (2,718 раза).
Концентрация ионов в диффузном слое на расстоянии х от границ раздела фаз пропорциональна распределению Больцмана:

где С – концентрация иона; i, z – валентности ионов в объеме раствора за пределами диффузного слоя; WX характеризует работу по перемещению 1 моля ионов из объема раствора на расстояние x до границы раздела фаз; F – число Фарадея; φх – потенциал на расстоянии х, изменяющийся от φх до φσ при х = σ.
Уравнение Пуассона — Больцмана:
]
Это уравнение после двойного интегрирования дает соотношение, выражающее закон изменения поверхностного потенциала от расстояния в диффузной части двойного электрического слоя и от свойств раствора. Чтобы в полной мере представлять возможности этого соотношения, лежащего в основе теории двойного электрического слоя, необходимо учитывать основные допущения и предположения, принятые Гуи и Чепменом при его выводе: двойной электрический слой является плоским, диэлектрическая проницаемость не зависит от расстояния х, ионы представляют собой точечные заряды (т. е. не имеют объема), при переводе противоионов из объема раствора в двойной электрический слой совершается работа только против электростатических сил.
Обычно уравнение Пуассона — Больцмана решают применительно к конкретным граничным условиям. Ниже приводится его решение при условии малости потенциала диффузного слоя
(φδ<<25 мВ).
Обозначим экспоненциальный показатель у фактора Больцмана через у. При малых значениях φ и соответственно y<<1 фактор Больцмана можно разложить в ряд Маклорена:
]
Если ограничиться двумя первыми членами ряда, то уравнение для объемной плотности заряда после этих преобразований примет вид:
]
Первый член правой части этого уравнения равен нулю. так как он включает сумму зарядов в объеме раствора, которая по условиям электронейтральности равна нулю, и поэтому окончательно имеем:
]
После такого преобразования уравнение Пуассона — Больцмана принимает следующую форму:
]
Выражение æ2 перед φх включает постоянные, характеризующие свойства раствора, поэтому можно считать, что они не изменяются с расстоянием от поверхности:
]
Окончательно имеем: 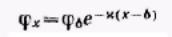
Если расстояние х отсчитывать от начала диффузной части двойного электрического слоя, то
Последние уравнения называются уравнениями Гуи-Чепмена, из них следует, что потенциал в области диффузного слоя в зависимости от расстояния уменьшается по экспоненте.
23.Современная теория строения ДЭС (теория Штерна) роль специфической адсорбции, перезарядка поверхности. Примеры образования ДЭС. Строение мицеллы (формулы ДЭС).
]
Современная теория строения двойного электрического слоя основана на представлениях Штерна. Она объединяет две предыдущие теории. Согласно современной теории слой противоионов состоит из двух частей.
Одна часть примыкает непосредственно к межфазной поверхности и образует адсорбционный слои (слой Гельмгсиьца) толщиной δ, которая равна радиусу гидратированных ионов, его составляющих. Другая часть противононов находится в диффузной части — диффузный слой (слой Гуи) с потенциалом φδ, толщина λ которой может быть значительной и зависит от свойств и состава системы. Потенциал в диффузной части двойного электрического слоя не может зависеть линейно от расстояния, так как ионы в нем распределены неравномерно. В соответствии с принятыми представлениями потенциал в слое Гельмгольца при увеличении расстояния от слоя потенциалопределяющих ионов снижается до потенциала диффузного слоя линейно, а затем, как будет показано, по экспоненте. Теория Штерна учитывает также специфическую (некулоновскую, химическую) составляющую адсорбции ионов на поверхности раздела фаз, которая существенным образом может влиять на изменение потенциала.
Пренебрежение размерами ионов приводит к тому, что не принимается во внимание толщина адсорбционною слон, и это, в свою очередь, вызывает большие погрешности при расчете параметров двойного электрического слоя. Кроме того, теория Гуи — Чепмена рассматривая только влияние концентрации и заряда ионов электролитов на изменение потенциала, не объясняет различного действия ионов разной природы, связанного со специфической адсорбцией их на межфазной поверхности.
Штерн предложил рассматривать слой противоионов состоящим из двух частей: внутренней (плотный слой Гельмгольца) и внешней (диффузный слой). Таким образом, теорию Гуи — Чепмена можно использовать для описания только строения внешней части слоя, где можно пренебречь адсорбционными силами и размерами ионов. Внутреннюю (плотную) часть Штерн представил как адсорбционный моноионный слой, в котором противоионы примыкают к поверхности благодаря электростатическим силам и специфическому взаимодействию. Введенный Штерном потенциал φδ часто называют штерновским. В
