
- •Часть 4. Гетерофункциональные соединения.
- •21.1. Строение и номенклатура.
- •21.2. Методы получения.
- •21.3. Физические и химические свойства гидроксикислот.
- •21.4. Стереоизомерия гидроксикислот.
- •21.5. Стереохимия реакций замещения и присоединения с участием
- •В случае фумаровой кислоты атака с разных сторон (50 на 50%) приводит к образованию рацемата:
- •2 1.6. Разделение рацематов.
- •22.1. Строение и номенклатура.
- •22.2. Методы получения.
- •22.3. Химические свойства.
- •23.1. Строение и номенклатура.
- •Методы получения.
- •23. 3. Свойства аминокислот.
- •24.1. Понятие о полипептидах и белках.
- •24.2. Классификация белков.
- •24.3. Структура белков.
- •Р исунок 24.1
- •24.4. Установление первичной структуры белков.
- •24.5. Синтез белков химическими методами.
- •25.1. Введение.
- •25.2. Моносахариды.
- •26.1. Химические свойства моносахаридов.
- •26.2. Брожение моносахаридов.
- •27.1. Олигосахариды или сахароподобные вещества.
- •27.2. Несахароподобные полисахариды.
- •С хема 27.2. Формула амилозы:
22.1. Строение и номенклатура.
 Эти
соединения, содержащие два вида функций
– кислотную СООН
и карбонильную С=О.
Они делятся на альдегидокислоты и
кетокислоты. Представители и их
номенклатура:
Эти
соединения, содержащие два вида функций
– кислотную СООН
и карбонильную С=О.
Они делятся на альдегидокислоты и
кетокислоты. Представители и их
номенклатура:
2-оксоэтановая, 3-оксопропановая, 2-оксопропановая, 3-оксобутановая,
глиоксалевая, малональдегидная, пировиноградная, ацетоуксусная,
формилмура- формилуксусная, -кетопропионовая, -кетомасляная.
вьиная,
22.2. Методы получения.
22.2.1. Окисление спиртов, гликолей, гидроксикислот.
Это уже рассматривалось ранее.
22.2.2. Ацилирование цианидов с дальнейшим гидролизом.

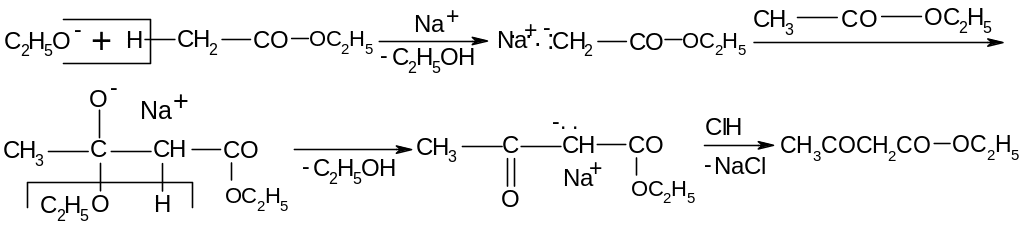
22.2.3. Сложноэфирная конденсация Кляйзена.
![]()
Механизм: реакция катализируется сильным основанием – этилатом натрия (С2Н5ОNa).
 С2Н5ОNa С2Н5О
+ Na+
С2Н5ОNa С2Н5О
+ Na+
В результате конденсации в качестве промежуточного продукта образуется натрий ацетоуксусный эфир, строение которого можно изобразить резонансными структурами:
У
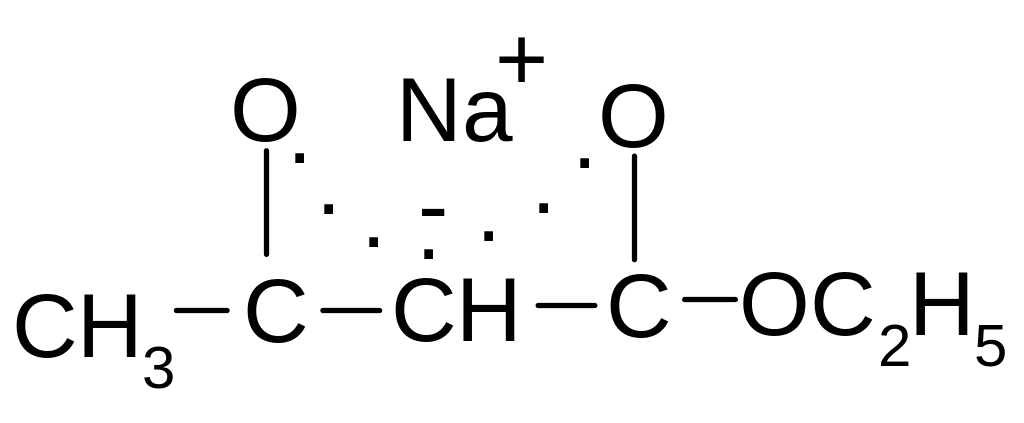 средненное
изображение натрий ацетоуксусного
эфира:
средненное
изображение натрий ацетоуксусного
эфира:
22.3. Химические свойства.
Остановимся на свойствах кетокислот и их эфиров, поскольку они широко используются в органическом синтезе, особенно ацетоуксусный эфир.
Кетокислоты имеют все свойства кетонов и кислот, но на них мы останавливаться не будем, поскольку они уже вам известны. Остановимся только на их специфических свойствах.
22.3.1. Реакции декарбоксилирования
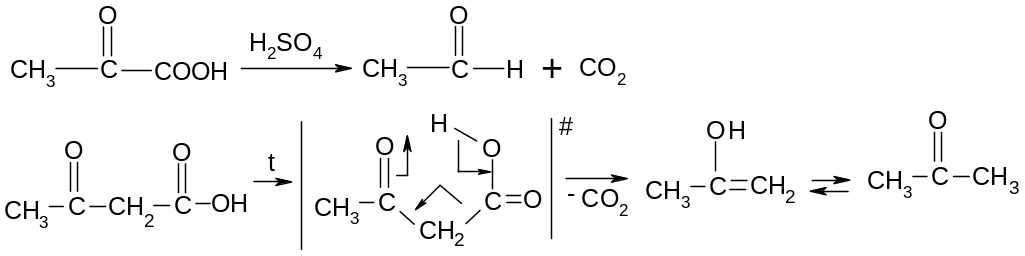 -Кетокислоты
и особенно -кетокислоты
очень легко декарбоксилируют:
-Кетокислоты
и особенно -кетокислоты
очень легко декарбоксилируют:
22.3.2. Кето-енольная таутомерия ацетоуксусного эфира.
Аналогично 1,3-дикетонам ацетоуксусный эфир вступает в таутомерное равновесие:
 Причем,
в равновесии находится 92% кетонной формы
и 8% енольной. Внутримолекулярная
водородная связь стабилизирует енольную
форму, но она все же менее стабильна,
чем в случае ацетилацетона (80% енольной
формы и 20% кетонной), вследствие сопряжения,
уменьшающего электроноакцепторные
свойства сложноэфирной группы:
Причем,
в равновесии находится 92% кетонной формы
и 8% енольной. Внутримолекулярная
водородная связь стабилизирует енольную
форму, но она все же менее стабильна,
чем в случае ацетилацетона (80% енольной
формы и 20% кетонной), вследствие сопряжения,
уменьшающего электроноакцепторные
свойства сложноэфирной группы:
 Таким
образом, в смеси существует две формы
(кетонная и енольная), каждая из них
может реагировать, т.е. ацетоуксусный
эфир проявляет двойственную реакционную
способность.
Таким
образом, в смеси существует две формы
(кетонная и енольная), каждая из них
может реагировать, т.е. ацетоуксусный
эфир проявляет двойственную реакционную
способность.
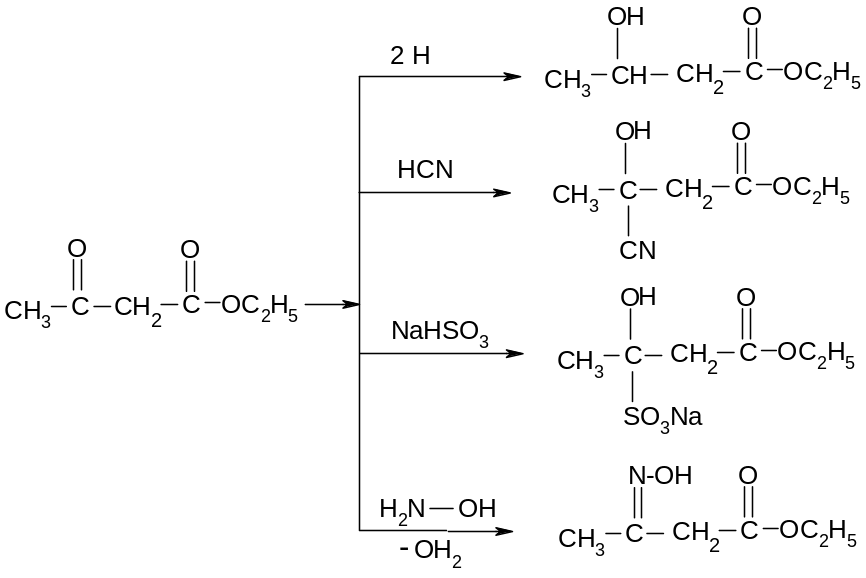 22.3.3.
Реакции кетонной формы ацетоуксусного
эфира.
22.3.3.
Реакции кетонной формы ацетоуксусного
эфира.
Здесь основания NC , SO3 , H2NOH слишком слабы, чтобы отрывать протон от метиленового звена, они могут реагировать только с полярной и легко поляризуемой карбонильной группой. Необходимо отметить, что абсолютно те же продукты образуются при атаке реагентов на двойную связь енольной формы, которая менее полярна и, следовательно, менее реакционноспособная, чем двойная связь в карбонильной группе. Поэтому формально будем считать, что в рассматриваемых реакциях участвует карбонильная форма. Пример реакции с участием енольной формы:

22.3.4. Реакции енольной формы ацетоуксусного эфира.
 Примеры
реакций с участием енольной формы:
Примеры
реакций с участием енольной формы:
комплексное соединение красно-фиолетового цвета
 С
точки зрения концепции «жестких и мягких
кислот и оснований» енольная форма
имеет два основных центра: жесткий на
атоме кислорода гидроксильной группы
и мягкий на -атоме
углерода при двойной связи. Представленные
на схеме реагенты являются жесткими
кислотами, вследствие чего и реагируют
с гидроксилом енола. При этом диазометан,
являясь сильным основанием, отрывает
протон от енола и превращает его в еще
более жесткое основание (енолят анион),
сам же диазометан превращается в жесткий
электрофил – карбокатион СН3+.
Что же касается реакции с участием
ацетилхлорида, то ее проводят в присутствии
основания пиридина, который, с одной
стороны, за счет водородной связи
усиливает основность (и жесткость)
енольного гидроксила, а с другой, образует
с ацетилхлоридом более жесткий электрофил
(ср. раздел 30.1.3.3 лекции № 30) – соль типа:
С
точки зрения концепции «жестких и мягких
кислот и оснований» енольная форма
имеет два основных центра: жесткий на
атоме кислорода гидроксильной группы
и мягкий на -атоме
углерода при двойной связи. Представленные
на схеме реагенты являются жесткими
кислотами, вследствие чего и реагируют
с гидроксилом енола. При этом диазометан,
являясь сильным основанием, отрывает
протон от енола и превращает его в еще
более жесткое основание (енолят анион),
сам же диазометан превращается в жесткий
электрофил – карбокатион СН3+.
Что же касается реакции с участием
ацетилхлорида, то ее проводят в присутствии
основания пиридина, который, с одной
стороны, за счет водородной связи
усиливает основность (и жесткость)
енольного гидроксила, а с другой, образует
с ацетилхлоридом более жесткий электрофил
(ср. раздел 30.1.3.3 лекции № 30) – соль типа:
22.3.5. Разложение ацетоуксусного эфира.
Ацетоуксусный эфир и его производные расщепляются различными путями, что используется при синтезе кислот или кетонов. Характер расщепления зависит от концентрации щелочи. В случае концентрированной щелочи ( 5М раствор) имеет место кислотное расщепление, а при действии разбавленных щелочей или минеральных кислот – кетонное расщепление:
 Кислотное
расщепление (обратная реакция процессу
конденсации):
Кислотное
расщепление (обратная реакция процессу
конденсации):
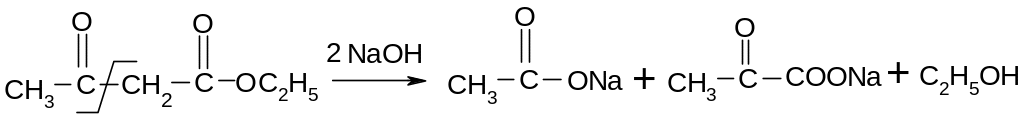
22.3.6. Синтезы при помощи ацетоуксусного эфира.
 Таким
образом, при кислотном распаде образуется
соль валериановой кислоты. В разведенном
растворе щелочи происходит кетонное
расщепление:
Таким
образом, при кислотном распаде образуется
соль валериановой кислоты. В разведенном
растворе щелочи происходит кетонное
расщепление:
 Еще
один синтез:
Еще
один синтез:

Лекции № 23.
АМИНОКИСЛОТЫ.
