
- •12.2. Галогенпроизводные углеводородов.
- •12.3. Нуклеофильное замещение.
- •12.4. Побочные реакции при sn1-замещении.
- •12.5. Реакции отщепления.
- •13.1. Введение.
- •14.1. Гликоли.
- •1 4.2. Двухатомные фенолы.
- •14.3. Трехатомные спирты. Глицерин.
- •14.4. Простые эфиры.
- •14.5. Строение и номенклатура оксосоединений.
- •14.6. Методы синтеза оксосоединений.
- •14.7. Строение карбонильной группы.
- •14.8. Химические свойства оксосоединений.
- •15.1. Реакции окисления.
- •15.2. Реакции замещения водорода в -положении по отношению к
- •15.3. Реакции конденсации.
- •15.4. Реакции замещения кислорода на галогены.
- •1 5.5. Реакции восстановления.
- •15.6. Реакции полимеризации.
- •15.7. Дикарбонильные соединения.
- •16.1 Введение.
- •16.2. Монокарбоновые насыщенные кислоты.
- •16.3. Ассоциация карбоновых кислот.
- •16.3. Строение карбоксильной группы.
- •16.4. Химические свойства.
- •16.5. Ненасыщенные карбоновые кислоты.
- •17.1. Классификация, номенклатура, изомерия.
- •17.2. Методы синтеза.
- •17.3. Химические свойства.
- •18.1. Нитросоединения.
- •18.2. Амины.
- •19.1. Свойства ароматических аминов.
- •19.2. Диамины.
- •19.3. Ароматические диазосоединения.
- •19.4. Алифатические диазосоединения.
- •20.1.Введение.
- •20.2. Производные непереходных элементов.
- •20.3. Эос переходных элементов.
- •20.4. Общие методы синтеза.
- •20.5. Серусодержашие соединения.
- •20.6. Фосфорорганические соединения.
14.8. Химические свойства оксосоединений.
Основными типами химических реакций кетонов и альдегидов являются:
Присоединение по карбонильной группе с разрывом -связи.
Конденсации.
Окисления.
Замещения.
Полимеризации.
14.8.1. Реакции простого присоединения.
14.8.1.1. Реакции гидратации.
Вода, как слабый нуклеофил, способна присоединятся только к очень активным альдегидам: Н2С=О, СН3СНО, CCl3CHO:
4 0%
раствор формальдегида в воде, где он
находится в виде гидрата, называют
формалином. Трихлоруксусный альдегид
образует устойчивый хлоральгидрат:
0%
раствор формальдегида в воде, где он
находится в виде гидрата, называют
формалином. Трихлоруксусный альдегид
образует устойчивый хлоральгидрат:
Б ольшинство
альдегидов и тем более кетонов гидраты
не образуют.
ольшинство
альдегидов и тем более кетонов гидраты
не образуют.
14.8.1.2. Реакции с бисульфитом натрия.
 В
реакцию вступают альдегиды и метилкетоны:
В
реакцию вступают альдегиды и метилкетоны:
З десь
атом серы более сильный нуклеофил
(бо’льший радиус – бо’льшая
поляризуемость), чем атом кислорода.
Механизм:
десь
атом серы более сильный нуклеофил
(бо’льший радиус – бо’льшая
поляризуемость), чем атом кислорода.
Механизм:
Продукт выпадает в осадок, что позволяет очищать эти соединения.
 В
слабощелочной среде реакция идет в
обратном направлении с выделением
исходного соединения:
В
слабощелочной среде реакция идет в
обратном направлении с выделением
исходного соединения:
14.8.1.3. Присоединение синильной кислоты.
 Синильная
кислота присоединяется к альдегидам и
пространственно незатрудненным
метилкетонам:
Синильная
кислота присоединяется к альдегидам и
пространственно незатрудненным
метилкетонам:
С инильная
кислота очень слабая, поэтому реакция
катализируется основанием (В),
освобождающим активный цианид-анион:
инильная
кислота очень слабая, поэтому реакция
катализируется основанием (В),
освобождающим активный цианид-анион:
Ввиду сильной токсичности НСN циангидрины получают, добавляя минеральную кислоту в смесь карбонильного соединения с водным раствором цианида натрия. Кислоту добавляют, чтобы сдвинуть равновесный процесс образования циангидрина (механизм АN + AE) в сторону конечного продукта.
14.8.1.4. Реакции с магнийорганическими соединениями (рассмотрено
в методах получения спиртов).
14.8.1.5. Присоединение спиртов.
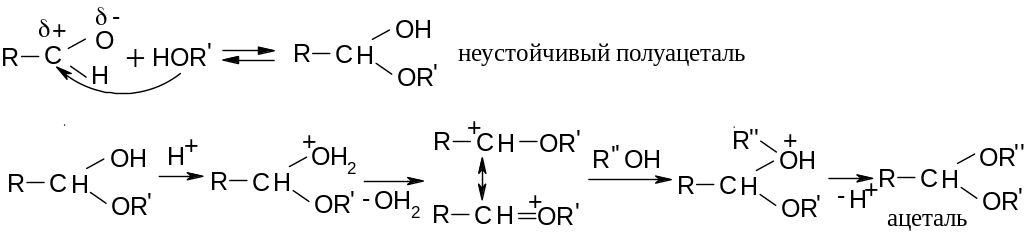 Эта
реакция напоминает реакцию присоединения
воды. Она катализируется кислотами и
основаниями:
Эта
реакция напоминает реакцию присоединения
воды. Она катализируется кислотами и
основаниями:
 Ацетон
образует кеталь:
Ацетон
образует кеталь:
Ацетали и кетали устойчивы в щелочной среде, но не устойчивы в кислой, где гидролизуются до исходных реагентов.
14.8.2. Реакции присоединения – отщепления.
14.8.2.1. Взаимодействие с аммиаком.
 Механизм
реакции с альдегидами:
Механизм
реакции с альдегидами:
 Альдимины
неустойчивы и тримеризуются до циклических
продуктов. Своеобразной реакцией
формальдегида с аммиаком является
образование уротропина:
Альдимины
неустойчивы и тримеризуются до циклических
продуктов. Своеобразной реакцией
формальдегида с аммиаком является
образование уротропина:
14.8.2.2. Взаимодействие с гидроксиламином.
Продуктами реакции карбонилсодержащих соединений с гидроксиламином являются оксимы. Схема реакции:
И
 з
ацетона образуется кетоксим (ацетоноксим):
з
ацетона образуется кетоксим (ацетоноксим):
 14.8.2.3.
Взаимодействие с гидразином и его
производными.
14.8.2.3.
Взаимодействие с гидразином и его
производными.
Аналогично гидразину с альдегидами и кетонами реагируют фенилгидразин С6Н5NHNH2 и семикарбазид H2NCONHNH2 , образуя фенилгидразоны RCH=NNHС6Н5 и семикарбазоны RCH=NNHСОNH2. Эти вещества являются кристаллическими, легко выделяются и легко определяются по температуре плавления, поэтому указанные реакции используются для идентификации альдегидов и кетонов.
Лекция № 15.
СВОЙСТВА ОКСОСОЕДИНЕНИЙ
15.1. Реакции окисления.
Альдегиды легко окисляются различными окислителями до карбоновых кислот. Качественные реакции на альдегидную группу:
а) с гидроксидом меди:
СН3СОН + 2Cu(OH)2 СН3СОOН + Cu2O + 2H2O.
В результате реакции выпадает красный осадок.
б) реакция серебряного зеркала:
СН3СОН + 2Ag(NH3)2OH СН3СОONH4+ + 2Ag + 3NH3 + H2O.
 Кетоны
окисляются намного труднее и в приведенные
выше реакции не вступают. Однако, как и
всю органику, их можно окислить, но при
этом происходит разрыв углерод-углеродной
цепи у карбонильной группы с образованием
соответствующих 4-х карбоновых кислот
по схеме:
Кетоны
окисляются намного труднее и в приведенные
выше реакции не вступают. Однако, как и
всю органику, их можно окислить, но при
этом происходит разрыв углерод-углеродной
цепи у карбонильной группы с образованием
соответствующих 4-х карбоновых кислот
по схеме:
