
- •12.2. Галогенпроизводные углеводородов.
- •12.3. Нуклеофильное замещение.
- •12.4. Побочные реакции при sn1-замещении.
- •12.5. Реакции отщепления.
- •13.1. Введение.
- •14.1. Гликоли.
- •1 4.2. Двухатомные фенолы.
- •14.3. Трехатомные спирты. Глицерин.
- •14.4. Простые эфиры.
- •14.5. Строение и номенклатура оксосоединений.
- •14.6. Методы синтеза оксосоединений.
- •14.7. Строение карбонильной группы.
- •14.8. Химические свойства оксосоединений.
- •15.1. Реакции окисления.
- •15.2. Реакции замещения водорода в -положении по отношению к
- •15.3. Реакции конденсации.
- •15.4. Реакции замещения кислорода на галогены.
- •1 5.5. Реакции восстановления.
- •15.6. Реакции полимеризации.
- •15.7. Дикарбонильные соединения.
- •16.1 Введение.
- •16.2. Монокарбоновые насыщенные кислоты.
- •16.3. Ассоциация карбоновых кислот.
- •16.3. Строение карбоксильной группы.
- •16.4. Химические свойства.
- •16.5. Ненасыщенные карбоновые кислоты.
- •17.1. Классификация, номенклатура, изомерия.
- •17.2. Методы синтеза.
- •17.3. Химические свойства.
- •18.1. Нитросоединения.
- •18.2. Амины.
- •19.1. Свойства ароматических аминов.
- •19.2. Диамины.
- •19.3. Ароматические диазосоединения.
- •19.4. Алифатические диазосоединения.
- •20.1.Введение.
- •20.2. Производные непереходных элементов.
- •20.3. Эос переходных элементов.
- •20.4. Общие методы синтеза.
- •20.5. Серусодержашие соединения.
- •20.6. Фосфорорганические соединения.
14.1. Гликоли.
14.1.1. Номенклатура.
 Это
двухатомные спирты. По радикально-функциональной
номенклатуре к названию алкена
соответствующей длины добавляется
окончание «гликоль», они делятся на -,
-,
-
и т- и т.д. гликоли:
Это
двухатомные спирты. По радикально-функциональной
номенклатуре к названию алкена
соответствующей длины добавляется
окончание «гликоль», они делятся на -,
-,
-
и т- и т.д. гликоли:
-пропиленгликоль -пропиленгликоль
пропандиол-1,2 пропандиол-1,3
14.1.2. Получение.
13.1.2.1. Гидролиз дигалогенпроизводных.
C lCH2CH2Cl + 2 H2O 2 HCl + HOCH2CH2OH (этиленгликоль).
14.1.2.2. Окисление алкенов по реакции Вагнера (уже давал).
14.1.3. Химические свойства.
13.1.3.1. Кислотные свойства.
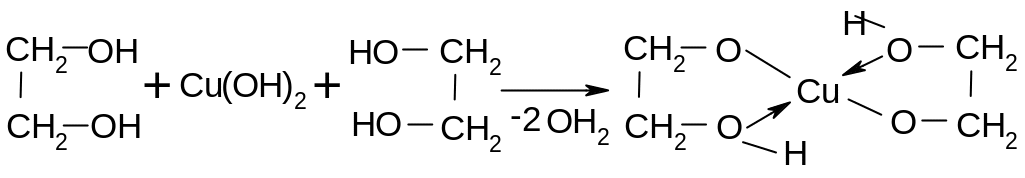 Соседняя
НО- группа проявляет І
эффект, вследствие чего -гликоли
кислее воды, реагируют со щелочами,
образуя гликоляты. С гидроксидом меди
гликоли образуют комплексные соединения
– клешневидные хелаты (раствор синего
цвета):
Соседняя
НО- группа проявляет І
эффект, вследствие чего -гликоли
кислее воды, реагируют со щелочами,
образуя гликоляты. С гидроксидом меди
гликоли образуют комплексные соединения
– клешневидные хелаты (раствор синего
цвета):
14.1.3.2. Дегидратация.
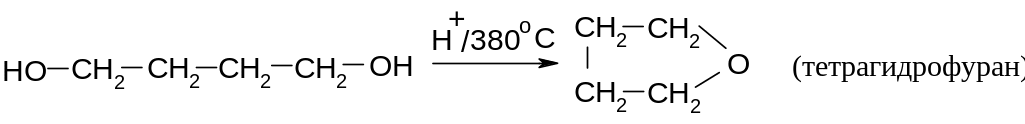 14.1.3.2.1.
Внутримолекулярная дегидратация.
14.1.3.2.1.
Внутримолекулярная дегидратация.
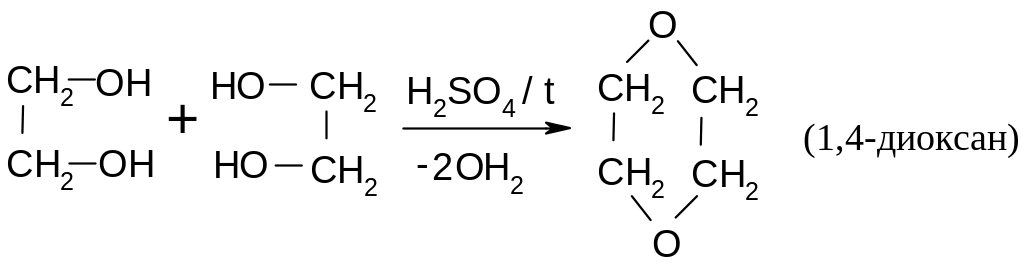
14.1.3.2.. Межмолекулярная дегидратация.
14.1.3.3. Реакции окисления.
1 4.2. Двухатомные фенолы.
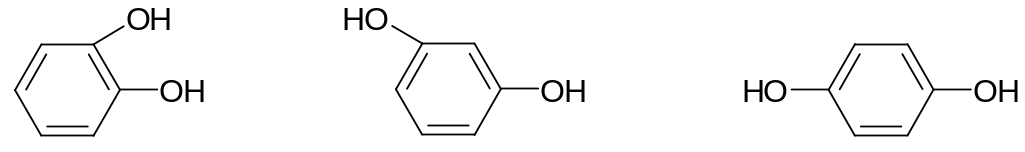 14.2.1.
Номенклатура.
14.2.1.
Номенклатура.
Пирокатехин резорцин гидрохинон
1,2-дигидроксибензен 1,3-дигидроксибензен 1,4-дигидроксибензен
14.2.2. Химические свойства.
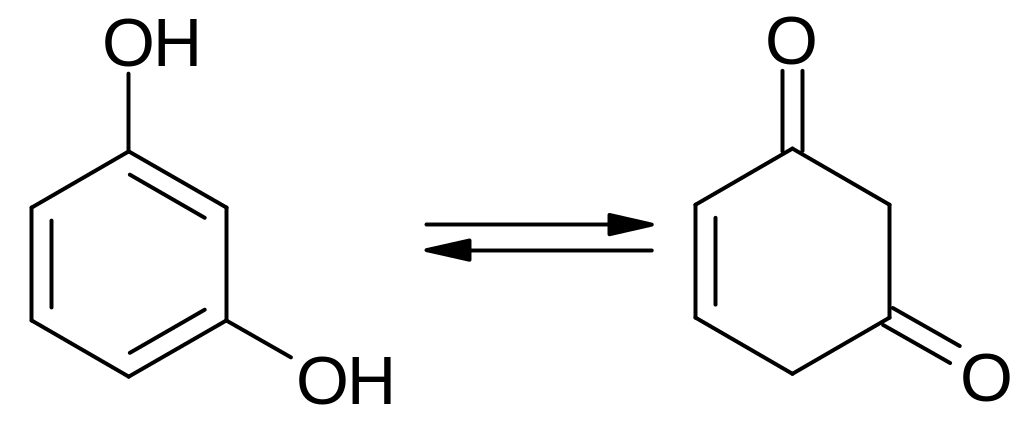 Взаимное
влияние гидроксильных групп в двухатомных
фенолах усиливает их кислотность.
Ароматический характер двухатомных
фенолов ниже, чем фенола, поэтому для
резорцина имеет место кето-енольная
таутомерия:
Взаимное
влияние гидроксильных групп в двухатомных
фенолах усиливает их кислотность.
Ароматический характер двухатомных
фенолов ниже, чем фенола, поэтому для
резорцина имеет место кето-енольная
таутомерия:
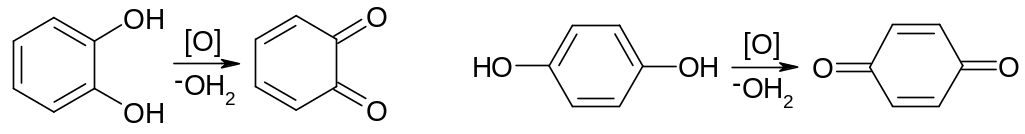 Пирокатехин
и гидрохинон легко окисляются, поэтому
их применяют как восстановители в
фотографии:
Пирокатехин
и гидрохинон легко окисляются, поэтому
их применяют как восстановители в
фотографии:
о-бензохинон п-бензохинон
14.3. Трехатомные спирты. Глицерин.
14.3.1. Синтез глицерина.
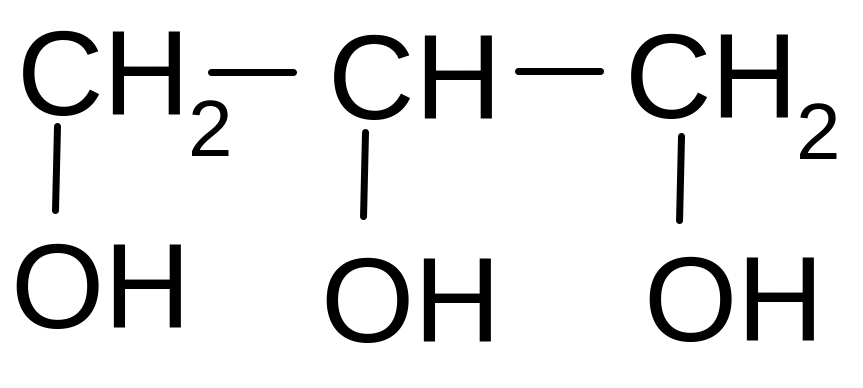 Наиболее
распространен трехатомный спирт
глицерин:
Наиболее
распространен трехатомный спирт
глицерин:
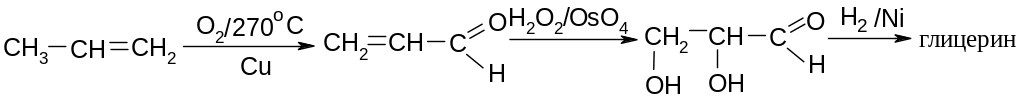 Глицерин
входит в состав жиров и образуется при
их омылении. Имеется много методов его
синтеза, наиболее перспективный –
получение из пропилена:
Глицерин
входит в состав жиров и образуется при
их омылении. Имеется много методов его
синтеза, наиболее перспективный –
получение из пропилена:
14.3.2. Химические свойства глицерина.
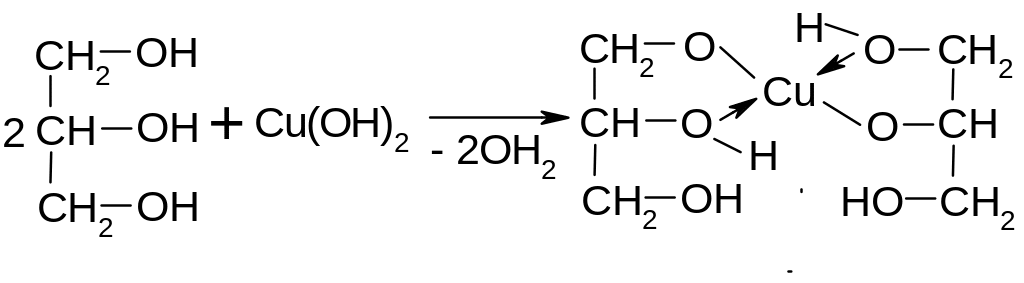 Вследствие
взаимного влияния гидроксилов глицерин
с гидроксидом меди образует глицерат
меди (раствор синего цвета):
Вследствие
взаимного влияния гидроксилов глицерин
с гидроксидом меди образует глицерат
меди (раствор синего цвета):
Г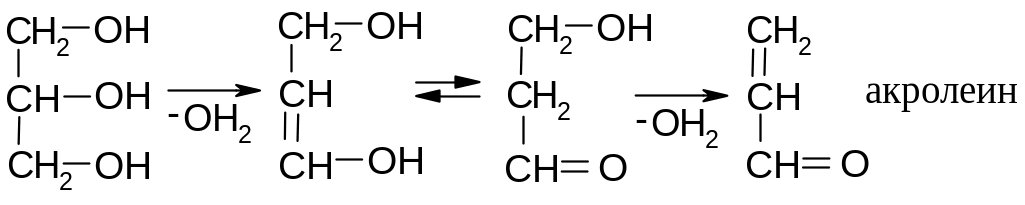 лицерин
имеет свойства обычных спиртов: образует
сложные эфиры, в том числе и жиры, вступает
в реакции окисления и дегидратации:
лицерин
имеет свойства обычных спиртов: образует
сложные эфиры, в том числе и жиры, вступает
в реакции окисления и дегидратации:
14.4. Простые эфиры.
14.4.1. Строение и номенклатура.
Простые эфиры имеют общую формулу ROR’, где R могут быть одинаковыми или разными (смешанные эфиры). Примеры:
З аместительная
метоксиметан метоксиэтан
2-метоксибутан
аместительная
метоксиметан метоксиэтан
2-метоксибутан
Радикально- диметиловый метилэтиловый втор-бутилметиловый
Функциональная эфир эфир эфир
14.4.2. Получение смешанных эфиров.
Реакция Вильямсона:
 СН3ОNa
+ ICH2CH3
CH3OCH2CH3
СН3ОNa
+ ICH2CH3
CH3OCH2CH3
- NaI
14.4.3. Cвойства простых эфиров.
Это довольно инертные химические соединения, они не взаимодействуют со щелочами и слабыми кислотами, но расщепляются сильными кислотами HI, HBr и H2SO4:
СH3OCH3 + HI CH3I + CH3OH .
П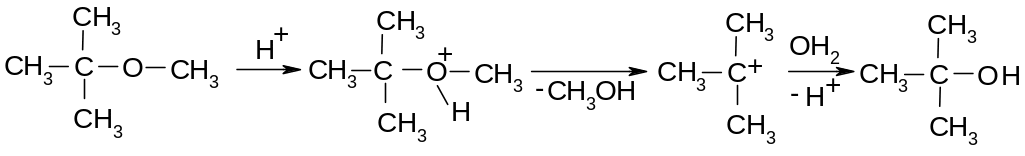 ервичные
эфиры расщепляются по SN2-механизму,
третичные – по SN1:
ервичные
эфиры расщепляются по SN2-механизму,
третичные – по SN1:
14.4.4. Циклические простые эфиры.
Вы уже знакомы с циклическими простыми эфирами: тетрагидрофураном и диоксаном. Существует очень интересный класс соединений, которые называют краун-эфирами. Пример синтеза:
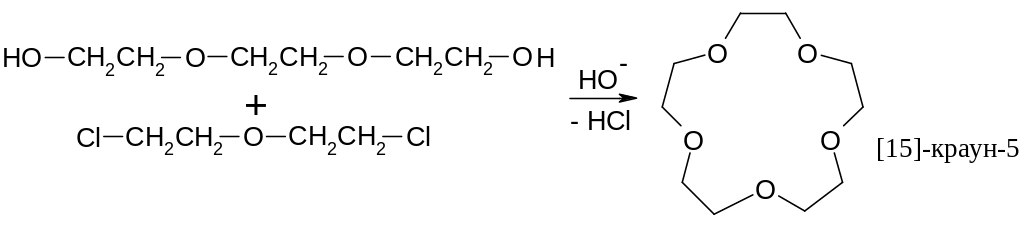
К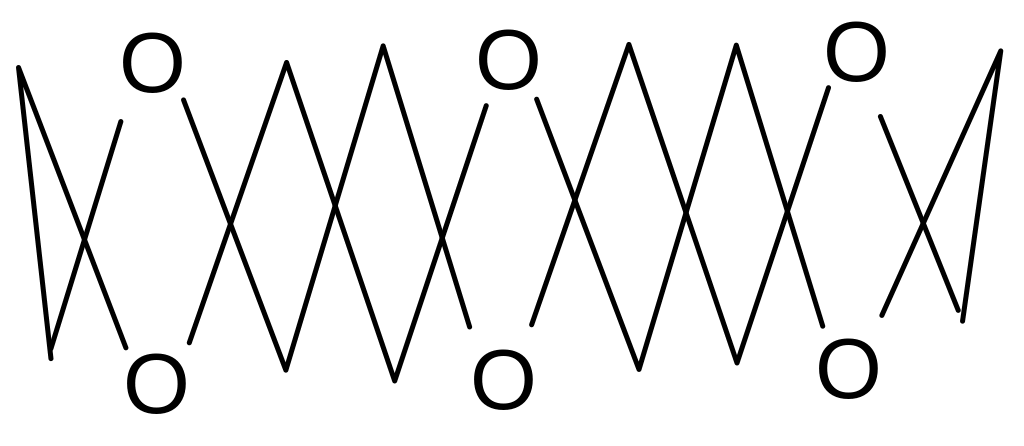 раун
(англ.) – корона, т.е. они имеют конформацию
короны. Пример такой конформации для
[18]-краун-6:
раун
(англ.) – корона, т.е. они имеют конформацию
короны. Пример такой конформации для
[18]-краун-6:
К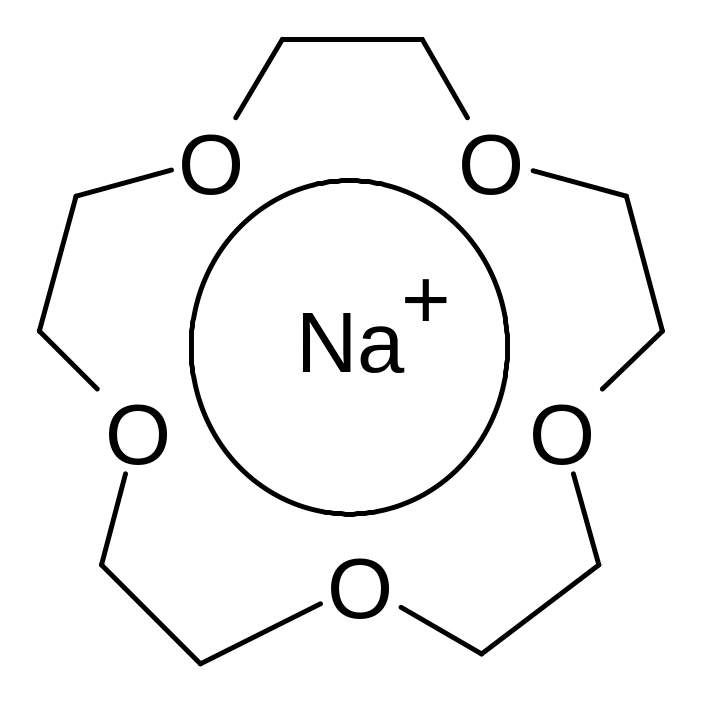 раун-эфиры
образуют стабильные комплексы с ионами
щелочных и щелочноземельных металлов
за счет донорно-акцепторных
связей между кислородом и ионом металла,
причем, внутренний диаметр короны должен
соответствовать диаметру иона. Так
[15]-краун-5 образует комплекс с катионом
натрия:
раун-эфиры
образуют стабильные комплексы с ионами
щелочных и щелочноземельных металлов
за счет донорно-акцепторных
связей между кислородом и ионом металла,
причем, внутренний диаметр короны должен
соответствовать диаметру иона. Так
[15]-краун-5 образует комплекс с катионом
натрия:
а [18]-краун-6 только с катионами калия. Благодаря образованию таких комплексов NaOH или KMnO4 cтановятся растворимыми в органических растворителях (бензол, толуол), что дает возможность проводить реакции в гомогенной среде.
. ОКСОСОЕДИНЕНИЯ (КАРБОНИЛСОДЕРЖАЩИЕ СОЕДИНЕНИЯ).
