
- •12.2. Галогенпроизводные углеводородов.
- •12.3. Нуклеофильное замещение.
- •12.4. Побочные реакции при sn1-замещении.
- •12.5. Реакции отщепления.
- •13.1. Введение.
- •14.1. Гликоли.
- •1 4.2. Двухатомные фенолы.
- •14.3. Трехатомные спирты. Глицерин.
- •14.4. Простые эфиры.
- •14.5. Строение и номенклатура оксосоединений.
- •14.6. Методы синтеза оксосоединений.
- •14.7. Строение карбонильной группы.
- •14.8. Химические свойства оксосоединений.
- •15.1. Реакции окисления.
- •15.2. Реакции замещения водорода в -положении по отношению к
- •15.3. Реакции конденсации.
- •15.4. Реакции замещения кислорода на галогены.
- •1 5.5. Реакции восстановления.
- •15.6. Реакции полимеризации.
- •15.7. Дикарбонильные соединения.
- •16.1 Введение.
- •16.2. Монокарбоновые насыщенные кислоты.
- •16.3. Ассоциация карбоновых кислот.
- •16.3. Строение карбоксильной группы.
- •16.4. Химические свойства.
- •16.5. Ненасыщенные карбоновые кислоты.
- •17.1. Классификация, номенклатура, изомерия.
- •17.2. Методы синтеза.
- •17.3. Химические свойства.
- •18.1. Нитросоединения.
- •18.2. Амины.
- •19.1. Свойства ароматических аминов.
- •19.2. Диамины.
- •19.3. Ароматические диазосоединения.
- •19.4. Алифатические диазосоединения.
- •20.1.Введение.
- •20.2. Производные непереходных элементов.
- •20.3. Эос переходных элементов.
- •20.4. Общие методы синтеза.
- •20.5. Серусодержашие соединения.
- •20.6. Фосфорорганические соединения.
18.1. Нитросоединения.
18.1.1. Классификация и номенклатура нитросоединений.
О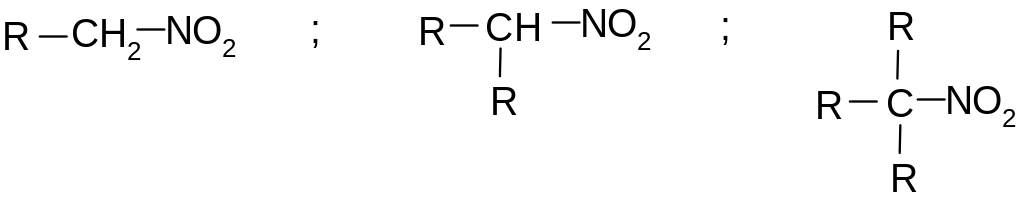 бщая
формула нитросоединений
RNO2,
они делятся в основном на два типа:
алифатические и ароматические.
Алифаимческие соединения в зависимости
от углерода, с которым связана нитрогруппа
, делятся на первичные, вторичные и
третичные:
бщая
формула нитросоединений
RNO2,
они делятся в основном на два типа:
алифатические и ароматические.
Алифаимческие соединения в зависимости
от углерода, с которым связана нитрогруппа
, делятся на первичные, вторичные и
третичные:
Принципы номенклатуры уже освещались в лекции № 3.
18.1.2. Методы получения.
Из всех методов получения уместно упомянуть только реакции нитрования алканов (реакция Коновалова) и аренов (лекции № 10 и 11).
18.1.3. Строение нитрогруппы. Полярность нитросоединений.
Н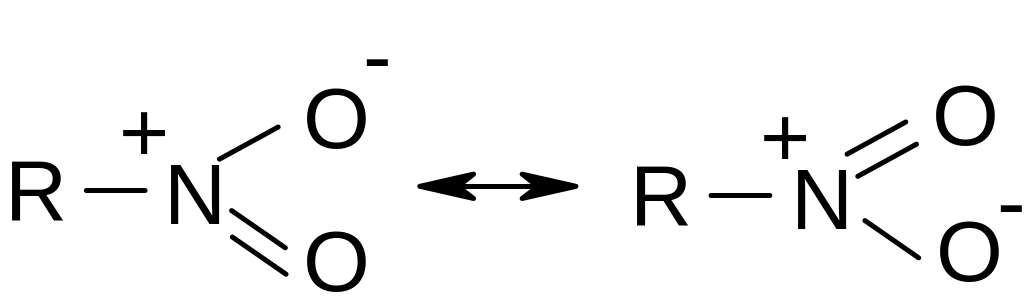 итрогруппа
имеет семиполярную связь, ее строение
можно описать двумя резонансными
структурами:
итрогруппа
имеет семиполярную связь, ее строение
можно описать двумя резонансными
структурами:
Нитросоединения сильно полярны, ибо содержат сильно полярную электроноакцепторную нитрогруппу.
18.1.4. Свойства нитросоединений.
18.1.4.1. Реакции восстановления.
Используются различные восстановители: H2/Pt, HCl + Zn, HCl + Fe, и т.д. Зинин впервые восстановил нитробензол сероводородом:
50oC
C6H5NO2 + 3H2S C6H5NH2 + 2H2O + 3S.
При восстановлении в кислой и щелочной средах образуется ряд разных промежуточных продуктов, но конечным продуктом восстановления всегда является амин. Студентам, интересующимся проблемами синтеза промежуточных продуктов восстановления, рекомендуется смотреть учебники и соответствующую литературу.
18.1.4.2. Реакции алифатических нитросоединений со щелочами.
Гиперконьюгация СН связей с нитрогруппой обуславливает подвижность водорода (кислотность СН связей) в -положении к нитрогруппе (и только в щелочной среде), что позволяет первичным и вторичным нитросоединениям реагировать со щелочами с образованием солей нитроновых кислот:
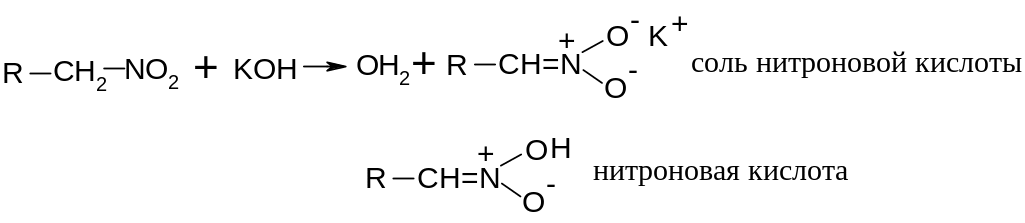 Первичные
и вторичные нитросоединения называют
псевдокислотами, ибо они не диссоциируют
на анионы и протон, а отщепляют протон
только под действием НО.
Третичные нитросоединения со щелочами
не реагируют, ибо не имеют кислого
водорода в -положении
к нитрогруппе.
Первичные
и вторичные нитросоединения называют
псевдокислотами, ибо они не диссоциируют
на анионы и протон, а отщепляют протон
только под действием НО.
Третичные нитросоединения со щелочами
не реагируют, ибо не имеют кислого
водорода в -положении
к нитрогруппе.
18.1.4.3. Гидролиз солей нитроновых кислот.
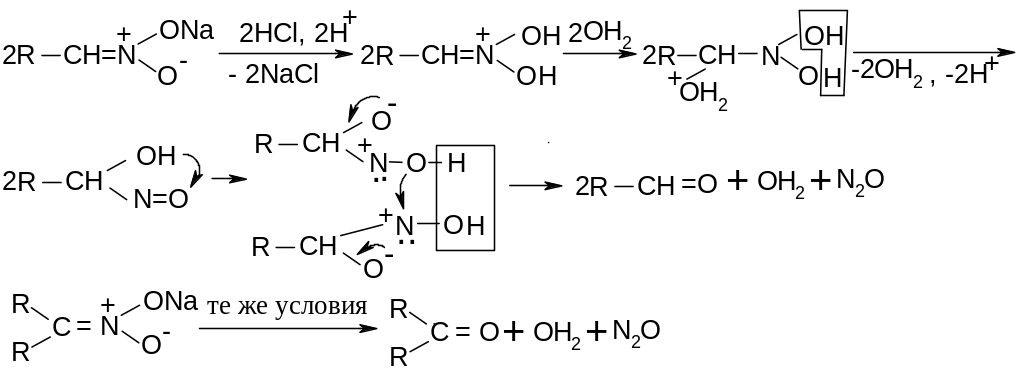 Сами
нитроновые кислоты в свободном состоянии
не существуют. Поэтому при действии
разбавленных сильных кислот из первичных
нитроновых солей образуются альдегиды,
из вторичных – кетоны:
Сами
нитроновые кислоты в свободном состоянии
не существуют. Поэтому при действии
разбавленных сильных кислот из первичных
нитроновых солей образуются альдегиды,
из вторичных – кетоны:
18.1.4.4. Реакции алифатических нитросоединений с азотистой кислотой.
Первичные и вторичные нитросоединения реагируют с азотистой кислотой по разному. В случае первичных соединений образуется соль красного цвета:
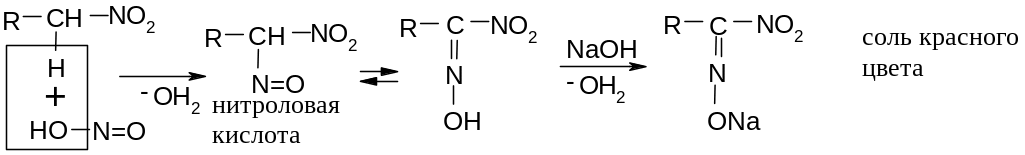
В случае вторичных соединений образуется псевдонитрол синего цвета:
 Третичные
нитросоединения с азотистой кислотой
не реагируют.
Третичные
нитросоединения с азотистой кислотой
не реагируют.
Первичные и вторичные нитросоединения вступают в реакции конденсации с альдегидами и кетонами в качестве метиленовой компоненты.
18.1.4.5. Реакции первичных алифатических нитросоединений с
концентрированной Н2SO4.
В качестве примера такой реакции можно
привести процесс превращения нитроэтана
в гидроксиламин и уксусную кислоту в
концентрированной Н2SO4
(80 – 90 %) по схеме:
качестве примера такой реакции можно
привести процесс превращения нитроэтана
в гидроксиламин и уксусную кислоту в
концентрированной Н2SO4
(80 – 90 %) по схеме:
Этим способом в промышленности получают гидроксиламин из нитрометана.
18.1.4.6. Реакции нуклеофильного замещения с участием
нитропроизводных бензола.
 Как
известно, нитро группа уменьшает
способность бензольного кольца к
реакциям электрофильного замещения,
но в то же время увеличивают его активность
к реакциям нуклеофильного замещения.
Легко эти реакции идут для тринитропроизводных.
Пример:
Как
известно, нитро группа уменьшает
способность бензольного кольца к
реакциям электрофильного замещения,
но в то же время увеличивают его активность
к реакциям нуклеофильного замещения.
Легко эти реакции идут для тринитропроизводных.
Пример:
Э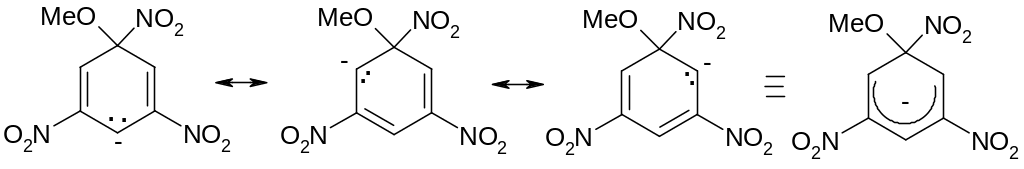 ти
реакции, как и в случае электрофильного
замещения, происходят с образованием
-комплексов, которые
в этом случае называют комплексами
Мейзенгеймера:
ти
реакции, как и в случае электрофильного
замещения, происходят с образованием
-комплексов, которые
в этом случае называют комплексами
Мейзенгеймера:
Возможно замещение и атома водорода на нуклеофил, только в этом случае водород должен отщепляться в виде нуклеофила, т.е. Н: (гидрид-анион), для этого в смеси должен присутствовать окислитель, например, гексацианоферат калия К3Fe(CN)6 (красная кровяная соль):
Пикриновая
кислота (2,4,6-тринитрофенол, техническое
название мелинит, шимоза) – бризантное
(дробящее) взрывчатое вещество. В виду
опасности при производстве вытеснена
веществами типа тола (тринитротолуола).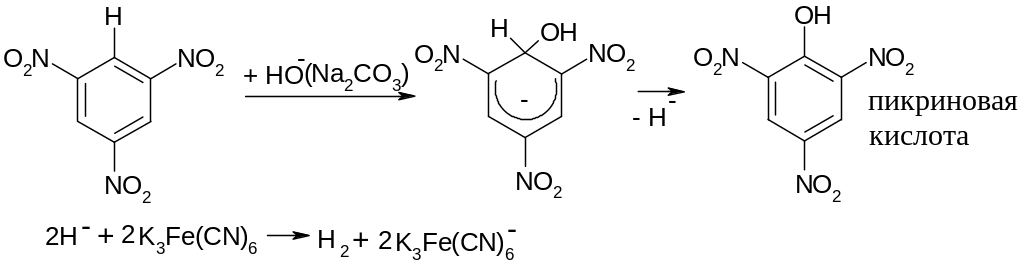
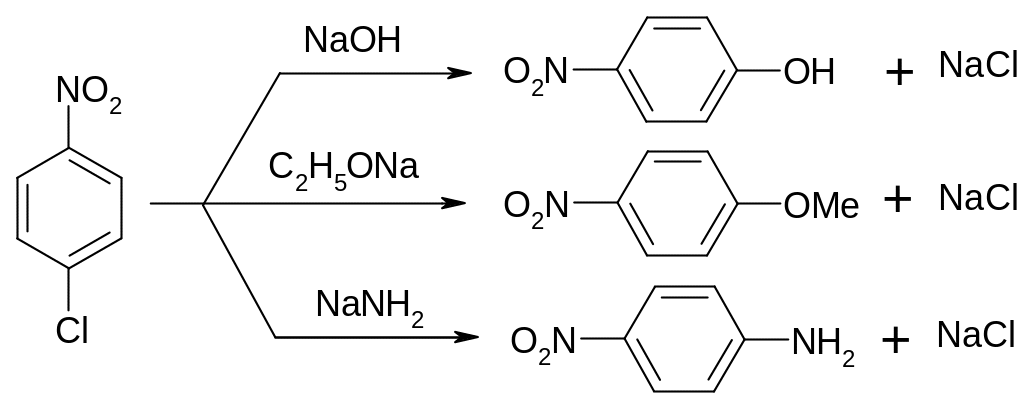 Важную
роль в органическом синтезе играют
реакции нуклеофильного замещения
галогена в тех соединениях, которые
содержат по крайней мере одну нитрогруппу
в о- или п-положениях. Пример:
Важную
роль в органическом синтезе играют
реакции нуклеофильного замещения
галогена в тех соединениях, которые
содержат по крайней мере одну нитрогруппу
в о- или п-положениях. Пример:
 Увеличение
количества нитрогрупп содействует
нуклеофильному замещению, например,
пикрилхлорид медленно гидролизуется
водой уже при комнатной температуре:
Увеличение
количества нитрогрупп содействует
нуклеофильному замещению, например,
пикрилхлорид медленно гидролизуется
водой уже при комнатной температуре:
