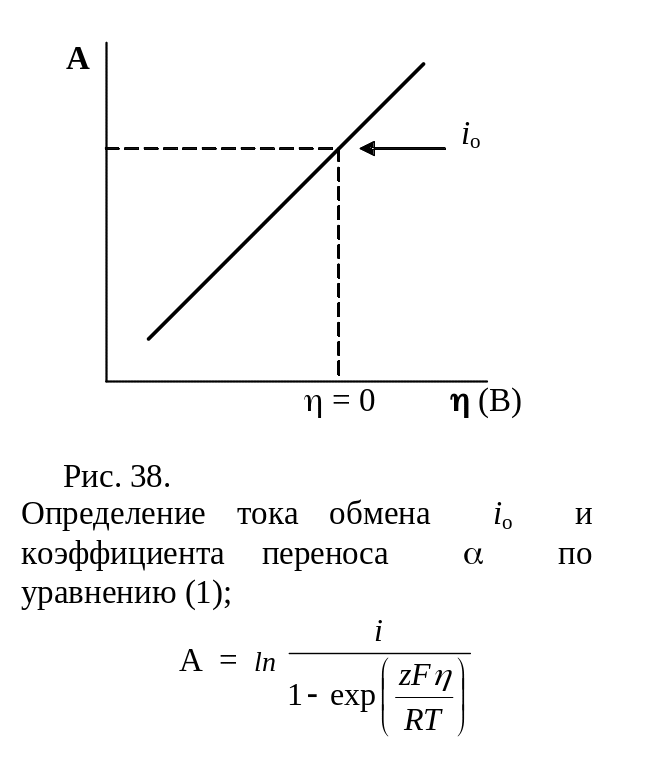- •Теория электрохимического перенапряжения, учитывающая структуру двойного электрического слоя
- •Влияние состава раствора на перенапряжение.
- •Закономерности перенапряжения выделения водорода
- •1. Влияние плотности тока
- •2. Влияние природы металла
- •3. Влияние природы и состава раствора
- •4. Влияние температуры и некоторых других факторов
- •Теория замедленной рекомбинации
- •Теория замедленной электрохимической десорбции
- •Ток обмена и коэффициент переноса
- •Порядок электрохимической реакции и стехиометрическое число
- •Механизм элементарного акта. Безбарьерный и безактивационный разряд
Ток обмена и коэффициент переноса
Наиболее важными характеристиками электрохимического перенапряжения следует считать ток обмена io и коэффициент переноса . При одном и том же отклонении потенциала электрода от равновесного значения скорость реакции (результативная плотность тока) будет тем больше, чем выше ток обмена, который, в свою очередь, зависит от природы электрохимической реакции, материала электрода и состава раствора. Коэффициент переноса характеризует степень влияния электрического поля электрода на энергию активации электрохимической стадии и определяет также симметрию катодного и анодного процессов. Для данной электрохимической реакции коэффициент переноса сравнительно мало изменяется при переходе от одного электродного материала к другому, чаще всего величина близка к 0,5.
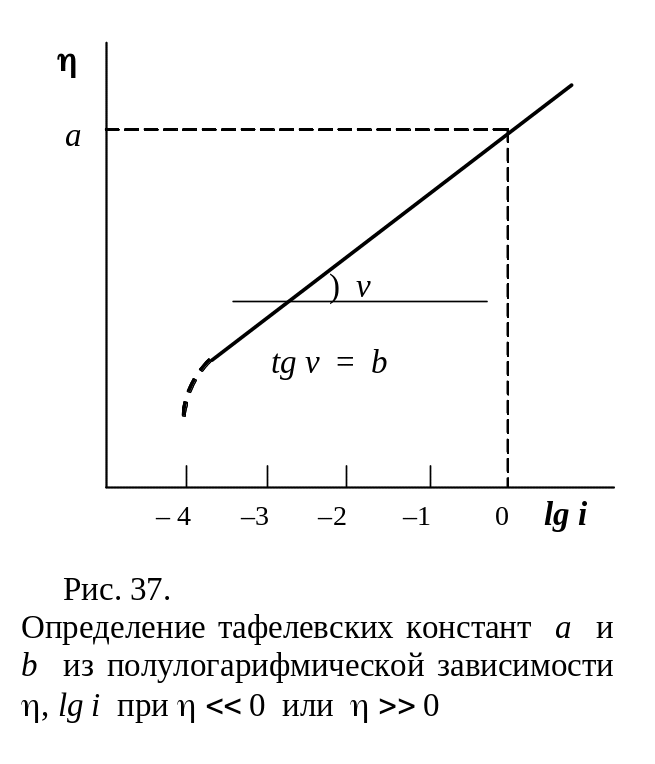
Величины io и для одностадийного электрохимического акта можно найти графически, используя зависимость , lg i (в области значительной катодной либо анодной поляризации):
|
|
Наклон b
прямой
– lg i
(рис. 37) равен 2,3
![]() и, следовательно,
и, следовательно,
= 2,3
![]() .
.
Ток обмена io может быть определен по величине перенапряжения = а при lg i = 0, то есть при единичной плотности тока:
io
=
![]() = 10 – a/b
.
= 10 – a/b
.
Порядок электрохимической реакции и стехиометрическое число
Двумя другими важными характеристиками электрохимических реакций являются их порядок и стехиометрическое число. Порядок электрохимической реакции имеет здесь тот же физический смысл, что и в учении о кинетике химических реакций, хотя в этом случае , кроме обычных параметров – давления и температуры, может быть функцией потенциала электрода. Порядок электрохимической реакции по отношению к какому-либо виду частиц i можно найти на основании изучения зависимости плотности тока от концентрации частиц данного вида при условии постоянства концентрации всех остальных видов частиц, а также температуры, давления и потенциала электрода:
![]() = i
.
= i
.
При этом для нахождения порядка катодной реакции необходимо располагать кинетическими данными в той области потенциалов, в которой можно пренебречь скоростью обратной реакции, то есть при 0; для нахождения порядка анодной реакции – соответственно данными в той области потенциалов, где можно пренебречь скоростью прямой реакции, то есть при 0.
Стехиометрическое число , по Гориучи (1948), предложившему это понятие, показывает, сколько раз должен совершиться элементарный акт, определяющий скорость суммарной электродной реакции для того, чтобы образовался её конечный продукт. Таким образом, если общий заряд, переносимый в ходе электродной реакции, равен n, то за один элементарный акт, отвечающий данной замедленной стадии, будет перенесён заряд, равный величине n. При малых отклонениях от равновесия для любой стадии, прямое и обратное течение которой связано с экспоненциальным множителем, содержащим энергию активации, справедливо уравнение типа:
i
= – io
![]() .
.
Если стехиометрическое число равно , уравнение должно быть переписано в виде
i
= – io
![]()
или, после решения относительно ,
= – io
![]() = – io
= – io
![]() .
.
Для определения стехиометрического числа по вышеприведенному уравнению необходимо проводить измерения перенапряжения вблизи равновесного потенциала данной реакции.