- •Теория электрохимического перенапряжения, учитывающая структуру двойного электрического слоя
- •Влияние состава раствора на перенапряжение.
- •Закономерности перенапряжения выделения водорода
- •1. Влияние плотности тока
- •2. Влияние природы металла
- •3. Влияние природы и состава раствора
- •4. Влияние температуры и некоторых других факторов
- •Теория замедленной рекомбинации
- •Теория замедленной электрохимической десорбции
- •Ток обмена и коэффициент переноса
- •Порядок электрохимической реакции и стехиометрическое число
- •Механизм элементарного акта. Безбарьерный и безактивационный разряд
3. Влияние природы и состава раствора
а) Влияние растворителя. Наибольшее число исследований по перенапряжению водорода выполнено с водными растворами. Для ртути и для некоторых др. металлов были получены данные также и в неводных растворах кислот. Характер изменения с изменением растворителя точно не установлен. Перенапряжение выделения водорода на ртути из раствора HCl в этиловом и метиловом спиртах ниже, чем из водных растворов; для Cu и Ni в спиртовых растворах оно выше, чем в водных. Для металлов с низким природа растворителя играет меньшую роль.
б) Влияние рН раствора на перенапряжение водорода с наибольшей полнотой изучено на ртути. Установлено, что в растворах чистых кислот в области концентраций до 0,1н не является функцией рН; при более высоких концентрациях зависит от рН, уменьшаясь с увеличением концентрации кислоты, причем /рН составляет примерно 60 мВ. Если растворы кроме кислоты содержат также избыток постороннего электролита, то подобное изменение с рН
|
наблюдается и для концентраций кислоты, меньших 0,1н. При избытке постороннего электролита такой ход с рН наблюдается и для разбавленных растворов щелочей. Т.о., максимальное перенапряжение водорода соответствует нейтральным растворам и линейно уменьшается с отклонением рН в ту или иную сторону от точки нейтральности. В концентрированных растворах кислот и оснований соотношение между и составом раствора становится более сложным. |
Зависимость перенапряжения выделения водорода от рН в растворах с постоянной ионной силой; i = const. |
Для других металлов: на Ni изменяется с рН незначительно и не подчиняется простой линейной зависимости; на Pb и Pt оно почти не зависит от рН раствора.
в) водорода очень чувствительно к присутствию в электролите посторонних веществ. Добавки солей к разбавленным растворам кислот увеличивают на ртути, причем увеличение концентрации 1-1 зарядного электролита в 10 раз (при постоянном рН) повышает примерно на 55–58 мВ. Первоначальная добавка электролита с поливалентным катионом оказывает большее действие, чем такая же добавка 1-1 зарядного электролита. Поверхностно-активные вещества (анионы, катионы и молекулярные вещества) или повышают, или понижают на ртути, в зависимости от их природы. ПАВ сильнее всего влияют на величину в области малых плотностей тока; действие этих добавок ослабляется с ростом плотности тока и при высоких ее значениях полностью исчезает. На Pt, Fe и Ni также возрастает при введении ПАВ; характер влияния ПАВ на и на этих металлах является функцией потенциала электрода.
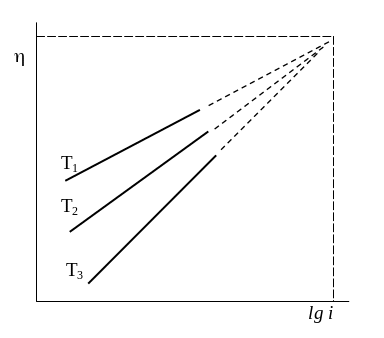
4. Влияние температуры и некоторых других факторов
водорода уменьшается с ростом Т, причем температурный коэффициент зависит не только от природы металла, но и от плотности тока, что находит отражение в соответствующих изменениях констант уравнения Тафеля. Т.к. константа b увеличивается, а константа а уменьшается с ростом Т, то температурный эффект больше выражен в области низких плотностей тока.
|
В среднем (d/dT)i составляет 1 – 4 мВ/К, причем нижний предел относится к металлам с малым перенапряжением, а верхний – к металлам с высоким перенапряжением. Если считать, что полулогарифмическая зависимость сохраняется неизменной до высоких плотностей тока, то, начиная с некоторого значения плотности тока, можно ожидать пересечения полулогарифмических прямых и изменения знака температурного коэффициента перенапряжения.
|
Рис. 13. Влияние температуры на перенапряжение выделения водорода: Т1 Т2 Т3 . |
Зависимость от давления водорода почти не изучена. Есть данные, что на ртути и гладкой платине несколько уменьшается при повышении давления.
На водорода на металлах железной и платиновой групп влияют ультразвуковые колебания. изменяется под действием светового облучения и потока радиоактивных частиц.
Возможные стадии и пути протекания процесса катодного выделения водорода. Природа водородного перенапряжения на различных металлах
Электрохимические реакции являются сложными процессами с последовательными стадиями, и малая скорость любой из них приводит к нарушению равновесия и появлению перенапряжения. Разряд ионов гидроксония, приводящий к выделению молекулярного водорода, несмотря на простоту суммарного выражения процесса, является сложной электродной реакцией. Рассмотрим стадии этого процесса.
1. Диффузионная стадия. Электрохимический процесс протекает на электроде, поэтому необходима доставка ионов Н3О+ к поверхности, что осуществляется за счет переноса ионов и их диффузии. Отметим, что в данном случае эта стадия протекает без существенного торможения. Исключение составляют кислые растворы с высоким значением рН, то есть с очень малой концентрацией разряжающихся ионов гидроксония; в этих растворах при высоких плотностях тока наблюдается предельный ток диффузионного происхождения, который затем сменяется (при значительных отрицательных потенциалах) новым тафелевским участком (линейный рост lg i с ростом потенциала), но разряжаюися при этом уже не ионы гидроксония, а молекулы воды.
2. Стадия разряда протона с образованием адсорбированных атомов водорода (собственно электрохимический процесс):
Н3О+ + е = Надс + Н2О .
3. Для стационарного протекания электролиза необходимо поддерживать постоянной поверхностную концентрацию атомов водорода, то есть обеспечивать их непрерывный отвод с поверхности катода. Атомы водорода могут удаляться тремя путями: каталитической рекомбинацией, электрохимической десорбцией и эмиссией. При каталитическом механизме отвод атомов водорода происходит за счет их рекомбинации в молекулы с одновременной десорбцией:
Надс + Надс = Н2 (раствор) ,
причем роль катализатора выполняет металл электрода. При электрохимической десорбции удаление атомов водорода с поверхности электрода происходит в результате разряда ионов гидроксония на уже адсорбированных атомах:
Н3О+ + Надс + е = Н2О + Н2 (раствор) .
При эмиссионном механизме адсорбированные атомы водорода испаряются с поверхности электрода в виде свободных атомов
Надс = Н
с их последующей объемной рекомбинацией в молекулы водорода.
4. Молекулярный водород, образующийся из адсорбированного атомарного водорода, должен удаляться от границы раздела электрод – электролит в газовую фазу (в виде пузырьков газа) – стадия фазообразования. Обычно эта стадия суммарного процесса (так же, как и первая стадия) протекает без существенного торможения, но на металлах с высокоразвитой поверхностью и низким перенапряжением выделения водорода (например, губчатая платина) может стать лимитирующей.
Любая из этих четырёх стадий может определять скорость всего процесса электролитического образования водорода и быть причиной появления водородного перенапряжения. При электрохимическом выделении водорода удаление его адсорбированных атомов может совершаться несколькими способами. Если эта стадия является замедленной, то скорость всего процесса должна определяться скоростью наиболее эффективного из указанных выше трёх механизмов десорбции. Замедленная рекомбинация, например, означает, что каталитическое образование молекул водорода отличается большим торможением, чем разряд или стадия транспортировки, и в то же время совершается заметно быстрее, чем электрохимическая десорбция или эмиссия водородных атомов. При близких значениях констант скорости параллельных стадий удаление водорода может совершаться одновременно несколькими путями.
Механизм Фольмера – Тафеля отвечает тому случаю, когда замедленно протекает разряд, а отвод образовавшихся атомов водорода осуществляется их рекомбинацией. По механизму Фольмера – Гейровского, замедленной стадией по-прежнему будет разряд, но удаление атомов водорода происходит путём их электрохимической десорбции. По механизму Тафеля – Гориучи, рекомбинация водородных атомов определяет скорость всего процесса и в то же время обеспечивает отвод атомов водорода, образующихся в результате разряда, протекающего без торможений. В основе механизма Гейровского – Гориучи лежит предположение, что скорость определяется стадией электрохимической десорбции, являющейся одновременно наиболее эффективным способом удаления адсорбированного водорода. При диффузионном механизме все стадии протекают быстрее, чем удаление молекулярного водорода, растворённого в слое электролита, примыкающем к поверхности электрода. Кроме перечисленных возможны также и другие кинетические варианты катодного выделения водорода. Так, например, может оказаться, что константы скорости двух или большего числа стадий мало отличаются друг от друга. Тогда при изменении условий, в которых происходит реакция, один механизм может замениться другим. При неизменных условиях на одном и том же электроде вследствие неоднородности его поверхности могут существовать участки, где выделение водорода совершается разными путями.
Критерием правильности той или другой теории являются опытные факты, поэтому справедливость той или иной теории перенапряжения определяется возможностью с помощью этой теории объяснить формулу Тафеля. Однако все основные теории приводят при известных предположениях к формуле Тафеля. Действительный механизм катодного выделения водорода на каждом данном металле удается установить на основании всесторонних экспериментальных исследований и их сопоставления с выводами, вытекающими из теории возникновения различных видов перенапряжения.