
- •Глава 6. Давление диссоциации соединений, не растворимых в металле
- •Контрольные вопросы.
- •Глава 7. Давление дисооциации соединений, растворимых в металле
- •Контрольные вопросы
- •Коэффициенты для расчета проницаемости водорода через металл по уравнению:
- •Коэффициенты для расчета диффузии в твердых металлах по уравнению:
- •Растворимость водорода в металлах,образующих экзотермические растворы (760 мм. Рт.Ст):
Контрольные вопросы
1. Как записать константу равновесия реакции
,![]() если
соединение растворимо
в металле?
если
соединение растворимо
в металле?
2. Как принято записывать символ давления диссоциации соединения, растворенного в металле?
Почему допустимо принять активность .металла в растворе равной единице?
Чему равно давление диссоциации соединения, растворенного
в металле?
Как меняется давление диссоциации соединения, растворенного
в металле, в зависимости от активности этого соединения в растворе?
6.. Как рассчитать активность соединения в растворе, если известны мольные доли этого соединения в насыщенном растворе
и в данном растворе?
Как рассчитать активность соединений в растворе по величине молярной свободной энергии растворения?
8. Как рассчитать активность соединения в растворе через
мольную долю и коэффициент активности?
Как изменяется термодинамическая устойчивость соединения,
растворенного в металле, в зависимости от его концентрации
в растворе.
Пример расчета давления диссоциации соединения, растворенного в металле
Задача
Рассчитать давление диссоциации закиси железа, растворенной
в железе при температурах.1550°С, 1625°Cf 1675°С, 1725°С, если известно, что активность закиси железа a(FeO) при температуре 1540°С равна 0,135, а концентрация кислорода
в растворе описывается уравнением:

1. Переводим заданные температуры в градусы Кельвина
T1= 18I3°K;T2= 1823°К; T3=1898°К;T4=1948°К; T5=1998 К.
2. Рассчитываем концентрацию кислорода в железе при заданных температурах:

![]()

3. Рассчитываем мольную долю кислорода в железе в зависимости от температуры:


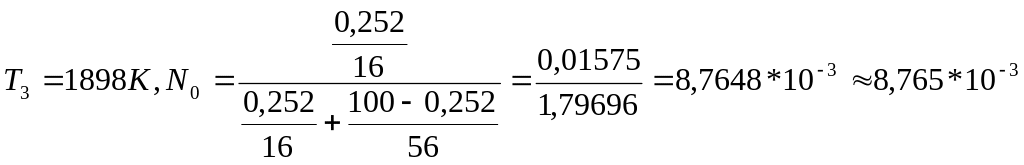


3. Рассчитываем коэффициент активности закиси железа по данным для температуры 1540°C (1813 К) и принимаем его постоянным для заданного в условии задачи интервале, температуры.
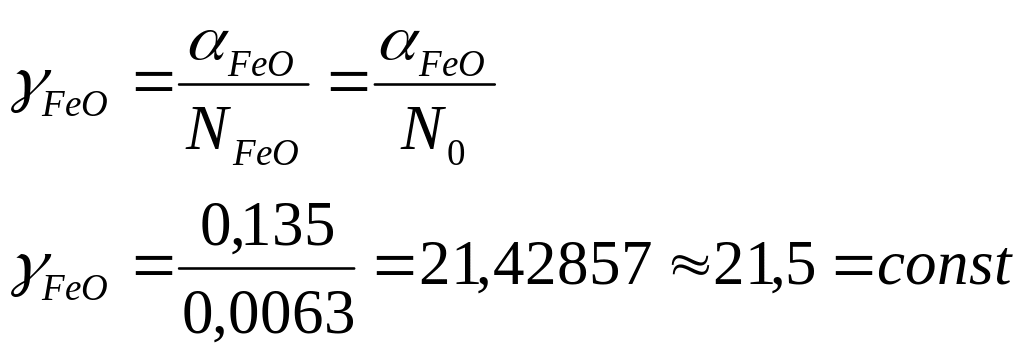
5. Определяем активность закиси железа в растворе при заданных температурах и концентрациях кислорода FeO=No; Feo
![]()
![]()

6. Расчет давления диссоциации закиси железа в свободном виде при заданных температурах:
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Из таблицы 6 приложения находим значения коэффициентов для расчёта изменения свободной энергии 1808-2000 К
A=-232870; B=0; C=45,34
![]()





7. Расчет давления диссоциации закиси железа, растворенной в железе:
![]()
![]()
![]()
![]()
![]()
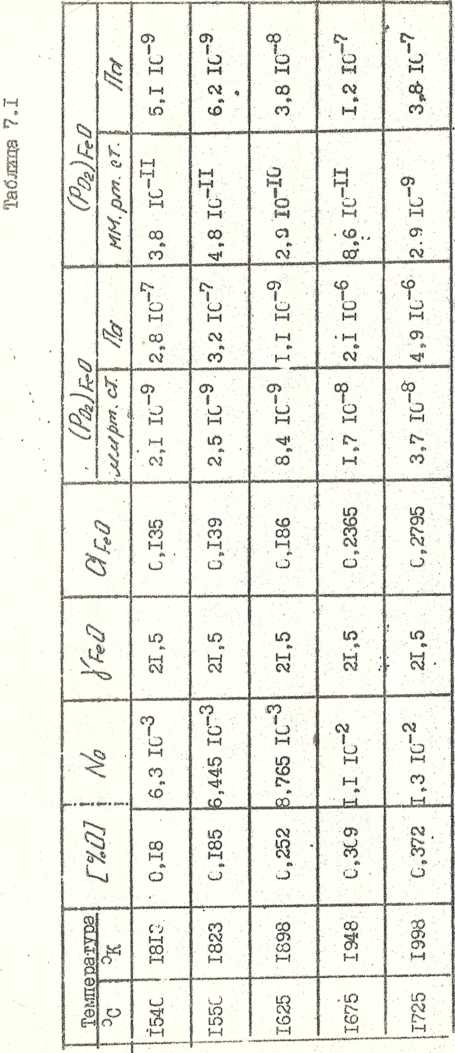
8. Полученные при расчёте данные сводим в общую таблицу 7.1.
9. Выводы: , .
1. С увеличением температуры увеличивается растворимость
кислорода в железе, растёт его мольная доля в растворе
и возрастает активность.
2. С увеличением температуры растёт давление диссоциации закиси железа в свободном виде.
3. Давление диссоциации закиси железа, растворенной в железе, меньше давления диссоциации её в свободном виде при тех же температурах. Следовательно, растворенная в железе закись железа обладает (при одних и тех же температурах) большей термодинамической устойчивостью по сравнению с закисью железа в свободном виде.
где СНА - действительное содержание водорода в конкретном случае.
Обычно да практике Ch*<Sh* т.к. растворимость водорода в металле , если это особо не оговорено, даётся в расчёте на = 760 мм рт.ст. В действительности же такое парциальное давление водорода в окружающей металл среде практически никогда не достигается.
Поэтому необходимо уметь рассчитывать содержание или растворимость ВОДОРОДА в конкретном металле. Поскольку растворимость водорода в твердых и жидких металлах в различной степени зависит от температуры, в таблицах приведены коэффициенты для жидкого и твердого состояния.
Взаимодействие Водорода с металлами
Взаимодействие Водорода с металлами
Водород является одним из менее активных газов по отно¬шению к металлам. Поэтому о большинством металлов водород образует растворы и только с ограниченным числом металлов вступает в химическое взаимодействие» сопровождающееся об¬разованием гидридов.. '
Абсорбция водорода металлом может протекать по двум схемам в зависимости от теплового эффекта. Поэтому растворы водорода в металлах принято разделять на эндотермические (атомные* разбавленные0 простые), образующиеся с поглощение11* тепла (д Н >0)> и экзотермические Сконцентрированные), образу¬ющиеся с выделением тепла (дН^ 0).
Процессу образования раствора водорода в металле пред¬шествуют диссоциация молекул водорода на атомы Н2 2Ht, хемадоорбция атомов на поверхности металла» их дийпфузия вглубь металла и фиксация атомов в определённых положениях внутри кристаллической решетки• Полагают» что в большинстве металлов водород образует растворы внедрения, однако не ис¬ключена вероятность образования и растворов замещения.
Эндотермические растворы образуются в следующих метал¬лах: Al, C u, Mg, Fe, Ca
Когда между парциальным давлением водорода в окружающей ореде и растворенным в металле водородом наступает равнове¬сие при постоянной температуре, щ цесс растворения водорода прекращается. Однако следует иметь в ЕИДУ, что равновесие но¬сит характер динамического. Равновесная концентрация водоро¬да в насыщенном растворе при данной температуре и данном пар-циальном давлении водорода называется растворимостью 2>н .
В случае,: когда концентрация водород Сн (т. е дей- ' ствительное содержание водорода в растворе) меньше его равно¬весной растворимости при данных условиях Сн имеет место ненасыщенный раствор.
При обратном соотношении (С н >5И) имеет, место пересыщеный
раствор водорода в металла.
Растворимость (S н) чаще всего выражается в см3 водорода. приходящихся на 100 грамм металла, Процесо образования раст водороде и металлах сопровождается уменьшением объёма.
Поэтому с увеличением парциального Давления водорода растворимость
водорода должна увеличиваться. Влияние давления на растворимость описывается уравнением Сивертса:
![]()
;
Эндотермические растворы образуются с поглощением тепла, поэтому с повышением температуры 'растворимость водорода в металле должна возрастать.
![]()
Где С-коэффициент,зависящий от рода металла, его агре- гатного состояния и единиц измерения Рн2- парциальное давление водорода; T-температура в градусах Кельвина Д H- тепловой эффект процесса растворения
![]()
![]() -
парциальная молярная теплота растворения
водорода
-
парциальная молярная теплота растворения
водорода
![]() -
теплота диссоциации водорода
-
теплота диссоциации водорода
Обычно >> , При этом
>0, а <0
И
поэтому
![]()
Логарифмируя уравнения растворимости в водороде, получаем:

Обозначим
![]()
![]() ,
то уравнение примет вид:
,
то уравнение примет вид:
![]()
Для ряда металлов и сплавов значения коэффициентов А и В приводятся в справочниках (таблица 4).
С увеличением температуры растёт. При этом влияние темпера- туры на растворимость водорода в твёрдом и расплавленном металле проявляется в различной степени. Переход металла из твердого состояния в жидкое при температуре плавления сопровождается скачкообразным изменением растворимости водорода (рис.81).
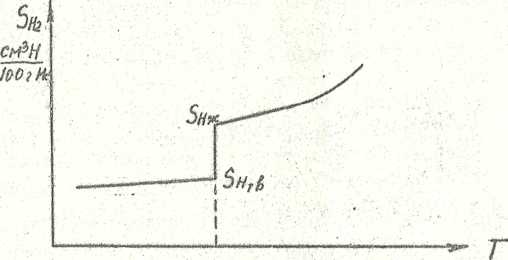
Рис.8.1. Изобара растворимости водорода в металле при образовании эндотермических растворов
Поскольку процесс абсорбции растворения обратим, тс при охлаждении металла растворимость будет уменьшаться и растворённый"в металле водород может выделяться is раство- ра (при условии Cн> Sн). В период кристаллизации металла из-за резкого снижения растворимости в нём водорода послед-, нйй будет интенсивно выделяться из раствора, образуя большое количество пузырьков. Поскольку в этот же период вязкость металла
существенно увеличивается возможно образование каркаса из затвердевающего металла, и значительная часть пузырьков водорода остается в металле, образуя газовую пористость. Beроятность
образования пористости, в различных металах можно оценить по величине степени пересыщенности.
![]()
Рл Для практических целей и спользуют выражение:
![]()
где Сна - действительное содержание водорода в конкретном случае.
Обычно да практике Ch*<Sh* т.к. растворимость водорода в металле , если это особо не оговорено, даётся в расчёте на = 760 мм рт.ст. В действительности же такое парциальное давление водорода в окружающей металл среде практически никогда не достигается.
Поэтому необходимо уметь рассчитывать содержание или растворимость водорода в конкретном металле. Поскольку растворимость водорода в твердых и жидких металлах в различной степени зависит от температуры, в таблицах приведены коэффициенты для жидкого и твердого состояния.
где СНА - действительное содержание водорода в конкретном случае.
Обычно да практике Ch*<Sh* т.к. растворимость водорода в металле , если это особо не оговорено, даётся в расчёте на = 760 мм рт.ст. В действительности же такое парциальное давление водорода в окружающей металл среде практически никогда не достигается.
Поэтому необходимо уметь рассчитывать содержание или растворимость ВОДОРОДА в конкретном металле. Поскольку растворимость водорода в твердых и жидких металлах в различной степени зависит от температуры, в таблицах приведены коэффициенты для жидкого и твердого состояния.
Контрольные вопросы
1.Какой вид взаимодействия с металлом наиболее характерен для водорода?
2.Какие виды взаимодействия газа с металлом предшествуют процессу образования раствора газа в металле?
3.Какие растворы образует водород в металлах?
4.Чем характерен процесс образования эндотермического раствора водорода в металле?
5.Чем характерен процесс образования экзотермического раствора водорода в металле?
6.Назовите примеры металлов, образующих с водородом эндотермический раствор?
7.Что понимается под растворимостью водорода в металле?
8.Какой раствор водорода б металле называется ненасыщенным? '
9. Какой раствор водорода з металле называется перенесшие иным?
10.Каким уравнением описывается влияние парциального давления водорода на его растворимость в металле?
11.Какое уравнение описывает совместное влияние температуры и давления на растворимость водорода в металлах?
12. Какое уравнение позволяет рассчитать растворимость водорода при использовании табличных коэффициентов А и В?
13. Как выглядит изобара, растворимости водорода в металлах при эндотермической растворимости водорода?
14. В какой период охлаждения металла наблюдается наиболее интенсивное выделение водорода из раствора?
15. Какую опасность создает водород; выделяющийся аз раствора?
16.что вложено в понятие степени пересыщенности водорода в растворе?
17. Что характеризует степень пересыщенности водорода в металле?
Пример расчёта растворимости водорода в металле при образовании эндотермических растворов
Задача
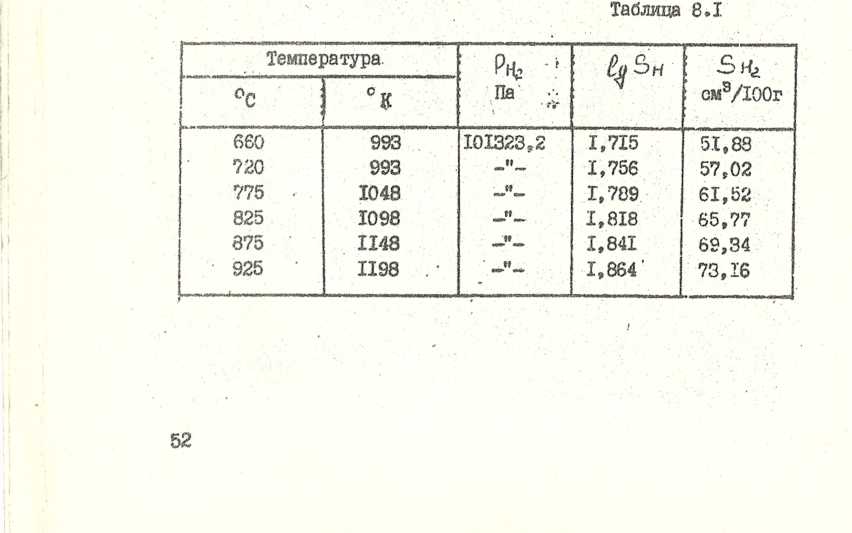
Рассчитать растворимость водорода в магнии при парциальном давлении водорода, равном 101323,2 Па (760 мм рт.ст.) при температурах 660°С, 720°С, 715°С, 825°С, 875°0 и 925°С.
Решение
1.Из таблицы 14 приложения, находим коэффициенты для уравнения растворимости водорода в магнии в зависимости от температуры. Все заданные температуры -лежат в области температур для жидкого магния А = 631;. B=0,112.Давление выражено в Па.
2.Рассчитываем растворимость водорода в магнии при заданных температурах.


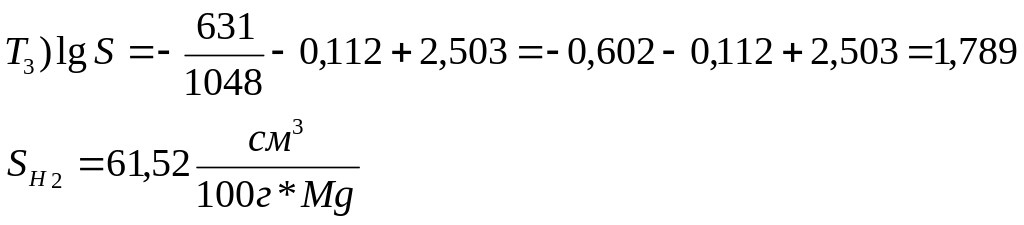



3. Сводим полученные при расчёте данные в таблицу 8.1
4. По полученным данным строим изобару растворимости водорода в магнии в интервале заданных температур (рис. 8.2)
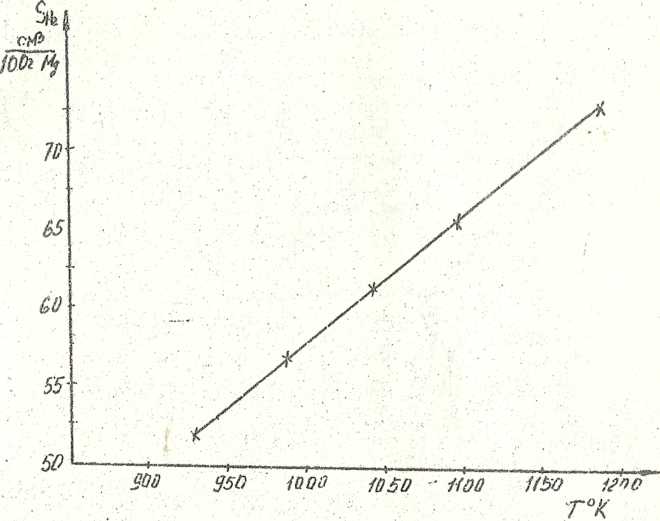
Рис. 8.2. Изобара растворимости водорода в магнии.
Приложение
ТАБЛИЦЫ ДАННЫХ ЛЛЯ ТЕРМОДИНАМИЧЕСКИХ РАСЧЁТОВ МЕТАЛЛУРГИЧЕСКИХ РЕАКЦИЙ
Система обозначений, принятая в таблицах:
![]() -Молярная
теплоемкость, Дж/моль
-Молярная
теплоемкость, Дж/моль
![]() -свободная
энергия образования соединения или
свободная энергия реакции, Дж
-свободная
энергия образования соединения или
свободная энергия реакции, Дж
![]() -
теплота образования соединений или
теплота реакции при 25С и давлении, равном
1 атм
-
теплота образования соединений или
теплота реакции при 25С и давлении, равном
1 атм
![]() -
Теплота растворения, ДЖ/моль
-
Теплота растворения, ДЖ/моль
![]() -
стандартная энтропия образования
соединения или реакции, Дж/К
-
стандартная энтропия образования
соединения или реакции, Дж/К
![]() -
парциальная молярная теплота растворения,
Дж/моль
-
парциальная молярная теплота растворения,
Дж/моль
![]() -
парциальная молярная энтропия растворения,
Дж/К*моль.
-
парциальная молярная энтропия растворения,
Дж/К*моль.
Примечание: 1 Дж=4,1868 кал.
Основные термодинамические уравнения
![]() уравнение
Гиббса-Гельмгольца
уравнение
Гиббса-Гельмгольца
![]()
Уравнение Кирхгофа
![]() уравнение
Вант-Гоффа
уравнение
Вант-Гоффа
![]()
уравнение Вант-Гоффа
![]() уравнение
Клаузиуса-Клайперона
уравнение
Клаузиуса-Клайперона
![]() уравнение
Кирхгофа
уравнение
Кирхгофа
![]()
Таблица 1
Значения некоторых физических постоянных

Таблица 2
Соотношение между различными единицами энергии
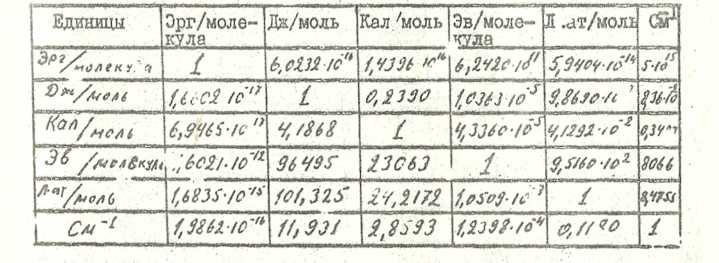
Таблица 3
Значения универсальной газовой постоянной в различных единицах.

Таблица 4
Основное свойства некоторых элементов и химических соединений

Продолжение таблицы 4
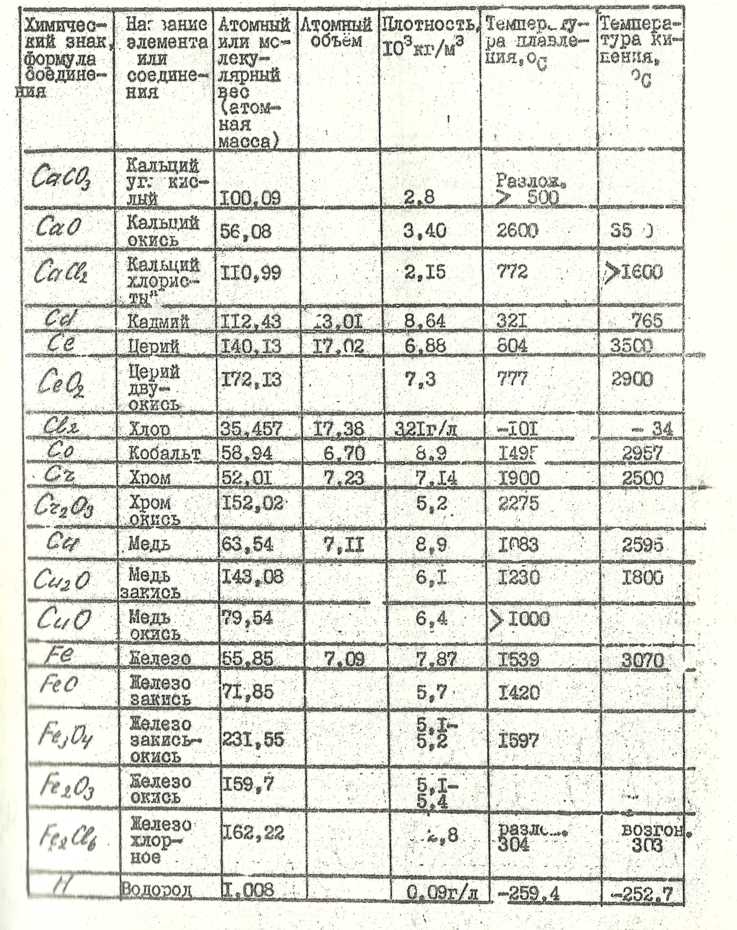
Продолжение таблицы 4

Продолжение таблицы 4

Продолжение таблицы 4
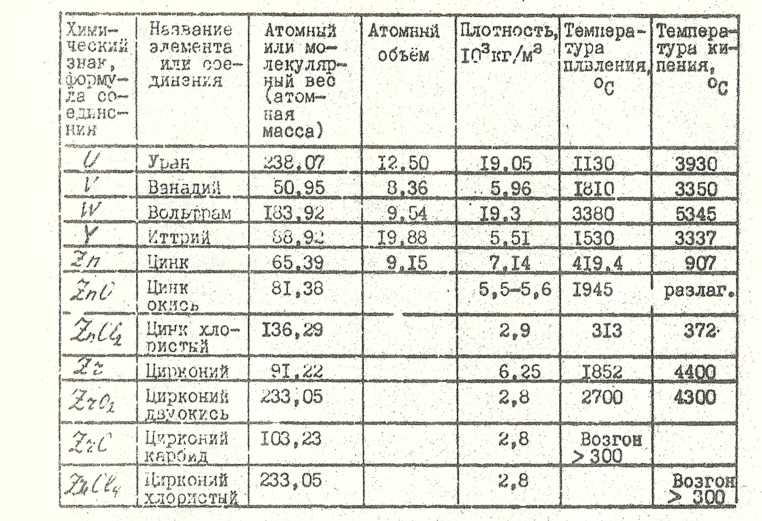
Таблица 5
Основные термодинамические величины для элементов и соединений.
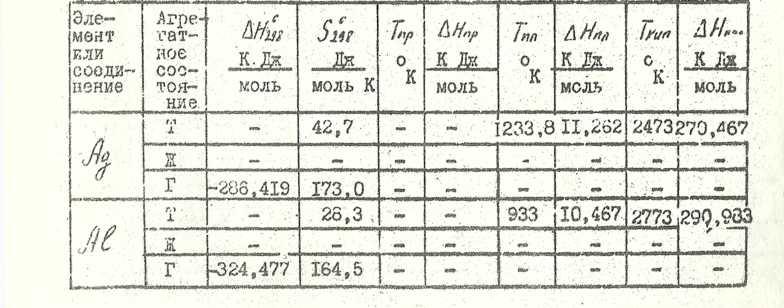
Продолжение таблицы 5
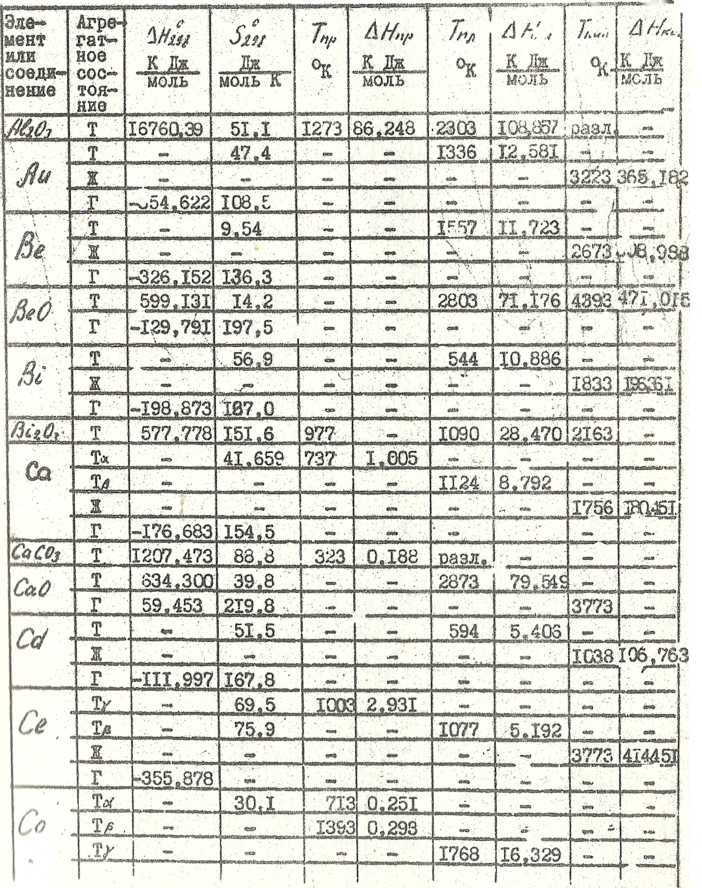
Продолжение таблицы 5

Продолжение таблицы 5
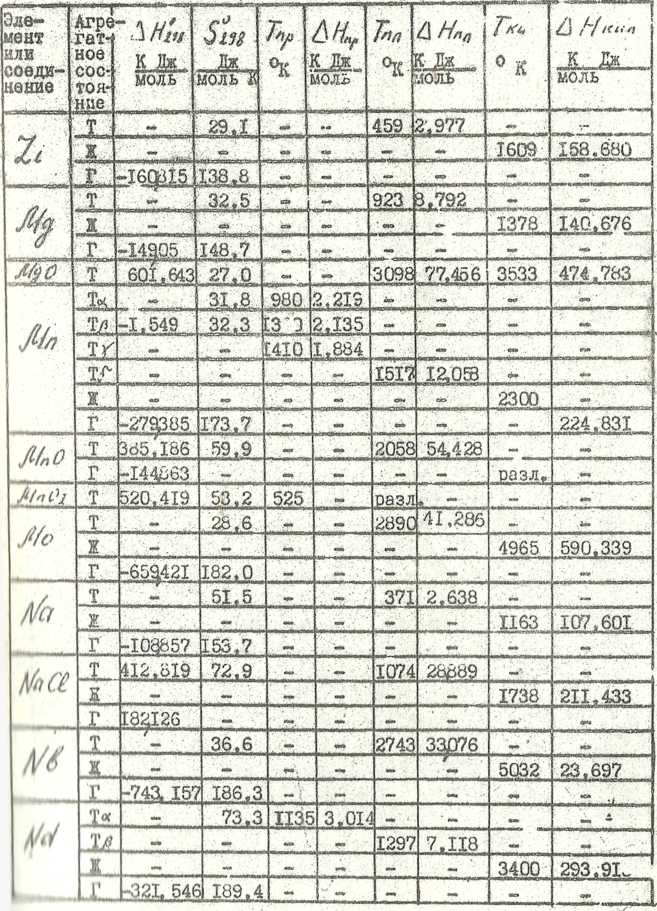
Продолжение таблицы 5
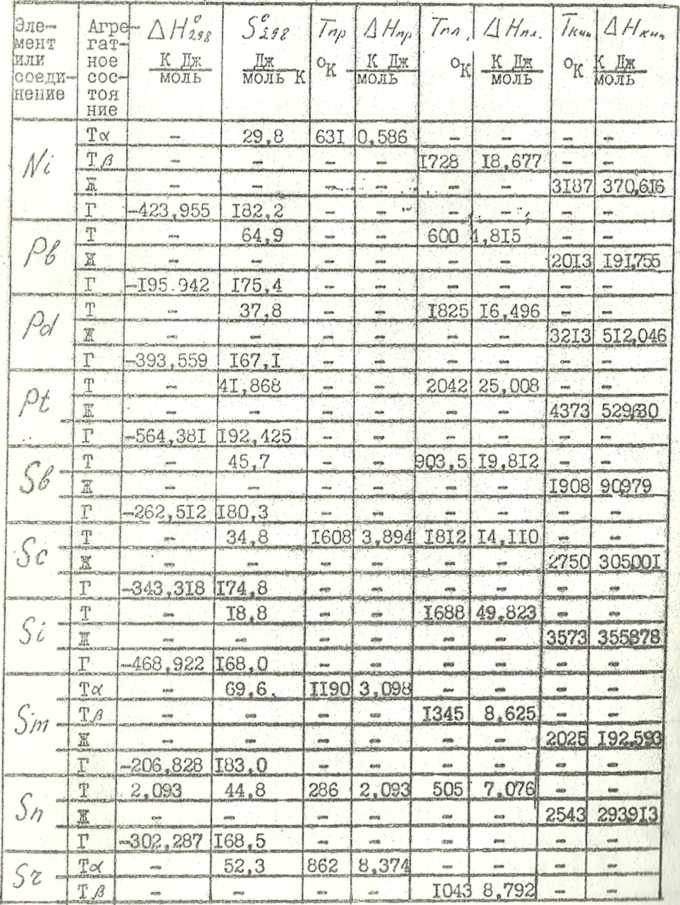
Продолжение таблицы 5

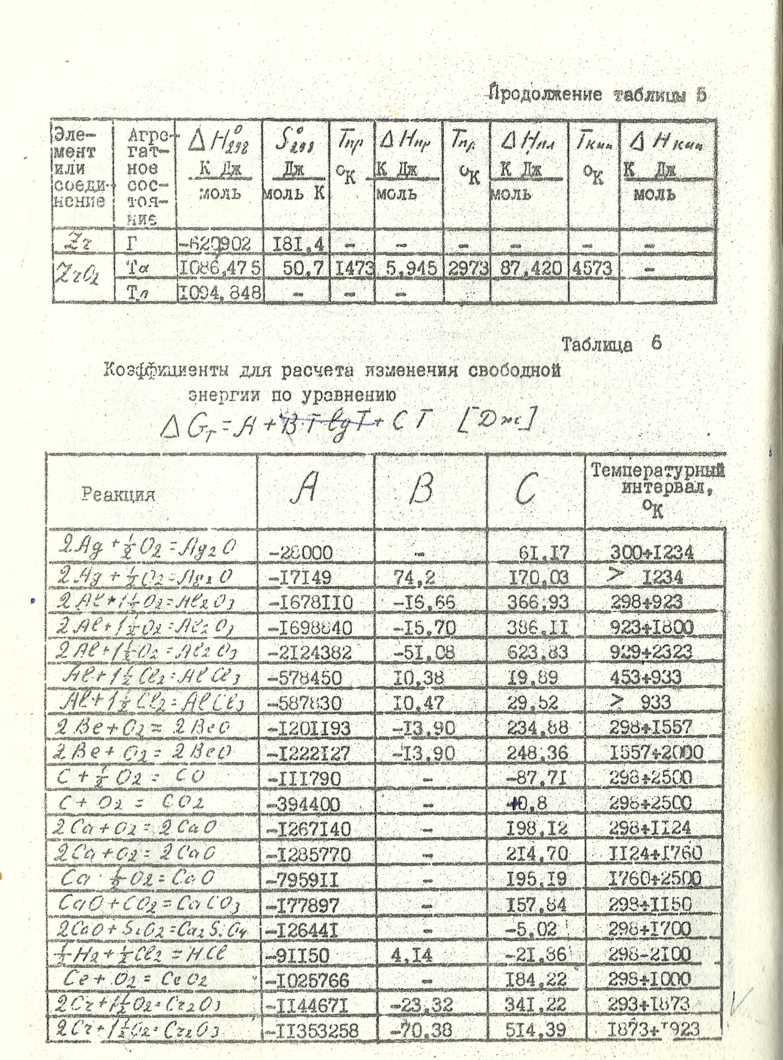
![]()
Продолжение таблицы 6
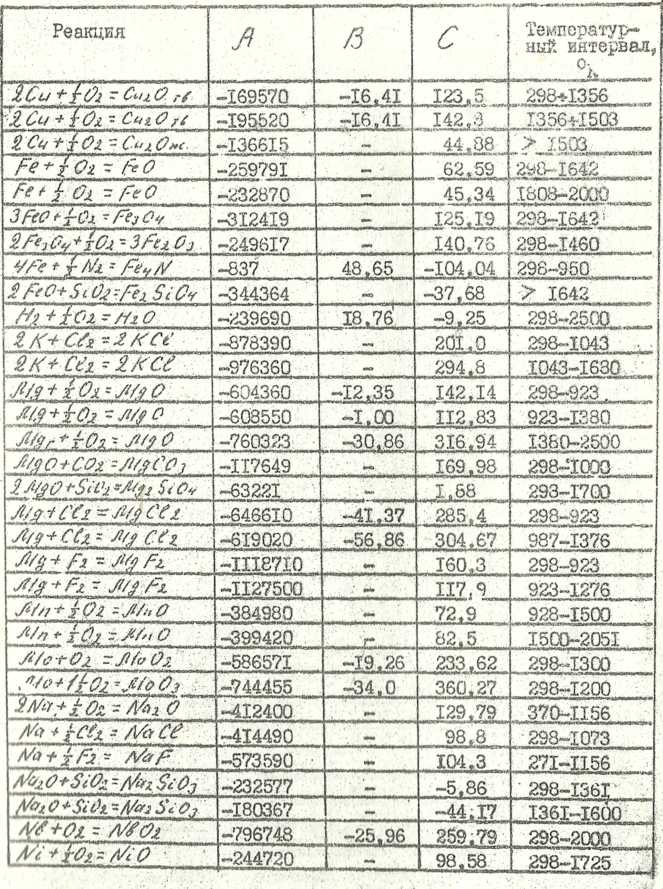
Продолжение таблицы 6
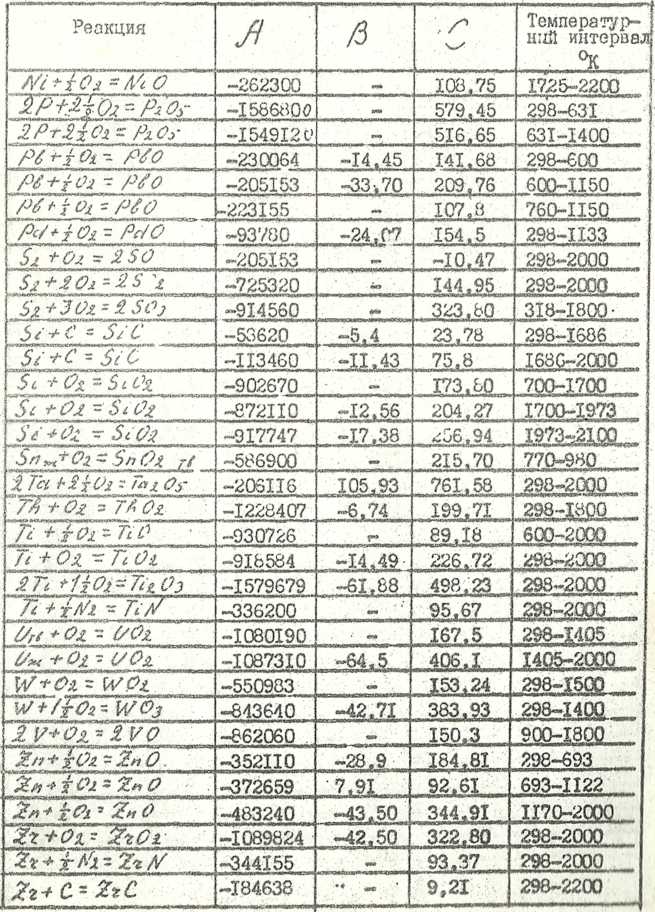
![]()
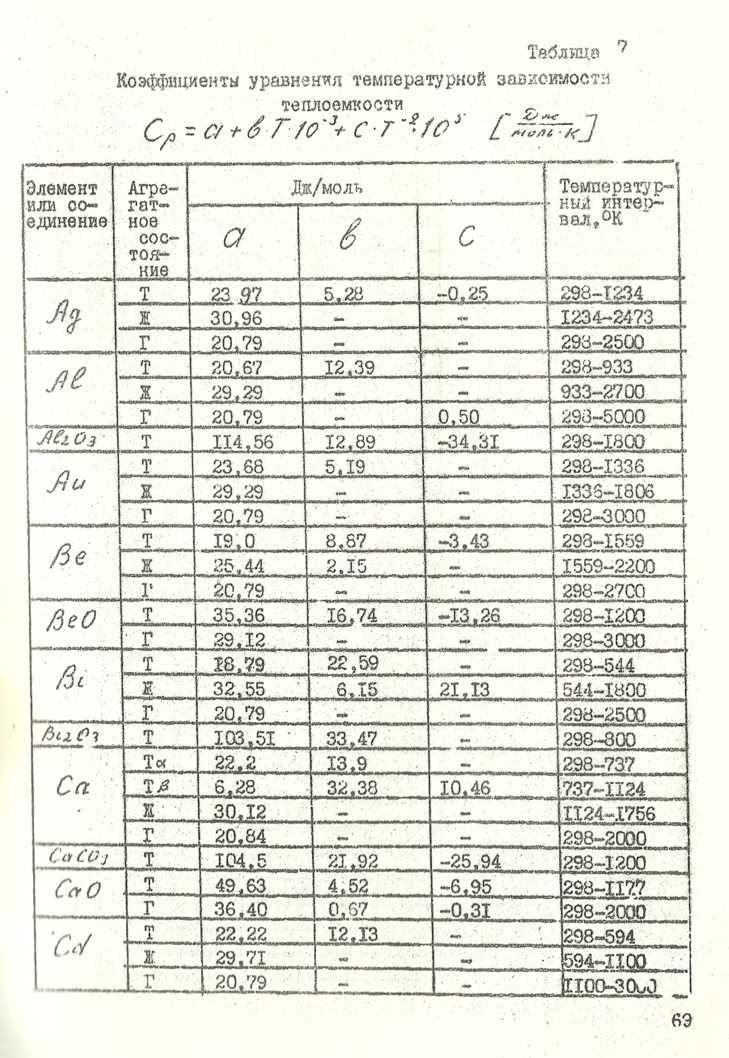
Продолжение таблицы 7
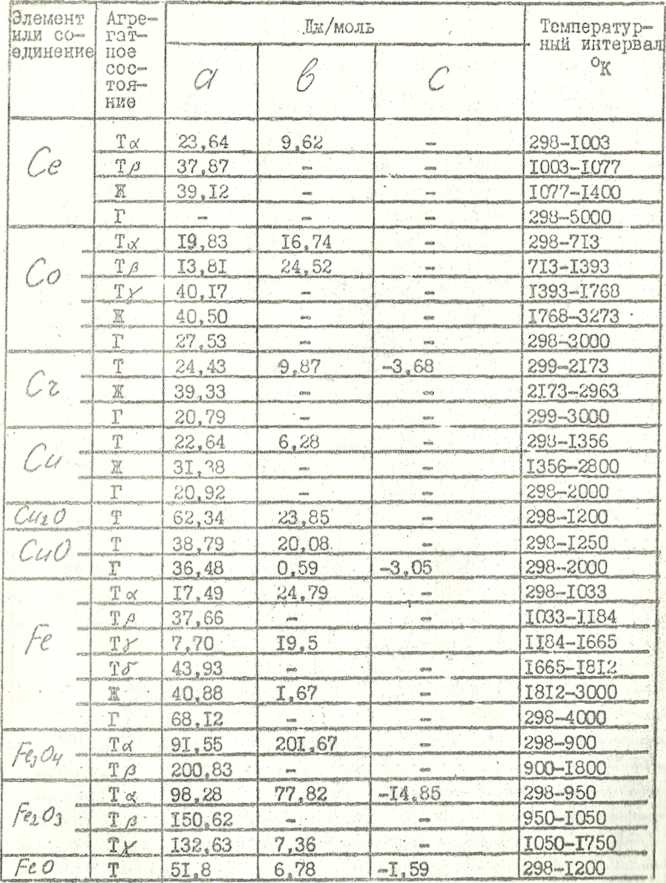
Продолжение таблицы 7
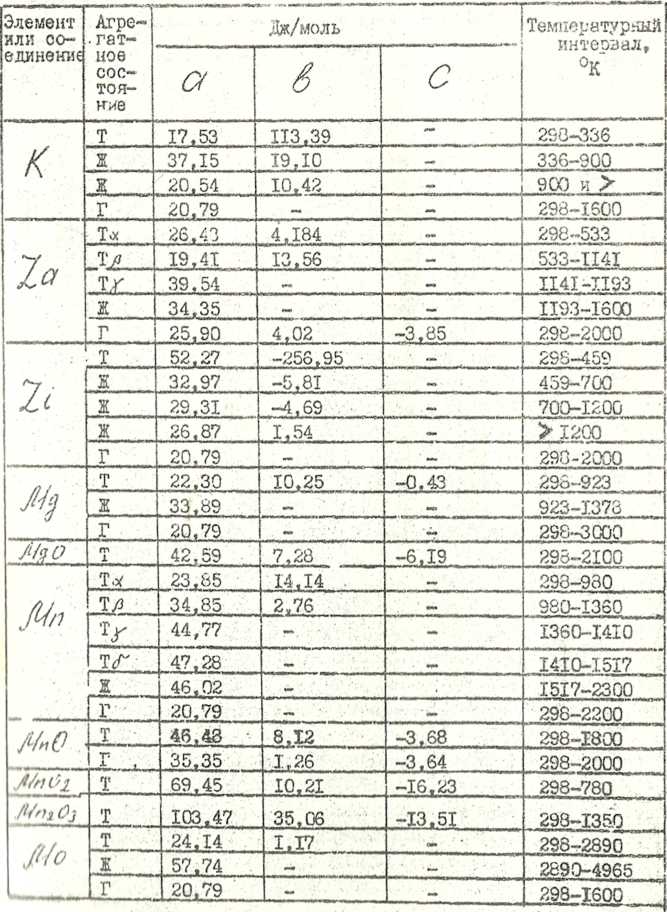
Продолжение таблицы 7

Продолжение таблицы 7
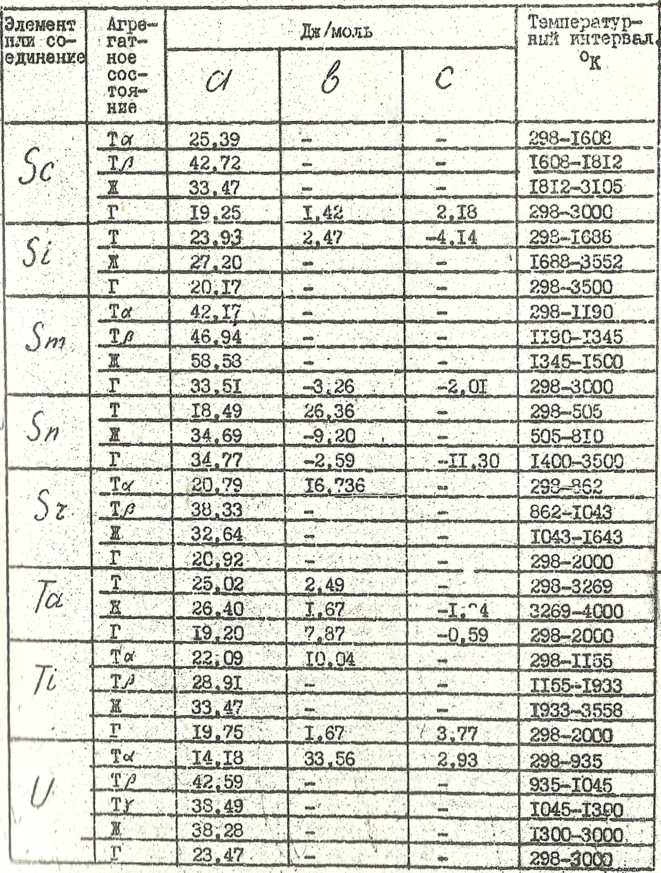
Продолжение таблицы 7
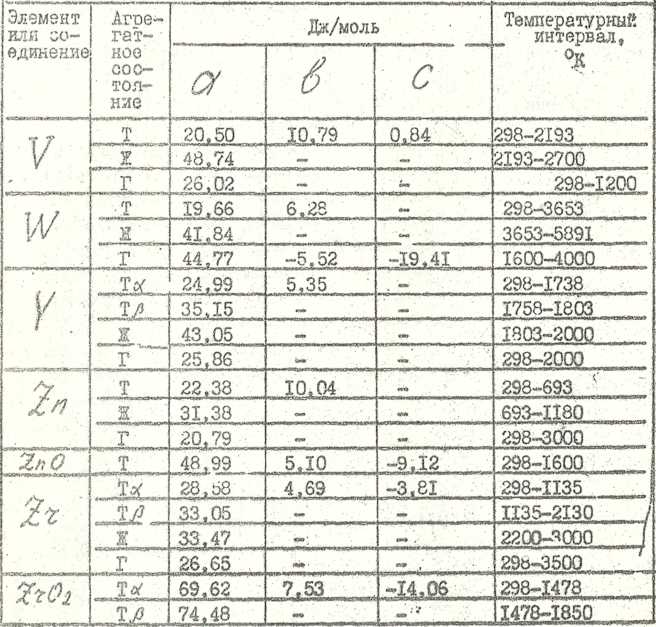
![]()
для расчета давления пара чистых веществ и некоторых соединений

Продолжение таблицы 6
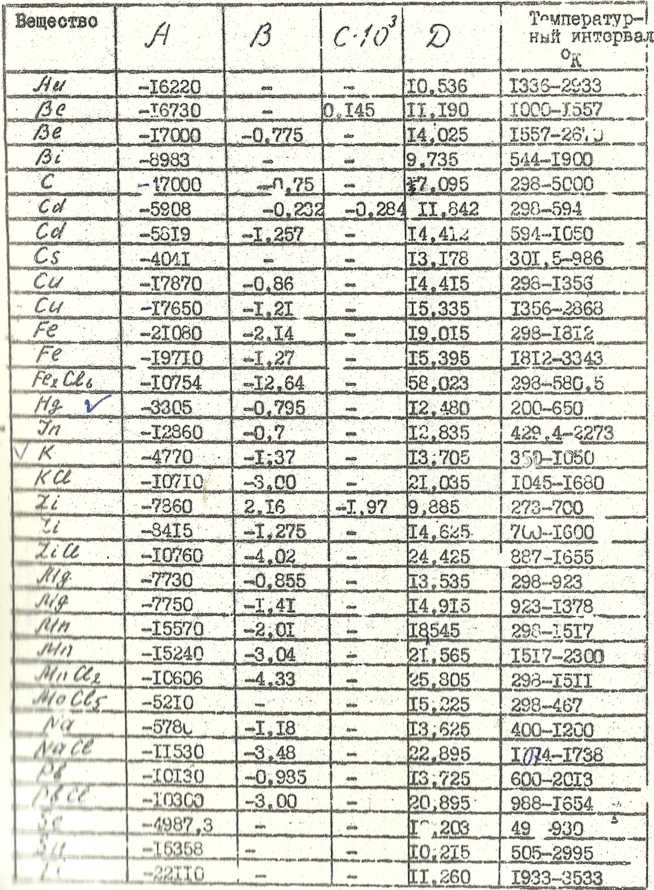
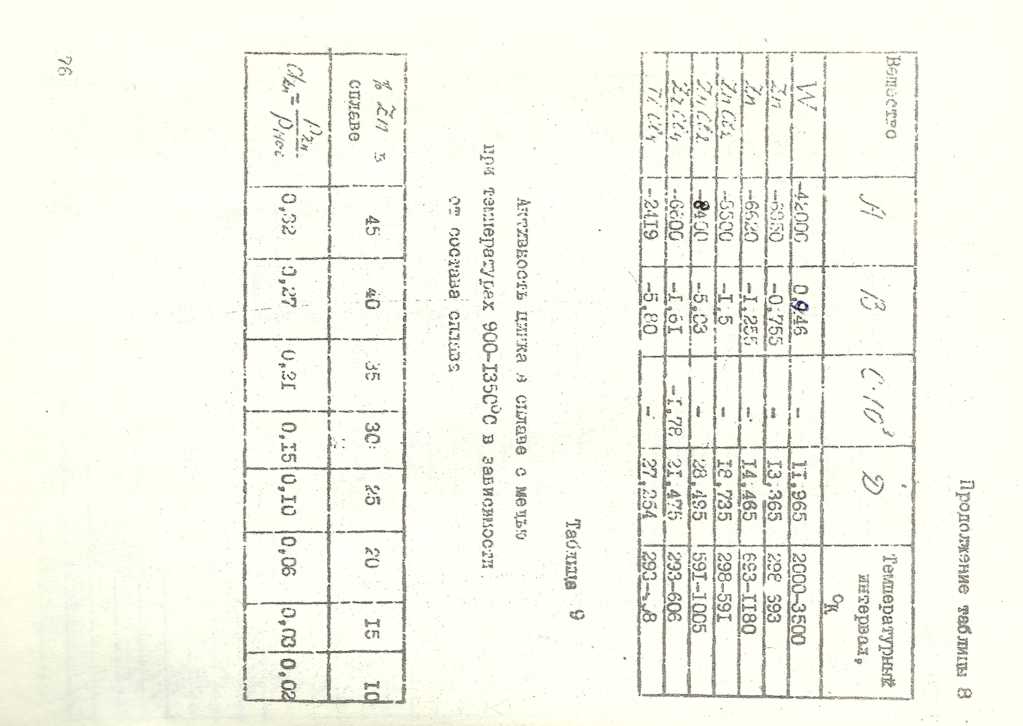
Таблица 10
Термодинамические данные для бинарных систем с непрерывной взаимной растворимостью в зависимости от мольной доли растворенного элемента
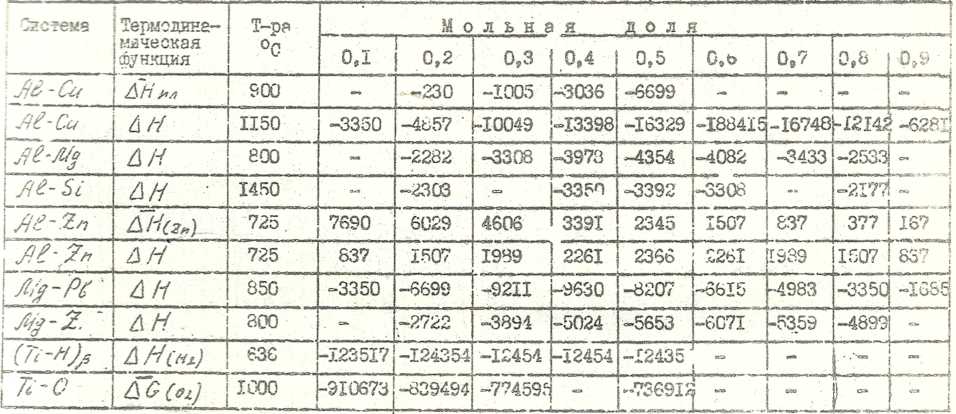
Таблица 11
Термодинамические данные для разбавленных растворов
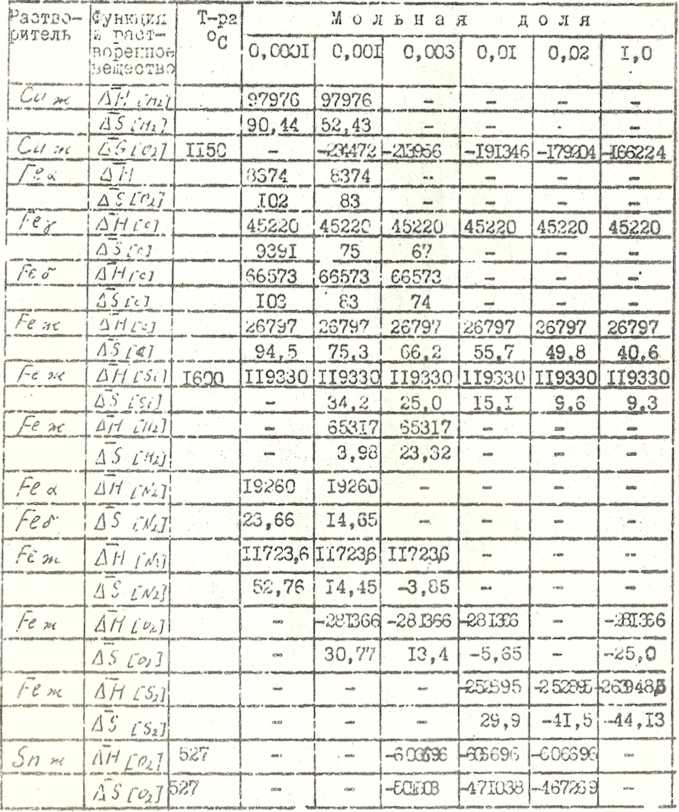
Таблица 12
